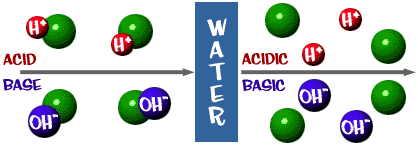
Să privim acum imaginea de ansamblu. Există o scală pentru acizi și baze, la fel ca pentru orice altceva. Iată câteva definiții pe care ar trebui să le cunoașteți:
Acid: O soluție care are un exces de ioni H+. Provine din cuvântul latin acidus, care înseamnă „ascuțit” sau „acru”.
Bază: O soluție care are un exces de ioni OH-. Un alt cuvânt pentru bază este alcalin.
Acuos: O soluție care este în principal apă. Gândiți-vă la cuvântul acvariu. AQUA înseamnă apă.
Acid puternic: Un acid care are un pH foarte scăzut (0-4).
Bază puternică: O bază care are un pH foarte ridicat (10-14).
Acid slab: Un acid care se ionizează doar parțial într-o soluție apoasă. Acest lucru înseamnă că nu toate moleculele se despart. Acizii slabi au de obicei un pH apropiat de 7 (3-6).
Bază slabă: O bază care se ionizează doar parțial într-o soluție apoasă. Acest lucru înseamnă că nu toate moleculele se despart. Bazele slabe au de obicei un pH apropiat de 7 (8-10).
Neutru: O soluție care are un pH de 7. Nu este nici acidă, nici bazică.
V-am povestit despre tipul acela, Arrhenius, și ideile sale despre concentrațiile ionilor de hidrogen și hidroxid. Veți învăța, de asemenea, despre ideile lui Brønsted-Lowry. Acești doi chimiști din Danemarca și Anglia au privit acizii ca donatori și bazele ca acceptori. Ce donau și ce acceptau ei? Ioni de hidrogen. Seamănă foarte mult cu prima definiție pe care am dat-o, în care un acid se descompune și eliberează/donă un ion de hidrogen. Această definiție mai nouă este un pic mai detaliată. Oamenii de știință au folosit noua definiție pentru a descrie mai multe baze, cum ar fi amoniacul (NH3). Deoarece bazele sunt acceptoare de protoni, atunci când amoniacul a fost văzut acceptând un H+ și creând un ion de amoniu (NH4+), ar putea fi etichetat ca bază. Nu mai trebuia să vă faceți griji cu privire la ionii de hidroxid. Dacă primea H+ de la o moleculă de apă, atunci apa (H2O) era donatorul de protoni. Asta înseamnă că apa a fost acidul în această situație? Da.
Un chimist pe nume Lewis a oferit un al treilea mod de a privi acizii și bazele. În loc să se uite la ionii de hidrogen, el s-a uitat la perechile de electroni (vă amintiți imaginile noastre cu structuri de puncte din Atomii și elementele?). În viziunea lui Lewis, acizii acceptă perechi de electroni, iar bazele donează perechi de electroni. Știm că ambele descrieri ale acizilor și bazelor folosesc termeni complet opuși, dar ideea este aceeași. Ionii de hidrogen doresc în continuare să accepte doi electroni pentru a forma o legătură. Bazele vor să îi cedeze. În general, definiția lui Lewis a reușit să clasifice și mai mulți compuși ca fiind acizi sau baze.
Ce se întâmplă cu adevărat?
Ce se întâmplă cu adevărat în aceste soluții? Aici lucrurile devin puțin mai complicate. Să ne uităm încă o dată la descompunerea moleculelor în soluțiile apoase (pe bază de apă) pentru o măsură bună. Acizii sunt compuși care se disociază (se rup) în ioni de hidrogen (H+) și un alt compus atunci când sunt plasați într-o soluție apoasă. Vă amintiți exemplul cu acidul acetic? Bazele sunt compuși care se descompun în ioni de hidroxid (OH-) și un alt compus atunci când sunt plasați într-o soluție apoasă. Vom vorbi despre bicarbonatul de sodiu în câteva paragrafe.
Să schimbăm puțin formularea. Dacă aveți un compus ionic/electrovalent și îl puneți în apă, acesta se va descompune în doi ioni. Dacă unul dintre acești ioni este H+, soluția este acidă. Acidul puternic clorură de hidrogen (HCl) este un exemplu. Dacă unul dintre ioni este OH-, soluția este bazică. Un exemplu de bază puternică este hidroxidul de sodiu (NaOH). Există și alți ioni care formează soluții acide și bazice, dar nu vom vorbi despre ei aici.
Scala de pH despre care am vorbit este de fapt o măsură a numărului de ioni H+ dintr-o soluție. Dacă sunt foarte mulți ioni H+, pH-ul este foarte scăzut. Dacă sunt foarte mulți ioni OH- în comparație cu numărul de ioni H+, pH-ul este ridicat.
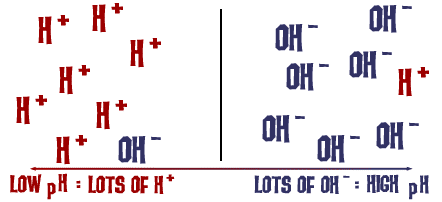
Gândiți-vă la această idee pentru o secundă: De ce un lichid cu niveluri ridicate de NaOH ar fi foarte bazic, dar periculos în același timp? Legătura Na-OH se rupe în soluție și aveți ioni de sodiu (pozitivi) și ioni de hidroxid (negativi). Ionii de sodiu nu reprezintă cu adevărat un pericol în soluție, dar există un număr foarte mare de ioni de hidroxid în soluție în comparație cu ionii de hidrogen care ar putea pluti în jur sub formă de H3O+ (un ion de hidroniu).Toți acești ioni OH- în exces fac ca pH-ul să fie foarte ridicat, iar soluția va reacționa cu ușurință cu mulți compuși. Același lucru se întâmplă la o scară mai puțin periculoasă atunci când adăugați bicarbonat de sodiu în apă. În timpul disocierii, în soluție se eliberează ioni OH- și acid carbonic. Numărul de ioni OH- este mai mare decât numărul de ioni H3O+ (H+ și H2O), iar pH-ul crește. Doar că nu este o diferență la fel de puternică ca în cazul hidroxidului de sodiu.
În principiu, asta este. (Ha ha ha! V-ați prins?)
Mai multe informații în prima parte.
Video conex…
Encyclopædia Britannica: Baze
Wikipedia: Acizi
Wikipedia: Baze
Enciclopedia.com: Acizi
Encyclopedia.com: Baze
.