Lärandemål
- Identifiera alkaner, alkener, alkyner och aromatiska föreningar.
- Nämn några egenskaper hos kolväten.
De enklaste organiska föreningarna är de som består av endast två grundämnen: kol och väte. Dessa föreningar kallas för kolväten. Kolväten i sig delas in i två typer: alifatiska kolväten och aromatiska kolväten. Alifatiska kolväten är kolväten som bygger på kedjor av C-atomer. Det finns tre typer av alifatiska kolväten. Alkaner är alifatiska kolväten med endast enkla kovalenta bindningar. Alkener är alifatiska kolväten som innehåller minst en C-C dubbelbindning och alkyner är alifatiska kolväten som innehåller en C-C trippelbindning. Ibland finner vi ett alifatiskt kolväte med en ring av C-atomer; dessa kolväten kallas cykloalkaner (eller cykloalkener eller cykloalkyner).
Aromatiska kolväten, som bensen, är platta ringsystem som innehåller kontinuerligt överlappande p-orbitaler.Elektroner i bensenringen har speciella energetiska egenskaper som ger bensen fysikaliska och kemiska egenskaper som skiljer sig markant från alkaner. Ursprungligen användes termen aromatisk för att beskriva denna klass av föreningar eftersom de var särskilt väldoftande. I modern kemi betecknar dock termen aromatisk förekomsten av en mycket stabil ring som ger molekylen olika och unika egenskaper.
De enklaste alkanerna har sina C-atomer bundna i en rak kedja; dessa kallas normala alkaner. De benämns efter antalet C-atomer i kedjan. Den minsta alkanen är metan:
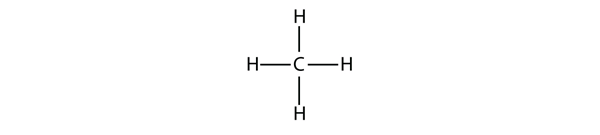
Figur 16.1 Tredimensionell representation av metan

För att skapa fyra kovalenta bindningar binder C-atomen till fyra H-atomer, vilket ger molekylformeln för metan CH4. Det tvådimensionella diagrammet för metan är dock missvisande; de fyra kovalenta bindningarna som C-atomen gör är orienterade tredimensionellt mot hörnen i en tetraeder. En bättre representation av metanmolekylen visas i figur 16.1 ”Three-Dimensional Representation of Methane”
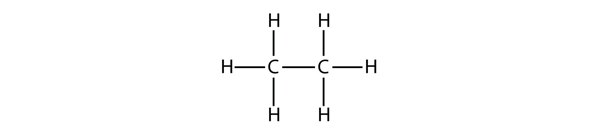
Den näst största alkanen har två C-atomer som är kovalent bundna till varandra. För att varje C-atom ska göra fyra kovalenta bindningar måste varje C-atom vara bunden till tre H-atomer. Den resulterande molekylen, vars formel är C2H6, är etan:
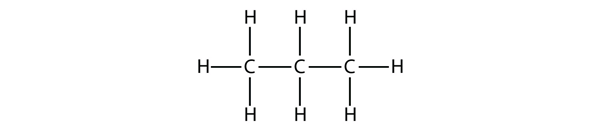
Propan har en ryggrad av tre C-atomer omgivna av H-atomer. Du bör kunna verifiera att molekylformeln för propan är C3H8:
De diagram som vi hittills har sett för alkaner är ganska enkla Lewisstrukturer. När molekylerna blir större blir dock Lewisstrukturerna mer och mer komplexa. Ett sätt att kringgå detta är att använda en kondenserad struktur,som listar formeln för varje C-atom i molekylens ryggrad. Den kondenserade strukturen för etan är till exempel CH3CH3, medan den är CH3CH2CH3 för propan. I tabell 16.1 ”De tio första alkanerna” anges molekylformlerna, de kondenserade strukturformlerna och namnen på de tio första alkanerna.
Tabell 16.1 De 10 första alkanerna
| Molekylformel | kondenserad strukturformel | namn |
|---|---|---|
| CH4 | CH4 | metan |
| C2H6 | CH3CH3 | etan |
| C3H8 | CH3CH3CH2CH3 | propan |
| C4H10 | CH3CH3CH2CH2CH3 | butan |
| C5H12 | CH3CH3CH2CH2CH2CH3 | pentan |
| C6H14 | CH3(CH2)4CH3 | hexan |
| C7H16 | CH3(CH2)5CH3 | heptan |
| C8H18 | CH3(CH2)6CH3 | oktan |
| C9H20 | CH3(CH2)7CH3 | nonan |
| C10H22 | CH3(CH2)8CH3 | dekan |
För att alkaner har det maximala antalet H-atomer som är möjligt enligt reglerna för kovalenta bindningar, kallas alkaner också för mättade kolväten.
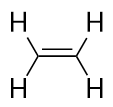
Alkaner har en C-C dubbelbindning. Eftersom de har mindre än det högsta möjliga antalet H-atomer kallas de omättade kolväten. Den minsta alkenenetenen har två C-atomer och är också känd under sitt vanliga namn, eten:
Den näst största alkenenetenen-propenen har tre C-atomer med en C-C dubbelbindning mellan två av C-atomerna. Den är också känd som propylen:
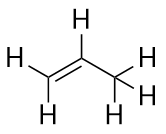
Vad lägger du märke till när det gäller namnen på alkaner och alkener? Namnen på alkener är desamma som deras motsvarande alkaner förutom att suffixet (ändelsen) är -en i stället för -an. Att använda en stam som kallas moderkedja för att ange antalet C-atomer i en molekyl och en ändelse för att representera typen av organisk förening är vanligt i organisk kemi, som vi ska se.
Med introduktionen av nästa alken, buten, börjar vi se ett stort problem med organiska molekyler: valmöjligheter. Med fyra C-atomer kan C-C dubbelbindningen gå mellan den första och andra C-atomen eller mellan den andra och tredje C-atomen:
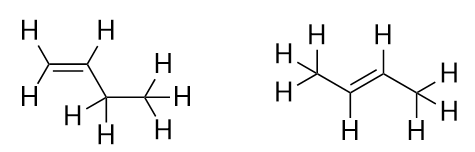
(En dubbelbindning mellan den tredje och fjärde C-atomen är samma sak som att ha den mellan den första och andra C-atomen, bara omvänt). Reglerna för namngivning i organisk kemi kräver att dessa två ämnen har olika namn. Den första molekylen heter but-1-en, medan den andra molekylen heter but-2-en. Siffran mellan moderkedjans namn och suffix kallas lokant och anger på vilket kol kol dubbelbindningen har sitt ursprung. Det lägsta möjliga talet används för att numrera en egenskap i en molekyl. Att kalla den andra molekylen but-3-ene skulle därför vara felaktigt. Nummer är vanliga delar av organiska kemiska namn eftersom de anger vilken C-atom i en kedja som innehåller en särskiljande egenskap. När dubbelbindningen (eller en annan funktionell grupp) är placerad på det första kolet är det vanligt att vissa författare utelämnar lokanten. Om t.ex. buten skrivs utan locant ska man anta att det avser but-1-ene, inte but-2-ene.
Föreningarna but-1-ene och but-2-ene har olika fysikaliska och kemiska egenskaper, även om de har samma molekylformel-C4H8. Olika molekyler med samma molekylformel kallas isomerer. Isomerer är vanliga i organisk kemi och bidrar till dess komplexitet.
Exempel 1
Baserat på namnen för butenmolekylerna, föreslå ett namn för denna molekyl.
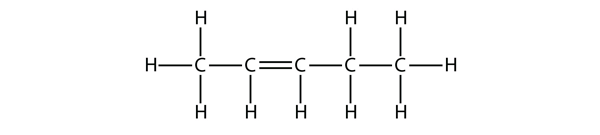
Lösning
Med fem C-atomer använder vi namnet penten, och med en C-C dubbelbindning är detta en alken, så denna molekyl är en penten. När vi numrerar C-atomerna använder vi siffran 2 eftersom det är den lägsta möjliga beteckningen. Så denna molekyl heter pent-2-ene.
Testa dig själv
Baserat på namnen för butenmolekylerna, föreslå ett namn för denna molekyl.
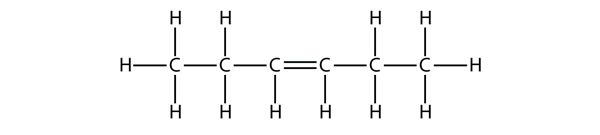
Svar
hex-3-en
Alkyner, med en C-C trippelbindning, benämns på samma sätt som alkener, förutom att deras namn slutar på -yne. Den minsta alkynen är etyne, som också kallas acetylen:
![]()
Propyne har denna struktur:
Med butyne måste vi börja numrera positionen för trippelbindningen, precis som vi gjorde med alkener:
Bensen är en aromatisk förening som består av sex C-atomer i en ring, med omväxlande enkla och dubbla C-C-bindningar:
De omväxlande enkla och dubbla C-C-bindningarna ger bensenringen en speciell stabilitet, och den reagerar inte som en alken som man skulle kunna förvänta sig.
Så grundläggande som kolvätena är för den organiska kemin, är deras egenskaper och kemiska reaktioner ganska vardagliga. De flesta kolväten är opolära på grund av C- och H-atomernas nära elektronegativitet. Som sådana löser de sig endast sparsamt i H2O och andra polära lösningsmedel. Små kolväten, som metan och etan, är gaser vid rumstemperatur, medan större kolväten, som hexan och oktan, är vätskor. Även större kolväten, som hentriacontan (C31H64), är fasta ämnen vid rumstemperatur och har en mjuk, vaxartad konsistens.
Kolväten är ganska oreaktiva, men de deltar i vissa klassiska kemiska reaktioner. En vanlig reaktion är substitution med en halogenatom genom att kombinera ett kolväte med en elementär halogen. Ljus används ibland för att främja reaktionen, till exempel denna mellan metan och klor:
Halogener kan också reagera med alkener och alkyner, men reaktionen är annorlunda. I dessa fall reagerar halogenmolekylerna med C-C dubbel- eller trippelbindningen och fäster på varje C-atom som är involverad i de flera bindningarna. Denna reaktion kallas för en additionsreaktion. Ett exempel är
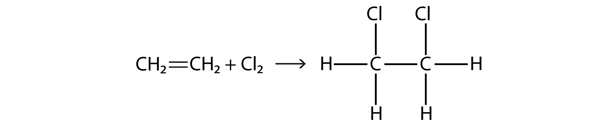
Reaktionsförhållandena är vanligtvis milda; i många fall reagerar halogenen spontant med en alken eller ett alkyn.
Väte kan också adderas över en multipelbindning; denna reaktion kallas en hydreringsreaktion. I detta fall är dock reaktionsförhållandena kanske inte milda; höga tryck av H2-gas kan vara nödvändiga. En platina- eller palladiumkatalysator används vanligen för att få reaktionen att fortskrida i rimlig takt:
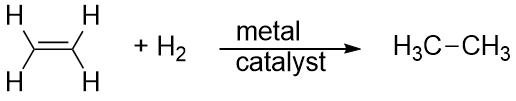
Den överlägset vanligaste reaktionen av kolväten är förbränning, vilket är kombinationen av ett kolväte med O2 för att göra CO2 och H2O. Förbränningen av kolväten åtföljs av ett frigörande av energi och är en primär källa till energiproduktion i vårt samhälle (figur 16.2 ”Förbränning”). Förbränningsreaktionen för till exempel bensin, som kan representeras av C8H18, är följande:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O + ~5060 kJ
Figur 16.2 Förbränning
