Los químicos aprecian los isótopos y los utilizan en la investigación básica y aplicada. Sin embargo, les preocupa más el movimiento de los electrones. Cuando un átomo gana o pierde electrones, se convierte en una especie cargada o en un ion. Cuando esto ocurre, el núcleo no se altera. En el caso de los átomos que pierden electrones, se produce una carga positiva global (#protones > #electrones). Los átomos que forman este tipo de iones se llaman cationes. Los átomos metálicos (situados en el lado izquierdo de la tabla periódica) siempre pierden electrones para convertirse en cationes.
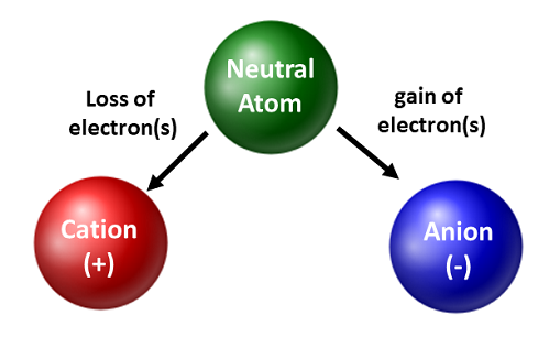
A diferencia de los átomos metálicos, los no metálicos ganan electrones para convertirse en aniones. Estos tipos de iones tienen una carga global negativa (#electrones > #protones). Con la excepción de los gases nobles, todos los átomos de la tabla periódica pierden o ganan electrones para conseguir estabilidad electrónica. Se producen diferentes tipos de enlaces cuando los átomos pierden, ganan o comparten electrones. Estos tipos de enlaces atómicos se discutirán más a fondo en el capítulo 4 de su libro de texto.
Interactivo: Construyendo un átomo
Construye un átomo con protones, neutrones y electrones, y observa cómo cambia el elemento, la carga y la masa. A continuación, realiza un juego para comprobar tus ideas
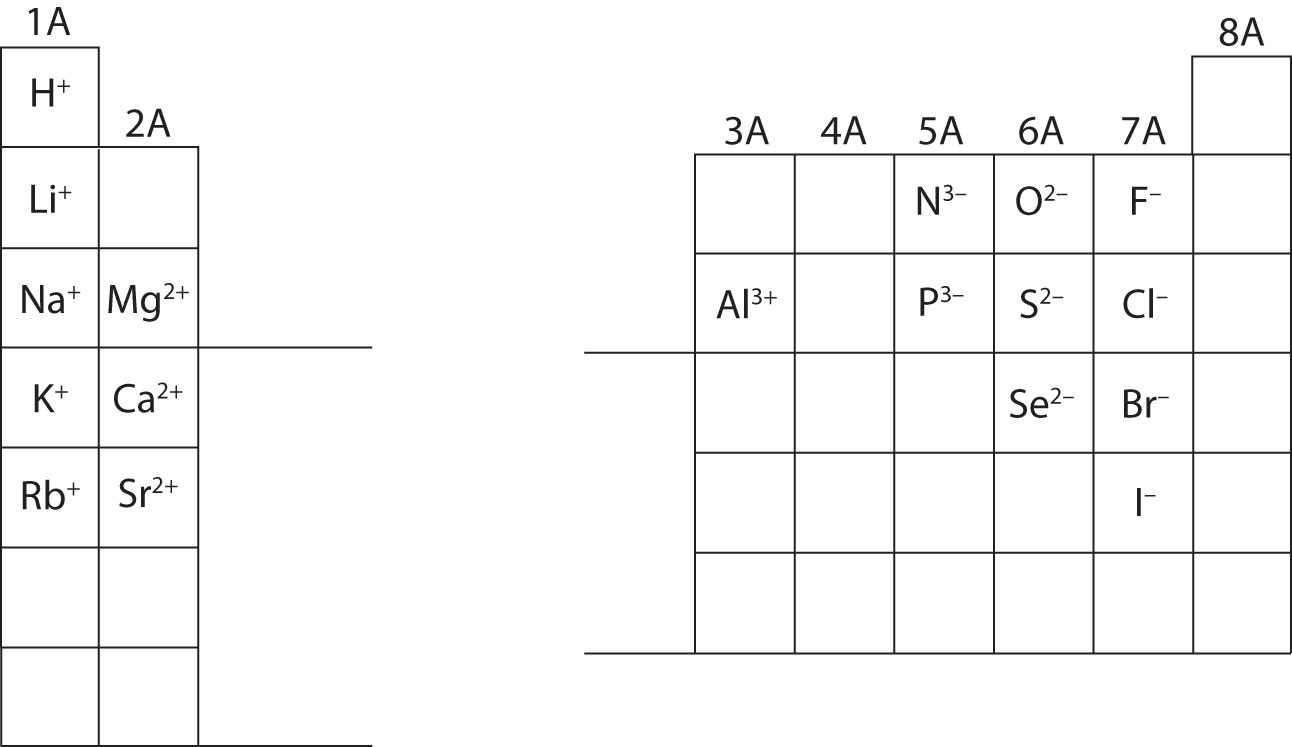
A estas alturas, deberías ser capaz de calcular todas las partículas subatómicas cuando se les da una carga iónica específica. Además, debes dominar las clasificaciones de los iones (reconociendo que los cationes son positivos y los aniones son negativos). La memorización de las cargas de iones específicos será necesaria cuando se trabaje en el capítulo 4 del libro de texto. Por ahora, las cargas de los iones serán proporcionadas y no deben ser memorizadas. Observe y aprecie las cargas iónicas de los elementos del grupo principal en la tabla periódica de abajo. Por último, los químicos no escriben un número para las cargas que implican el número uno (1). Para estas especies, sólo verá un signo + o -. Las cargas de mayor magnitud siempre tendrán un número asociado al símbolo elemental.
Ejemplo \(\PageIndex{1}): Clasificación ómica
Calcule las partículas subatómicas de las especies que aparecen a continuación utilizando la información de la figura \(\PageIndex{2}\N). Etiquete cada una como un átomo, catión o anión. Consulte la tabla periódica para conocer las masas, los números atómicos y las cargas específicas de los iones.
- Ión de aluminio
- Átomo de circonio
- Ión de azufre
Soluciones
- En el ion de aluminio hay 13 protones, 14 neutrones y 10 electrones. Este ion está cargado positivamente, lo que significa que ha perdido electrones y forma un catión.
- En el átomo de circonio hay 40 protones, 51 neutrones y 40 electrones. Este es un átomo que no tiene carga global.
- Hay 16 protones, 16 neutrones y 18 electrones en el ion de azufre. Este ión está cargado negativamente, lo que significa que ha ganado electrones y forma un anión.
Ejemplo \N(\NIndicePágina{2}): Anotaciones A/Z y masa de símbolos
Escribe las anotaciones A/Z y masa de símbolos para los iones/átomos de la pregunta anterior.
Soluciones
- (\ce{{27}_{13}Al^{3+}}) y Al-27
- (\ce{{91}_{40}Zr}}) y Zr-91
- (\ce{32}_{16}S}^{2-}\) y S-32
Si un átomo gana o pierde electrones esto debe ser representado en el formato A/Z. El formato símbolo-masa no muestra la carga de los iones. Recuerde que los neutrones y protones no se ven afectados por los cambios de electrones.
¿Necesita más práctica?
- Vaya a la Sección 3.E de este REA y trabaje los problemas #5 y #9.
Contribuidores
-
Elizabeth R. Gordon (Furman University)