Některé základní chemické vlastnosti mědi(I)
Disproporcionace iontů mědi(I) v roztoku
Chemie mědi(I) je omezena reakcí, která probíhá za účasti jednoduchých iontů mědi(I) v roztoku. To je dobrý příklad disproporcionace – reakce, při níž se něco oxiduje a redukuje.
Disproporcionací iontů mědi(I) v roztoku vznikají ionty mědi(II) a srážka mědi.
Reakce probíhá:
![]()
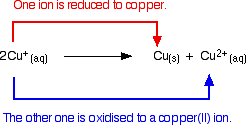
Každý pokus o výrobu jednoduché sloučeniny mědi(I) v roztoku vede k tomuto ději.
Pokud například reaguje oxid měďnatý(I) s horkou zředěnou kyselinou sírovou, lze očekávat, že vznikne roztok síranu měďnatého(I) a vody. Ve skutečnosti získáte hnědou sraženinu mědi a modrý roztok síranu měďnatého(II) v důsledku disproporcionační reakce.
![]()
![]()
Stabilizace oxidačního stavu mědi(I)
Nerozpustné sloučeniny mědi(I)
Již jsme viděli, že jodid měďnatý(I) vzniká jako bělavá sraženina, pokud do roztoku obsahujícího ionty mědi(II) přidáte roztok jodidu draselného. Jodid měďnatý(I) je ve vodě prakticky nerozpustný, a proto nedojde k disproporcionační reakci.
Podobně může vzniknout chlorid měďnatý(I) jako bílá sraženina (reakce popsaná níže). Za předpokladu, že se oddělí od roztoku a co nejrychleji vysuší, zůstane bílá. Ve styku s vodou však pomalu modrá, protože se tvoří ionty mědi(II).
Disproporcionační reakce probíhá pouze s jednoduchými ionty mědi(I) v roztoku.
Komplexy mědi(I)
Tvorba komplexů mědi(I) (jiných než s vodou jako ligandem) také stabilizuje oxidační stav mědi(I).
Například + i – jsou komplexy mědi(I), které se nedisproporcionují.
Komplex obsahující chlor vzniká, pokud se oxid měďnatý(I) rozpustí v koncentrované kyselině chlorovodíkové.
Můžete si představit, že to probíhá ve dvou fázích. Nejprve vznikne chlorid měďnatý(I):
![]()
![]()
V přítomnosti přebytku chloridových iontů z HCl však tento reaguje za vzniku stabilního, rozpustného komplexu měď(I).
![]()
![]()
Přidáním vody k tomuto roztoku získáte bílou sraženinu chloridu měďnatého(I) (zmíněnou výše). Tím se poslední reakce zvrátí tím, že se zbaví přebytečného chloridového iontu.
Otázky k ověření porozumění
Pokud je toto vaše první sada otázek, přečtěte si prosím úvodní stránku, než začnete. Poté se sem budete muset vrátit pomocí tlačítka ZPĚT ve svém prohlížeči.
otázky na měď
odpovědi
Kam byste chtěli přejít nyní?
Do nabídky přechodových kovů . .
Do nabídky Anorganická chemie . .
Do hlavního menu . . .