銅(I)化学の本質
溶液中の銅(I)イオンの不均化
銅(I)化学は、溶液中の単純な銅(I)イオンに関わって起こる反応によって制限されています。
溶液中の銅(I)イオンは不均化し、銅(II)イオンと銅の沈殿物を生成する。
この反応は、
![]()
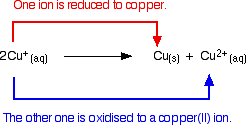
溶液中の単純な銅(I)化合物を生成しようとすると、このようになります。
たとえば、酸化銅(I)を熱い希硫酸と反応させると、硫酸銅(I)の溶液と水が生成すると思われるかもしれません。 実際には不均化反応により、銅の褐色の沈殿と硫酸銅(II)の青い溶液が得られます。
![]()
![]()
銅(I)の酸化状態の安定化
不溶性銅(I)化合物
銅(II)イオンを含む溶液にヨウ化カリウム溶液を加えると、オフホワイトの沈殿としてヨウ化銅(I)を生成することはすでに見ました。 ヨウ化銅(I)は水にほとんど溶けないので、不均化反応は起こりません。
同様に塩化銅(I)も白い沈殿として生成します(反応は後述)。 これを溶液から分離し、できるだけ早く乾燥させれば、白色のままである。
銅(I)錯体
銅(I)錯体(水を配位子とするもの以外)を形成すると、銅(I)の酸化状態も安定化する。
例えば、+も-も不均化しない銅(I)錯体です。
酸化銅(I)を濃塩酸に溶かすと塩素含有錯体ができます。
これが2段階で起こると考えてよいでしょう。 まず、塩化銅(I)が生成されます。
![]()
![]()
しかし、塩酸からの過剰な塩素イオンの存在下で、これが反応して安定で可溶性の銅(I)錯体を与えます。
![]()
![]()
この溶液に水を加えて塩化銅(I)の白い沈殿(上述)を得ることができます。 これは最後の反応を逆転させ、余分な塩化物イオンを取り去ります。
Questions to test your understanding
これが最初の問題集なら、始める前に入門ページを読んでおいてください。 その後、ブラウザの戻るボタンでここに戻ってくる必要があります。
銅に関する質問
回答
これからどこに行きたいですか?
遷移金属メニューへ. .
無機化学のメニューへ. .
メインメニューへ . . .