Uma química do cobre(I) essencial
A desproporção de iões de cobre(I) em solução
A química do cobre(I) é limitada por uma reacção que ocorre envolvendo iões de cobre(I) simples em solução. Este é um bom exemplo de desproporção – uma reacção em que algo oxida e se reduz.
Iões de cobre(I) em solução desproporcionada para dar iões de cobre(II) e um precipitado de cobre.
A reacção é:
![]()
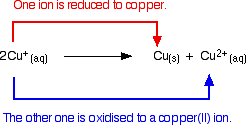
A qualquer tentativa de produzir um composto simples de cobre(I) em solução resulta nisto.
Por exemplo, se você reagir óxido de cobre(I) com ácido sulfúrico diluído a quente, você pode esperar obter uma solução de sulfato de cobre(I) e água produzida. Na verdade, você obtém um precipitado marrom de cobre e uma solução azul de sulfato de cobre(II) devido à reação desproporcional.
![]()
![]()
Estabilizar o estado de oxidação do cobre(I)
Compostos de cobre(I) insolúveis
Já vimos que o iodeto de cobre(I) é produzido como um precipitado quase branco se você adicionar solução de iodeto de potássio a uma solução contendo iões de cobre(II). O iodeto de cobre(I) é virtualmente insolúvel na água, e portanto a reacção de desproporção não acontece.
Simplesmente cloreto de cobre(I) pode ser produzido como um precipitado branco (reacção descrita abaixo). Desde que este seja separado da solução e seco o mais rapidamente possível, permanece branco. Em contacto com a água, no entanto, lentamente torna-se azul à medida que se formam iões de cobre(II).
A reacção de desproporção só ocorre com iões simples de cobre(I) em solução.
Cobre(I) complexes
Formar complexos de cobre(I) (que não aquele com água como ligante) também estabiliza o estado de oxidação do cobre(I).
Por exemplo, ambos + e – são complexos de cobre(I) que não são desproporcionais.
O complexo contendo cloro é formado se o óxido de cobre(I) for dissolvido em ácido clorídrico concentrado.
Você pode pensar que isto acontece em dois estágios. Primeiro, você obtém cloreto de cobre(I) formado:
![]()
Mas na presença de íons de cloreto em excesso do HCl, isto reage para dar um complexo estável e solúvel de cobre(I).
![]()
![]()
Você pode obter o precipitado branco de cloreto de cobre(I) (mencionado acima), adicionando água a esta solução. Isto inverte a última reacção, removendo o ião cloreto extra.
Questões para testar a sua compreensão
Se esta é a primeira série de perguntas que você fez, por favor leia a página introdutória antes de começar. Você precisará usar o BOTÃO DE VOLTA no seu navegador para voltar aqui depois.
Perguntas sobre cobre
Respostas
Onde você gostaria de ir agora?
Para o menu de metais de transição . …
Para o menu de Química Inorgânica . . . .
Para o menu principal . . .