Alcuni elementi essenziali della chimica del rame (I)
La sproporzione di ioni rame (I) in soluzione
La chimica del rame (I) è limitata da una reazione che avviene coinvolgendo semplici ioni rame (I) in soluzione. Questo è un buon esempio di sproporzione – una reazione in cui qualcosa si ossida e si riduce.
Gli ioni rame(I) in soluzione si sproporzionano per dare ioni rame(II) e un precipitato di rame.
La reazione è:
![]()
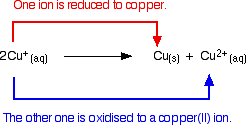
Tutti i tentativi di produrre un semplice composto di rame(I) in soluzione hanno come risultato questo.
Per esempio, se si fa reagire l’ossido di rame(I) con acido solforico diluito caldo, ci si potrebbe aspettare di ottenere una soluzione di solfato di rame(I) e acqua. In realtà si ottiene un precipitato marrone di rame e una soluzione blu di solfato di rame(II) a causa della reazione di sproporzione.
![]()
![]()
Stabilizzazione dello stato di ossidazione del rame(I)
Composti insolubili del rame(I)
Abbiamo già visto che lo ioduro di rame(I) viene prodotto come un precipitato bianco sporco se si aggiunge una soluzione di ioduro di potassio a una soluzione contenente ioni rame(II). Lo ioduro di rame(I) è praticamente insolubile in acqua, e così la reazione di sproporzione non avviene.
Similmente il cloruro di rame(I) può essere prodotto come un precipitato bianco (reazione descritta sotto). Se questo viene separato dalla soluzione e asciugato il più rapidamente possibile, rimane bianco. A contatto con l’acqua, però, diventa lentamente blu perché si formano ioni rame(II).
La reazione di sproporzione avviene solo con ioni rame(I) semplici in soluzione.
Complessi di rame(I)
La formazione di complessi di rame(I) (diversi da quello con acqua come ligando) stabilizza anche lo stato di ossidazione del rame(I).
Per esempio, sia + che – sono complessi di rame(I) che non si sproporzionano.
Il complesso contenente cloro si forma se l’ossido di rame(I) è dissolto in acido cloridrico concentrato.
Puoi pensare che questo avvenga in due fasi. In primo luogo, si forma il cloruro di rame(I):
![]()
![]()
Ma in presenza di ioni cloruro in eccesso dall’HCl, questo reagisce per dare un complesso di rame(I) stabile e solubile.
![]()
![]()
Si può ottenere il precipitato bianco di cloruro di rame(I) (menzionato sopra) aggiungendo acqua a questa soluzione. Questo inverte l’ultima reazione togliendo lo ione cloruro extra.
Domande per testare la tua comprensione
Se questa è la prima serie di domande che hai fatto, per favore leggi la pagina introduttiva prima di iniziare. Dovrai usare il PULSANTE INDIETRO del tuo browser per tornare qui dopo.
domande sul rame
risposte
Dove vorresti andare ora?
Al menu dei metalli di transizione . .
Al menu Chimica Inorganica . . .
Al menu principale . . .