Enige essentiële koper(I)-chemie
De disproportionering van koper(I)-ionen in oplossing
De koper(I)-chemie wordt beperkt door een reactie die optreedt met enkelvoudige koper(I)-ionen in oplossing. Dit is een goed voorbeeld van disproportionering – een reactie waarbij iets zichzelf oxideert en reduceert.
Koper(I)-ionen in oplossing disproportioneren om koper(II)-ionen te geven en een neerslag van koper.
De reactie is:
![]()
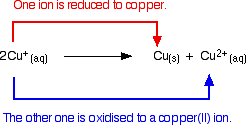
Alle pogingen om een eenvoudige koper(I)-verbinding in oplossing te maken, leiden tot dit verschijnsel.
Bijv. als u koper(I)oxide reageert met heet verdund zwavelzuur, zou u verwachten een oplossing van koper(I)sulfaat en water geproduceerd te krijgen. In feite krijg je een bruin neerslag van koper en een blauwe oplossing van koper(II)sulfaat als gevolg van de disproportioneringsreactie.
![]()
![]()
Stabiliseren van de koper(I)-oxidatietoestand
Onoplosbare koper(I)-verbindingen
We hebben al gezien dat koper(I)jodide ontstaat als een gebroken wit neerslag als je kaliumjodide-oplossing toevoegt aan een oplossing die koper(II)-ionen bevat. Het koper(I)jodide is vrijwel onoplosbaar in water, en dus vindt de disproportioneringsreactie niet plaats.
Ook koper(I)chloride kan worden geproduceerd als een wit neerslag (reactie hieronder beschreven). Mits dit zo snel mogelijk van de oplossing wordt gescheiden en gedroogd, blijft het wit. In contact met water wordt het echter langzaam blauw doordat koper(II)-ionen worden gevormd.
De disproportioneringsreactie treedt alleen op met enkelvoudige koper(I)-ionen in oplossing.
Koper(I)-complexen
Het vormen van koper(I)-complexen (anders dan die met water als ligand) stabiliseert ook de koper(I)-oxidatietoestand.
Zowel + als – zijn bijvoorbeeld koper(I)complexen die niet disproportioneren.
Het chloorhoudende complex wordt gevormd als koper(I)oxide wordt opgelost in geconcentreerd zoutzuur.
Je kunt je voorstellen dat dit in twee fasen gebeurt. Eerst wordt koper(I)chloride gevormd:
![]()
![]()
Maar in aanwezigheid van een overmaat aan chloride-ionen uit het HCl reageert dit tot een stabiel, oplosbaar koper(I)complex.
![]()
![]()
Het witte neerslag van koper(I)chloride (hierboven genoemd) krijg je door water aan deze oplossing toe te voegen. Dit keert de laatste reactie om door het extra chloride-ion te verwijderen.
Vragen om je begrip te testen
Als dit de eerste reeks vragen is die je hebt gemaakt, lees dan eerst de inleidende pagina voordat je begint. U zult de BACK BUTTON van uw browser moeten gebruiken om daarna hier terug te komen.
Vragen over koper
antwoorden
Waar wilt u nu naar toe?
Naar het overgangsmetaalmenu . . .
Naar het menu anorganische chemie . . .
Naar het hoofdmenu . . .