Einiges zur Kupfer(I)-Chemie
Die Disproportionierung von Kupfer(I)-Ionen in Lösung
Die Kupfer(I)-Chemie wird durch eine Reaktion begrenzt, die mit einfachen Kupfer(I)-Ionen in Lösung stattfindet. Dies ist ein gutes Beispiel für Disproportionierung – eine Reaktion, bei der etwas oxidiert und sich selbst reduziert.
Kupfer(I)-Ionen in Lösung disproportionieren zu Kupfer(II)-Ionen und einem Kupfer-Niederschlag.
Die Reaktion ist:
![]()
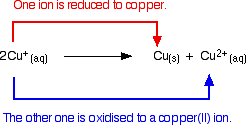
Jeder Versuch, eine einfache Kupfer(I)-Verbindung in Lösung herzustellen, führt zu diesem Ergebnis.
Wenn man zum Beispiel Kupfer(I)-Oxid mit heißer verdünnter Schwefelsäure reagieren lässt, könnte man erwarten, eine Lösung von Kupfer(I)-Sulfat und Wasser zu erhalten. Tatsächlich erhält man aufgrund der Disproportionierungsreaktion einen braunen Niederschlag von Kupfer und eine blaue Lösung von Kupfer(II)-sulfat.
![]()
![]()
Stabilisierung der Kupfer(I)-Oxidationsstufe
Unlösliche Kupfer(I)-Verbindungen
Wir haben bereits gesehen, dass Kupfer(I)-Jodid als weißer Niederschlag entsteht, wenn man Kaliumjodidlösung zu einer Lösung mit Kupfer(II)-Ionen gibt. Das Kupfer(I)-Jodid ist praktisch unlöslich in Wasser, so dass die Disproportionierungsreaktion nicht stattfindet.
Auch Kupfer(I)-chlorid kann als weißer Niederschlag entstehen (Reaktion unten beschrieben). Wenn dieser von der Lösung abgetrennt und möglichst schnell getrocknet wird, bleibt er weiß. In Kontakt mit Wasser färbt es sich jedoch langsam blau, da Kupfer(II)-Ionen gebildet werden.
Die Disproportionierungsreaktion tritt nur bei einfachen Kupfer(I)-Ionen in Lösung auf.
Kupfer(I)-Komplexe
Die Bildung von Kupfer(I)-Komplexen (außer dem mit Wasser als Ligand) stabilisiert ebenfalls die Kupfer(I)-Oxidationsstufe.
Zum Beispiel sind sowohl + als auch – Kupfer(I)-Komplexe, die nicht disproportioniert sind.
Der chlorhaltige Komplex bildet sich, wenn Kupfer(I)-oxid in konzentrierter Salzsäure gelöst wird.
Das kann man sich in zwei Stufen vorstellen. Zuerst wird Kupfer(I)-chlorid gebildet:
![]()
![]()
In Gegenwart von überschüssigen Chloridionen aus der HCl reagiert dieses jedoch zu einem stabilen, löslichen Kupfer(I)-Komplex.
![]()
![]()
Durch Zugabe von Wasser zu dieser Lösung erhält man den oben erwähnten weißen Niederschlag von Kupfer(I)-chlorid. Dies kehrt die letzte Reaktion um, indem es das zusätzliche Chlorid-Ion abstreift.
Fragen, um Ihr Verständnis zu testen
Wenn dies die erste Reihe von Fragen ist, die Sie bearbeiten, lesen Sie bitte die Einführungsseite, bevor Sie beginnen. Sie müssen die BACK BUTTON Ihres Browsers benutzen, um danach hierher zurückzukehren.
Fragen zu Kupfer
Antworten
Wo möchten Sie jetzt hin?
Zum Menü Übergang Metall . .
Zum Menü Anorganische Chemie . .
Zum Hauptmenü . . .