Un peu de chimie essentielle du cuivre(I)
La disproportion des ions cuivre(I) en solution
La chimie du cuivre(I) est limitée par une réaction qui se produit impliquant de simples ions cuivre(I) en solution. C’est un bon exemple de disproportionnement – une réaction dans laquelle quelque chose s’oxyde et se réduit.
Les ions cuivre(I) en solution se disproportionnent pour donner des ions cuivre(II) et un précipité de cuivre.
La réaction est :
![]()
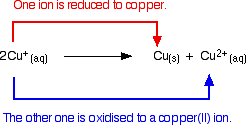
Toute tentative de produire un composé simple de cuivre(I) en solution aboutit à ce qui se passe.
Par exemple, si vous faites réagir l’oxyde de cuivre(I) avec de l’acide sulfurique dilué chaud, vous pourriez vous attendre à obtenir une solution de sulfate de cuivre(I) et de l’eau produite. En fait, vous obtenez un précipité brun de cuivre et une solution bleue de sulfate de cuivre(II) à cause de la réaction de disproportionnement.
![]()
![]()
Stabilisation de l’état d’oxydation du cuivre(I)
Composés insolubles du cuivre(I)
Nous avons déjà vu que l’iodure de cuivre(I) est produit sous forme de précipité blanc cassé si vous ajoutez une solution d’iodure de potassium à une solution contenant des ions cuivre(II). L’iodure de cuivre(I) est pratiquement insoluble dans l’eau, et donc la réaction de disproportionnement ne se produit pas.
De même, le chlorure de cuivre(I) peut être produit sous forme de précipité blanc (réaction décrite ci-dessous). A condition que celui-ci soit séparé de la solution et séché le plus rapidement possible, il reste blanc. Par contre, au contact de l’eau, il devient lentement bleu car des ions cuivre(II) se forment.
La réaction de disproportionnement ne se produit qu’avec des ions cuivre(I) simples en solution.
Complexes du cuivre(I)
La formation de complexes du cuivre(I) (autre que celui avec l’eau comme ligand) stabilise également l’état d’oxydation du cuivre(I).
Par exemple, + et – sont tous deux des complexes de cuivre(I) qui ne se disproportionnent pas.
Le complexe contenant du chlore est formé si l’oxyde de cuivre(I) est dissous dans de l’acide chlorhydrique concentré.
On peut penser que cela se passe en deux étapes. D’abord, vous obtenez le chlorure de cuivre(I) formé :
![]()
![]()
Mais en présence d’un excès d’ions chlorure provenant du HCl, cela réagit pour donner un complexe de cuivre(I) stable et soluble.
![]()
![]()
Vous pouvez obtenir le précipité blanc de chlorure de cuivre(I) (mentionné ci-dessus) en ajoutant de l’eau à cette solution. Cela inverse la dernière réaction en éliminant l’ion chlorure supplémentaire.
Questions pour tester votre compréhension
Si c’est la première série de questions que vous avez faite, veuillez lire la page d’introduction avant de commencer. Vous devrez utiliser le BOUTON PRÉCÉDENT de votre navigateur pour revenir ici par la suite.
questions sur le cuivre
réponses
Où voulez-vous aller maintenant ?
Au menu des métaux de transition . .
Au menu de la Chimie Inorganique . .
Vers le menu principal . . .