Câteva aspecte esențiale ale chimiei cuprului(I)
Disproporționarea ionilor de cupru(I) în soluție
Chimia cuprului(I) este limitată de o reacție care are loc și care implică ioni simpli de cupru(I) în soluție. Acesta este un bun exemplu de disproporționare – o reacție în care ceva se oxidează și se reduce.
Ionii de cupru(I) în soluție se disproporționează pentru a da ioni de cupru(II) și un precipitat de cupru.
Reacția este:
![]()
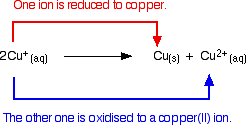
În orice încercare de a produce un compus simplu de cupru(I) în soluție, se întâmplă acest lucru.
De exemplu, dacă faceți să reacționați oxidul de cupru(I) cu acid sulfuric diluat fierbinte, vă puteți aștepta să obțineți o soluție de sulfat de cupru(I) și apă produsă. De fapt, veți obține un precipitat brun de cupru și o soluție albastră de sulfat de cupru(II) din cauza reacției de disproporționare.
![]()
![]()
Stadificarea stării de oxidare a cuprului(I)
Compuși insolubili ai cuprului(I)
Am văzut deja că iodura de cupru(I) este produsă sub forma unui precipitat albicios dacă adăugați o soluție de iodură de potasiu la o soluție care conține ioni de cupru(II). Iodura de cupru(I) este practic insolubilă în apă și, astfel, reacția de disproporționare nu are loc.
În mod similar, clorura de cupru(I) poate fi produsă sub forma unui precipitat alb (reacție descrisă mai jos). Cu condiția ca acesta să fie separat de soluție și uscat cât mai repede posibil, rămâne alb. În contact cu apa, însă, acesta devine lent albastru pe măsură ce se formează ioni de cupru(II).
Reacția de disproporționare are loc numai cu ioni simpli de cupru(I) în soluție.
Complecși de cupru(I)
Formarea de complecși de cupru(I) (alții decât cel cu apă ca ligand) stabilizează, de asemenea, starea de oxidare a cuprului(I).
De exemplu, atât + cât și – sunt complecși ai cuprului(I) care nu se disproporționează.
Complexul care conține clor se formează dacă oxidul de cupru(I) este dizolvat în acid clorhidric concentrat.
Vă puteți gândi că acest lucru se întâmplă în două etape. În primul rând, se formează clorura de cupru(I):
![]()
![]()
Dar în prezența excesului de ioni de clorură din HCl, aceasta reacționează pentru a da un complex de cupru(I) stabil și solubil.
![]()
![]()
Puteți obține precipitatul alb de clorură de cupru(I) (menționat mai sus) adăugând apă la această soluție. Acest lucru inversează ultima reacție prin îndepărtarea ionului de clorură suplimentar.
Întrebări pentru a vă testa înțelegerea
Dacă acesta este primul set de întrebări pe care îl faceți, vă rugăm să citiți pagina introductivă înainte de a începe. Va trebui să folosiți BUTONUL BACK (ÎNAPOI) de pe browserul dvs. pentru a reveni aici după aceea.
Întrebări despre cupru
răspunsuri
Unde doriți să mergeți acum?
La meniul metalelor de tranziție . .
La meniul Chimie anorganică . .
La meniul principal . . .