Dávkovací forma: tobolka, tekutá náplň
Medicínsky přezkoumáno Drugs.com. Naposledy aktualizováno 1. dubna 2020.
- Přehled
- Nežádoucí účinky
- Dávkování
- Odborné
- Interakce
- Další
- Vitamin D Ergokalciferol Popis
- Vitamin D Ergokalciferol – klinická farmakologie
- Indikace a použití přípravku Vitamin D Ergocalciferol
- Kontraindikace
- Upozornění
- Bezpečnostní opatření
- Všeobecně
- Lékové interakce
- Karcinogeneze, mutageneze, poškození fertility
- Těhotenství kategorie C
- Kojící matky
- Pediatrické použití
- Geriatrické použití
- Nežádoucí účinky
- Předávkování
- Účinky podávaného vitaminu D mohou přetrvávat dva nebo více měsíců po ukončení léčby.
- Dávkování a způsob podání ergokalciferolu vitaminu D
- Jak se vitamin D Ergokalciferol dodává
- Označení na obalu.PŘÍBALOVÝ OZNAČOVACÍ PANEL
- Více o ergokalciferolu
- Zdroje pro spotřebitele
- Zdroje pro odborníky
- Související průvodce léčbou
Vitamin D Ergokalciferol Popis
Ergokalciferol Kapsle, USP jsou syntetickým regulátorem vápníku pro perorální podání.
Ergokalciferol je bílý, bezbarvý krystal, nerozpustný ve vodě, rozpustný v organických rozpouštědlech a mírně rozpustný v rostlinných olejích. Je ovlivněn vzduchem a světlem. Ergosterol neboli provitamin D 2 se nachází v rostlinách a kvasinkách a nemá antirachitickou aktivitu.
Existuje více než 10 látek patřících do skupiny steroidních sloučenin, klasifikovaných jako látky s vitaminem D nebo antirachitickou aktivitou.
Jedna USP jednotka vitaminu D 2 odpovídá jedné mezinárodní jednotce (IU) a 1 mcg vitaminu D 2 odpovídá 40 USP jednotkám.
Každá tobolka obsahuje vitamin D (ergokalciferol) 1,25 mg odpovídající 50 000 USP jednotkám v jedlém rostlinném oleji.
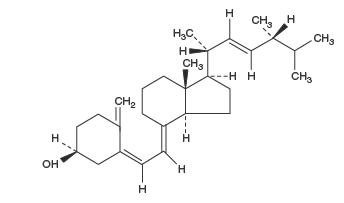
Ergokalciferol, nazývaný také vitamin D 2, je 9,10-secoergosta-5,7,10(19), 22-tetraen-3-ol, (3β,5Z,7E,22 E)-; (C 28H 44O) s molekulovou hmotností 396,65 a má následující strukturní vzorec:
Inactive Ingredients:
Vitamin D Ergokalciferol – klinická farmakologie
Syntéza hlavních biologicky aktivních metabolitů vitaminu D in vivo probíhá ve dvou krocích. První hydroxylace ergokalciferolu probíhá v játrech (na 25-hydroxyvitamin D) a druhá v ledvinách (na 1, 25-dihydroxyvitamin D). Metabolity vitaminu D podporují aktivní vstřebávání vápníku a fosforu tenkým střevem, čímž zvyšují sérové hladiny vápníku a fosfátu natolik, že umožňují mineralizaci kostí. Metabolity vitaminu D také mobilizují vápník a fosfát z kostí a pravděpodobně zvyšují reabsorpci vápníku a možná i fosfátu ledvinnými tubuly.
Mezi podáním vitaminu D a zahájením jeho působení v organismu je časová prodleva 10 až 24 hodin, což je způsobeno nutností syntézy aktivních metabolitů v játrech a ledvinách. Za regulaci tohoto metabolismu v ledvinách je zodpovědný parathormon.
Indikace a použití přípravku Vitamin D Ergocalciferol
Ergocalciferol Capsules, USP je indikován k použití při léčbě hypoparatyreózy, refrakterní křivice, známé také jako křivice rezistentní na vitamin D, a familiární hypofosfatemie.
Kontraindikace
Ergocalciferol Capsules, USP jsou kontraindikovány u pacientů s hyperkalcemií, malabsorpčním syndromem, abnormální citlivostí na toxické účinky vitaminu D a hypervitaminózou D.
Upozornění
Hypersenzitivita na vitamin D může být jedním z etiologických faktorů u kojenců s idiopatickou hyperkalcemií. V těchto případech je třeba přísně omezit podávání vitaminu D.
Uchovávejte mimo dosah dětí.
Bezpečnostní opatření
Všeobecně
Mělo by být vyhodnoceno podávání vitaminu D z obohacených potravin, doplňků stravy, samoplátců a léků na předpis. Terapeutické dávkování by mělo být znovu upraveno, jakmile dojde ke klinickému zlepšení. Dávkování musí být individuální a je třeba věnovat velkou pozornost prevenci závažných toxických účinků. U KŘIVICE REZISTENTNÍ NA VITAMIN D JE ROZMEZÍ MEZI TERAPEUTICKÝMI A TOXICKÝMI DÁVKAMI ÚZKÉ. Při použití vysokých terapeutických dávek by měl být sledován postup s častým stanovením vápníku v krvi.
Při léčbě hypoparatyreózy může být nutné intravenózní podání vápníku, parathormonu a/nebo dihydrotachysterolu.
Udržování normální hladiny sérového fosforu omezením fosfátů v potravě a/nebo podáváním hliníkových gelů jako střevních vazačů fosfátů u pacientů s hyperfosfatemií, která se často vyskytuje u renální osteodystrofie, je nezbytné pro prevenci metastatické kalcifikace.
Dostatečné množství vápníku v potravě je nezbytné pro klinickou odpověď na léčbu vitaminem D.
Tento přípravek obsahuje žluť FD&C č. 5 (tartrazin), která může u některých citlivých jedinců vyvolat reakce alergického typu (včetně bronchiálního astmatu). Ačkoli celkový výskyt citlivosti na FD&C Yellow No. 5 (tartrazin) v obecné populaci je nízký, často se vyskytuje u pacientů, kteří mají také přecitlivělost na aspirin.
Chraňte před světlem.
Lékové interakce
Minerální olej interferuje s absorpcí vitaminů rozpustných v tucích, včetně přípravků s vitaminem D.
Podávání thiazidových diuretik pacientům s hypoparatyreózou, kteří jsou současně léčeni přípravkem Ergocalciferol Capsules, USP, může způsobit hyperkalcemii.
Karcinogeneze, mutageneze, poškození fertility
Nebyly provedeny žádné dlouhodobé studie na zvířatech, které by hodnotily potenciál přípravku v těchto oblastech.
Těhotenství kategorie C
Studie reprodukce zvířat prokázaly u několika druhů abnormality plodu spojené s hypervitaminózou D. Ty jsou podobné syndromu supravalvulární aortální stenózy popsanému u kojenců Blackem v Anglii (1963). Tento syndrom byl charakterizován supravalvulární aortální stenózou, elfím obličejem a mentální retardací. Z důvodu ochrany plodu je proto třeba se vyvarovat užívání vitaminu D v množství překračujícím doporučenou výživovou dávku během normálního těhotenství, pokud podle úsudku lékaře potenciální přínos ve specifickém, jedinečném případě nepřeváží významná rizika s tím spojená. Bezpečnost nad 400 USP jednotek vitaminu D denně během těhotenství nebyla stanovena.
Kojící matky
Při podávání přípravku Ergocalciferol Capsules, USP kojícím ženám je třeba dbát zvýšené opatrnosti. U matky, které byly podávány velké dávky vitaminu D, se 25-hydroxycholekalciferol objevil v mléce a způsobil hyperkalcemii u jejího dítěte. V takovém případě je nutné sledovat koncentraci vápníku v séru kojence (Goldberg, 1972).
Pediatrické použití
Dávky pro děti musí být individuální (viz Dávkování a způsob podání).
Geriatrické použití
Klinické studie přípravku Ergocalciferol Capsules, USP nezahrnovaly dostatečný počet osob starších 65 let, aby bylo možné určit, zda reagují jinak než mladší osoby. Jiné uváděné klinické zkušenosti nezjistily rozdíly v reakcích mezi staršími a mladšími pacienty. Několik publikovaných zpráv naznačuje, že absorpce perorálně podávaného vitaminu D může být u starších osob oslabena ve srovnání s mladšími. Obecně platí, že volba dávky u staršího pacienta by měla být opatrná a obvykle by měla začínat na dolní hranici dávkovacího rozmezí, což odráží častější výskyt snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné farmakoterapie.
Nežádoucí účinky
Hypervitaminóza D je charakterizována účinky na následující orgánový systém:
Břišní: Poškození funkce ledvin s polyurií, nokturií, polydipsií, hyperkalciurií, reverzibilní azotemií, hypertenzí, nefrokalcinózou, generalizovanou vaskulární kalcifikací nebo ireverzibilní renální insuficiencí, která může vyústit v úmrtí.
CNS: Mentální retardace.
Měkké tkáně: Rozsáhlá kalcifikace měkkých tkání, včetně srdce, cév, ledvinových kanálků a plic.
Kosterní: Současně dochází k demineralizaci kostí (osteoporóze) u dospělých.
Snížení průměrné rychlosti lineárního růstu a zvýšená mineralizace kostí u kojenců a dětí (trpasličí růst) nejasné bolesti, ztuhlost a slabost.
Žaludeční a střevní: Nevolnost, anorexie, zácpa.
Metabolické funkce:
Ohledně nežádoucích účinků se obraťte na svého lékaře. Nežádoucí účinky můžete hlásit společnosti AvKARE na telefonním čísle 1-855-361-3993 nebo na adrese www.avkare.com.
Předávkování
Účinky podávaného vitaminu D mohou přetrvávat dva nebo více měsíců po ukončení léčby.
Hypervitaminóza D je charakterizována:
- Hyperkalcemií s anorexií, nevolností, slabostí, úbytkem hmotnosti, neurčitými bolestmi a ztuhlostí, zácpou, mentální retardací, anémií a mírnou acidózou.
- Zhoršení funkce ledvin s polyurií, nokturií, polydipsií, hyperkalciurií, reverzibilní azotemií, hypertenzí, nefrokalcinózou, generalizovanou vaskulární kalcifikací nebo ireverzibilní renální insuficiencí, která může vyústit v úmrtí.
- Široce rozšířená kalcifikace měkkých tkání, včetně srdce, cév, ledvinových kanálků a plic. Současně dochází k demineralizaci kostí (osteoporóze) u dospělých.
- Snížení průměrné rychlosti lineárního růstu a zvýšená mineralizace kostí u kojenců a dětí (dwarfismus).
Léčba hypervitaminózy D s hyperkalcemií spočívá v okamžitém vysazení vitaminu, dietě s nízkým obsahem vápníku, velkorysém příjmu tekutin spolu se symptomatickou a podpůrnou léčbou. Hyperkalcemická krize s dehydratací, stuorem, kómatem a azotémií vyžaduje razantnější léčbu. Prvním krokem by měla být hydratace pacienta. Intravenózní fyziologický roztok může rychle a významně zvýšit vylučování vápníku močí. K infuzi fyziologického roztoku může být podáno kličkové diuretikum (furosemid nebo kyselina etakrynová), které dále zvýší vylučování vápníku ledvinami. Další uváděná terapeutická opatření zahrnují dialýzu nebo podávání citrátů, sulfátů, fosfátů, kortikosteroidů, EDTA (kyselina ethylendiamintetraoctová) a mithramycinu prostřednictvím vhodných režimů. Při vhodné terapii je obvyklým výsledkem uzdravení, pokud nedošlo k trvalému poškození. Byla hlášena úmrtí v důsledku selhání ledvin nebo kardiovaskulárního systému.
LD 50 u zvířat není známa. Toxická perorální dávka ergokalciferolu u psa je 4 mg/kg.
Dávkování a způsob podání ergokalciferolu vitaminu D
Rozmezí mezi terapeutickými a toxickými dávkami je malé.
Křivice rezistentní na vitamin D:
Hypoparatyreóza:
Dávkování musí být individualizováno pod přísným lékařským dohledem.
Příjem vápníku by měl být dostatečný. Stanovení vápníku a fosforu v krvi musí být prováděno každé 2 týdny nebo v případě potřeby častěji.
Rentgenové snímky kostí by měly být prováděny každý měsíc, dokud se stav neupraví a nestabilizuje.
Jak se vitamin D Ergokalciferol dodává
Každá tobolka obsahuje vitamin D (ergokalciferol) 1,25 mg odpovídající 50 000 USP jednotkám. Zeleně zbarvené oválné průhledné měkké želatinové tobolky jsou potištěny bílým nápisem „194“ a obsahují čirou světle žlutou olejovitou tekutinu.
NDC 50268-297-15 (10 tobolek na kartě, 5 karet v kartonu).
Dávkováno v blistrech z děrovaného materiálu. Pouze pro institucionální použití.
Uchovávejte při teplotě 20 až 25 °C .
Chraňte před světlem.
Vyrobeno pro:
AvKARE
Pulaski, TN 38478
Mfg. rev. 03/19
AV 03/20 (P)
AvPAK
Označení na obalu.PŘÍBALOVÝ OZNAČOVACÍ PANEL

| VITAMIN D ergokalciferol v tobolkách |
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
Označovatel – AvPAK (832926666)
Více o ergokalciferolu
- Nežádoucí účinky
- Během těhotenství
- Dávkování Informace
- Obrázky léků
- Lékové interakce
- Ceny &Kupóny
- En Español
- 26 recenzí
- Třída léků: Léčivé přípravky: vitamíny
- Upozornění FDA (1)
Zdroje pro spotřebitele
- Informace pro pacienty
Zdroje pro odborníky
- Předpisové informace
- Ergokalciferol (odborný pacient. Poradenství pro pacienty)
- Ergokalciferol (FDA)
Ostatní značky Drisdol
Související průvodce léčbou
- Hypoparatyreóza
- Hypokalcémie
- Familiární hypofosfatemie
- Hypofosfatemie
- … +5 více
Medicínské prohlášení o vyloučení odpovědnosti