Chemiker schätzen Isotope und verwenden sie in der Grundlagen- und angewandten Forschung. Sie sind jedoch mehr mit der Bewegung von Elektronen beschäftigt. Wenn ein Atom Elektronen gewinnt oder verliert, wird es zu einer geladenen Spezies oder einem Ion. Der Kern wird dabei nicht verändert. Bei Atomen, die Elektronen verlieren, entsteht eine positive Gesamtladung (#Protonen > #Elektronen). Atome, die diese Art von Ionen bilden, werden Kationen genannt. Metallatome (auf der linken Seite des Periodensystems) verlieren immer Elektronen und werden zu Kationen.
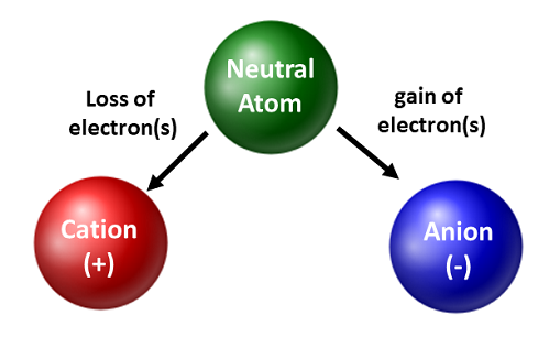
Im Gegensatz zu Metallatomen nehmen Nichtmetalle Elektronen auf und werden zu Anionen. Diese Arten von Ionen haben eine negative Gesamtladung (#Elektronen > #Protonen). Mit Ausnahme der Edelgase verlieren oder gewinnen alle Atome im Periodensystem Elektronen, um elektronische Stabilität zu erreichen. Verschiedene Arten von Bindungen treten auf, wenn Atome Elektronen verlieren, gewinnen oder teilen. Diese Arten von Atombindungen werden in Kapitel 4 deines Lehrbuchs näher erläutert.
Interaktiv: Bau eines Atoms
Baue ein Atom aus Protonen, Neutronen und Elektronen und beobachte, wie sich das Element, die Ladung und die Masse verändern. Spiele dann ein Spiel, um deine Ideen zu testen!
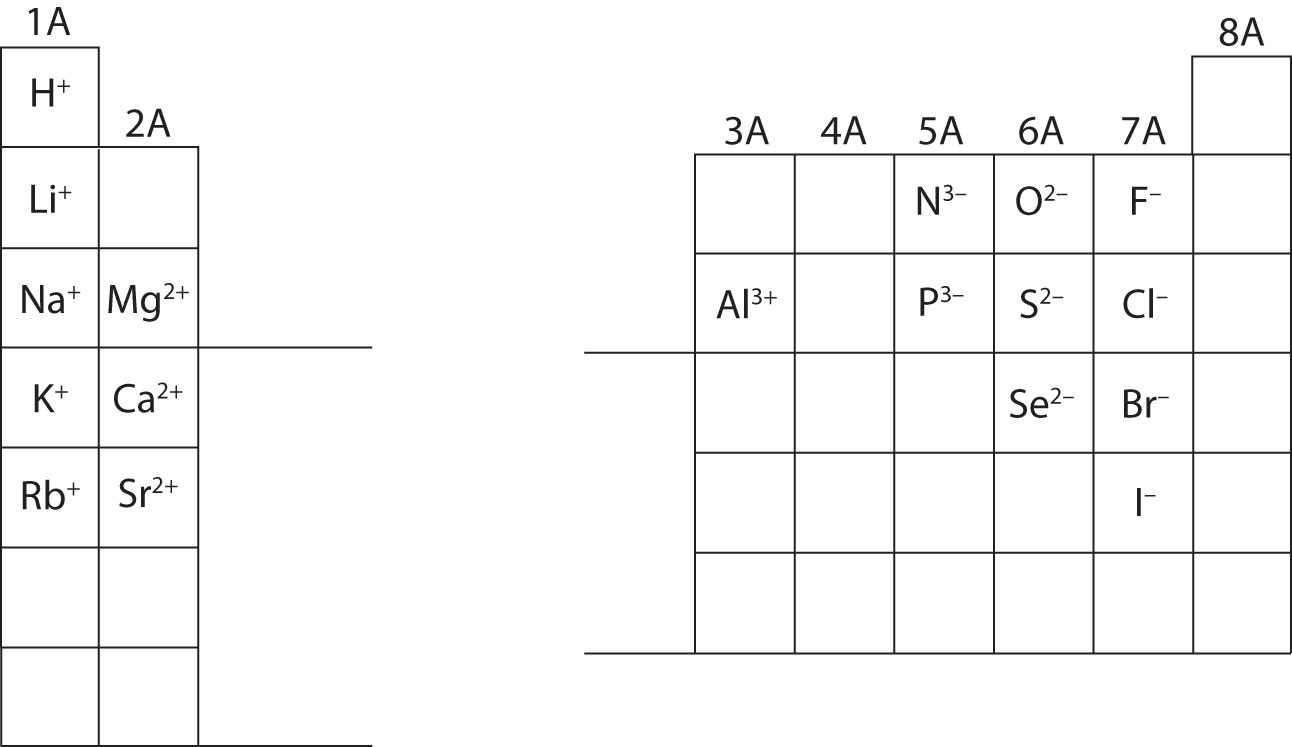
Zu diesem Zeitpunkt solltest du in der Lage sein, alle subatomaren Teilchen zu berechnen, wenn du eine bestimmte Ionenladung erhältst. Außerdem solltest du die Klassifizierung von Ionen beherrschen (Kationen sind positiv und Anionen sind negativ). Das Auswendiglernen der Ladungen bestimmter Ionen wird bei der Arbeit an Kapitel 4 im Lehrbuch erforderlich sein. Für den Moment werden die Ionenladungen zur Verfügung gestellt und sollten nicht auswendig gelernt werden. Notieren Sie sich die Ionenladungen der Hauptgruppenelemente im unten stehenden Periodensystem und schätzen Sie sie. Schließlich schreiben Chemiker keine Zahl für Ladungen, die die Zahl eins (1) beinhalten. Für diese Arten wird nur ein + oder – Zeichen angegeben. Ladungen höheren Grades haben immer eine Zahl, die mit dem Elementsymbol verbunden ist.
Beispiel \(\PageIndex{1}\): IOnische Klassifizierung
Berechnen Sie die subatomaren Teilchen für die folgenden Arten anhand der Informationen in Abbildung \(\PageIndex{2}\). Kennzeichnen Sie jedes Teilchen als Atom, Kation oder Anion. Beziehe dich auf das Periodensystem für Massen, Ordnungszahlen und spezifische Ionenladungen.
- Aluminium-Ion
- Zirkonium-Atom
- Schwefel-Ion
Lösungen
- Es gibt 13 Protonen, 14 Neutronen und 10 Elektronen im Aluminium-Ion. Dieses Ion ist positiv geladen, d.h. es hat Elektronen verloren und bildet ein Kation.
- Das Zirkoniumatom besteht aus 40 Protonen, 51 Neutronen und 40 Elektronen. Es ist ein Atom ohne Gesamtladung.
- Das Schwefel-Ion hat 16 Protonen, 16 Neutronen und 18 Elektronen. Dieses Ion ist negativ geladen, d.h. es hat Elektronen gewonnen und bildet ein Anion.
Beispiel \(\PageIndex{2}\): A/Z- und Symbolmassenbezeichnungen
Schreiben Sie A/Z- und Symbolmassenbezeichnungen für die Ionen/Atome aus der vorherigen Frage.
Lösungen
- \(\ce{^{27}_{13}Al^{3+}}\) und Al-27
- \(\ce{^{91}_{40}Zr}\) und Zr-91
- \(\ce{^{32}_{16}S}^{2-}\) und S-32
Wenn ein Atom Elektronen gewinnt oder verliert, sollte dies im A/Z-Format dargestellt werden. Im Symbol-Masse-Format wird die Ionenladung nicht angezeigt. Denke daran, dass Neutronen und Protonen von Veränderungen der Elektronen nicht betroffen sind.
Brauchst du mehr Übung?
- Schlage in Abschnitt 3.E dieser OER und bearbeiten Sie die Aufgaben Nr. 5 und Nr. 9.
Beitragende
-
Elizabeth R. Gordon (Furman University)