Katsotaan nyt kokonaisuutta. Hapoille ja emäksille on olemassa asteikko aivan kuten kaikelle muullekin. Tässä on pari määritelmää, jotka sinun tulisi tietää:
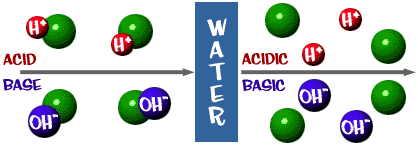
Happo: Liuos, jossa on liikaa H+-ioneja. Se tulee latinan sanasta acidus, joka tarkoittaa ”terävää” tai ”hapanta”.
Emäs: Liuos, jossa on liikaa OH-ioneja. Toinen sana emäkselle on alkali.
Vesiliuos: Liuos, joka koostuu pääasiassa vedestä. Ajattele sanaa akvaario. AQUA tarkoittaa vettä.
Kova happo: Happo, jonka pH on hyvin alhainen (0-4).
Vahva emäs: Emäs, jonka pH on hyvin korkea (10-14).
Heikko happo: Happo, joka ionisoituu vesiliuoksessa vain osittain. Tämä tarkoittaa, että kaikki molekyylit eivät hajoa. Heikkojen happojen pH on yleensä lähellä 7:ää (3-6).
Heikko emäs: Emäs, joka ionisoituu vesiliuoksessa vain osittain. Tämä tarkoittaa, että kaikki molekyylit eivät hajoa. Heikkojen emästen pH on yleensä lähellä 7 (8-10).
Neutraali: Liuos, jonka pH on 7. Se ei ole hapan eikä emäksinen.
Kerroimme sinulle tuosta Arrheniuksesta ja hänen ajatuksistaan vety- ja hydroksidi-ionien pitoisuuksista. Opit myös Brønsted-Lowryn ideoista. Nämä kaksi tanskalaista ja englantilaista kemistiä tarkastelivat happoja luovuttajina ja emäksiä vastaanottajina. Mitä he luovuttivat ja hyväksyivät? Vetyioneja. Se muistuttaa paljon ensimmäistä määritelmää, jonka annoimme: happo hajoaa ja vapauttaa/luovuttaa vetyionin. Tämä uudempi määritelmä on hieman yksityiskohtaisempi. Tutkijat käyttivät uutta määritelmää kuvaamaan useampia emäksiä, kuten ammoniakkia (NH3). Koska emäkset ovat protonien vastaanottajia, kun ammoniakin nähtiin ottavan vastaan H+:n ja muodostavan ammoniumionin (NH4+), sitä voitiin nimittää emäkseksi. Hydroksidi-ioneista ei tarvinnut enää huolehtia. Jos se sai H+:n vesimolekyyliltä, vesi (H2O) oli protonin luovuttaja. Tarkoittaako tämä, että vesi oli tässä tilanteessa happo? Kyllä.
Kemisti nimeltä Lewis tarjosi kolmannen tavan tarkastella happoja ja emäksiä. Vetyionien tarkastelun sijasta hän tarkasteli elektronipareja (muistatko kuvamme pistemäisten rakenteiden kanssa atomeista ja alkuaineista?). Lewisin näkemyksen mukaan hapot ottavat vastaan elektronipareja ja emäkset luovuttavat elektronipareja. Tiedämme, että näissä molemmissa happojen ja emästen kuvauksissa käytetään täysin vastakkaisia termejä, mutta ajatus on sama. Vetyionit haluavat edelleen ottaa vastaan kaksi elektronia muodostaakseen sidoksen. Emäkset haluavat luovuttaa niitä. Kaiken kaikkiaan Lewisin määritelmällä pystyttiin luokittelemaan entistä useampia yhdisteitä hapoiksi tai emäksiksi.
Mitä oikeasti tapahtuu?
Mitä noissa liuoksissa oikeasti tapahtuu? Tästä tulee hieman hankalaa. Tarkastellaan vielä kerran varmuuden vuoksi molekyylien hajoamista vesipohjaisissa (vesipohjaisissa) liuoksissa. Hapot ovat yhdisteitä, jotka dissosioituvat (hajoavat) vetyioneiksi (H+) ja toiseksi yhdisteeksi, kun ne sijoitetaan vesiliuokseen. Muistatko esimerkin etikkahaposta? Emäkset ovat yhdisteitä, jotka hajoavat hydroksidi-ioneiksi (OH-) ja joksikin muuksi yhdisteeksi, kun ne sijoitetaan vesiliuokseen. Puhumme ruokasoodasta muutaman kappaleen kuluttua.
Muutetaan sanamuotoa hieman. Jos sinulla on ioninen/elektrovalenttinen yhdiste ja laitat sen veteen, se hajoaa kahdeksi ioniksi. Jos toinen näistä ioneista on H+, liuos on hapan. Vahva happo vetykloridi (HCl) on yksi esimerkki. Jos toinen ioneista on OH-, liuos on emäksinen. Esimerkki vahvasta emäksestä on natriumhydroksidi (NaOH). On muitakin ioneja, jotka tekevät happamia ja emäksisiä liuoksia, mutta emme puhu niistä tässä.
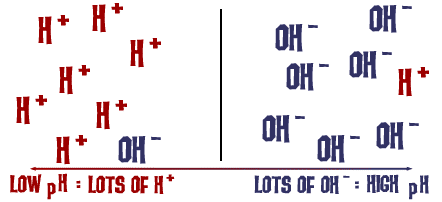
Tämä pH-asteikko, josta puhuimme, on itse asiassa liuoksessa olevien H+-ionien lukumäärän mitta. Jos H+-ioneja on paljon, pH on hyvin alhainen. Jos OH-ioneja on paljon verrattuna H+-ionien määrään, pH on korkea.
Ajattele tätä ajatusta hetki: Miksi neste, jossa on paljon NaOH:ta, olisi hyvin emäksinen, mutta samalla vaarallinen? Na-OH-sidos katkeaa liuoksessa ja sinulla on natriumioneja (positiivisia) ja hydroksidi-ioneja (negatiivisia). Natriumionit eivät oikeastaan aiheuta vaaraa liuoksessa, mutta liuoksessa on valtava määrä hydroksidi-ioneja verrattuna vetyioneihin, jotka saattavat kellua ympäriinsä H3O+:na (hydroniumionina).Kaikki nämä ylimääräiset OH-ionit tekevät pH:sta erittäin korkean, ja liuos reagoi helposti monien yhdisteiden kanssa. Sama asia tapahtuu vähemmän vaarallisessa mittakaavassa, kun lisäät ruokasoodaa veteen. Dissosiaation aikana liuokseen vapautuu OH-ioneja ja hiilihappoa. OH-ionien määrä on suurempi kuin H3O+-ionien (H+ ja H2O) määrä, ja pH nousee. Ero ei vain ole yhtä voimakas kuin natriumhydroksidilla.
Se on periaatteessa siinä. (Ha ha! Tajusitko?)
Lisätietoa ensimmäisessä osassa.
Seuraava video…
Encyclopædia Britannica: Bases
Wikipedia: Hapot
Wikipedia: Hapot
Encyclopedia.com: Hapot
Encyclopedia.com: Bases