Les chimistes apprécient les isotopes et les utilisent en recherche fondamentale et appliquée. Cependant, ils sont plus concernés par le mouvement des électrons. Lorsqu’un atome gagne ou perd des électrons, il devient une espèce chargée ou un ion. Lorsque cela se produit, le noyau n’est pas altéré. Pour les atomes qui perdent des électrons, il en résulte une charge positive globale (#protons > #électrons). Les atomes qui forment ce type d’ions sont appelés cations. Les atomes métalliques (situés sur le côté gauche du tableau périodique) perdent toujours des électrons pour devenir des cations.
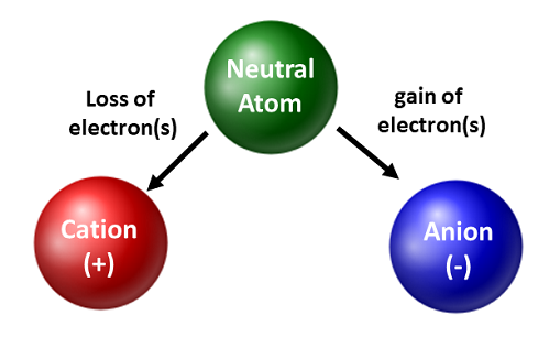
Contrairement aux atomes métalliques, les non-métaux vont gagner des électrons pour devenir des anions. Ces types d’ions ont une charge globale négative (#électrons > #protons). À l’exception des gaz rares, tous les atomes du tableau périodique perdent ou gagnent des électrons pour atteindre la stabilité électronique. Différents types de liaisons se produisent lorsque les atomes perdent, gagnent ou partagent des électrons. Ces types de liaisons atomiques seront abordés plus en détail au chapitre 4 de votre manuel.
Interactif : Construire un atome
Construisez un atome à partir de protons, de neutrons et d’électrons, et voyez comment l’élément, la charge et la masse changent. Jouez ensuite à un jeu pour tester vos idées !
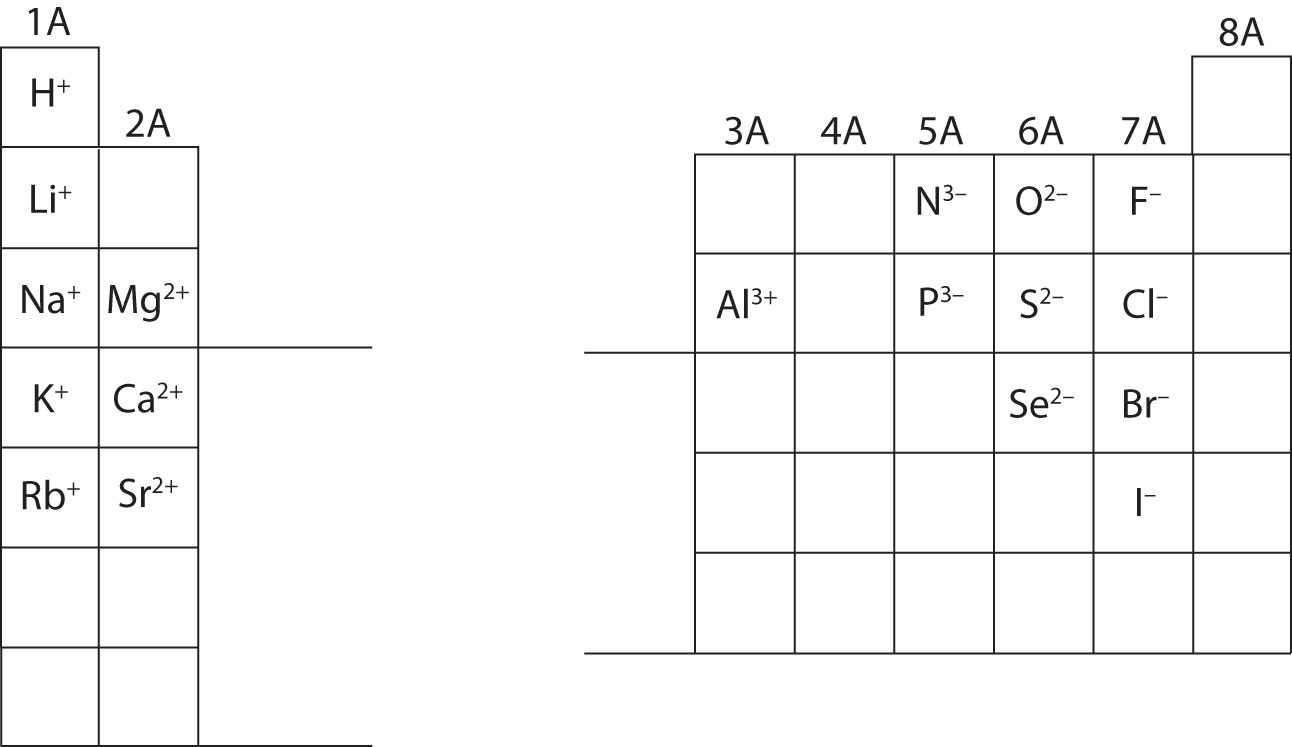
À ce stade, vous devriez être capable de calculer toutes les particules subatomiques lorsqu’on leur donne une charge ionique spécifique. De plus, vous devriez maîtriser les classifications des ions (en reconnaissant que les cations sont positifs et que les anions sont négatifs). La mémorisation des charges d’ions spécifiques sera nécessaire lorsque vous travaillerez sur le chapitre 4 du manuel. Pour l’instant, les charges ioniques seront fournies et ne doivent pas être mémorisées. Notez et appréciez les charges ioniques des éléments du groupe principal dans le tableau périodique ci-dessous. Enfin, les chimistes n’écrivent pas de nombre pour les charges impliquant le chiffre un (1). Pour ces espèces, vous verrez uniquement un signe + ou -. Les charges de magnitude supérieure auront toujours un nombre associé au symbole de l’élément.
Exemple \(\PageIndex{1}\) : Classification IOnic
Calculez les particules subatomiques des espèces ci-dessous en utilisant les informations de la figure \(\PageIndex{2}\). Identifiez chaque particule comme étant un atome, un cation ou un anion. Reportez-vous au tableau périodique pour connaître les masses, les numéros atomiques et les charges ioniques spécifiques.
- Ion aluminium
- Atome de zirconium
- Ion soufre
Solutions
- L’ion aluminium compte 13 protons, 14 neutrons et 10 électrons. Cet ion est chargé positivement ce qui signifie qu’il a perdu des électrons et forme un cation.
- Il y a 40 protons, 51 neutrons et 40 électrons dans l’atome de zirconium. C’est un atome qui n’a pas de charge globale.
- Il y a 16 protons, 16 neutrons et 18 électrons dans l’ion soufre. Cet ion est chargé négativement ce qui signifie qu’il a gagné des électrons et forme et un anion.
Exemple \(\PageIndex{2}\) : Notations de masse A/Z et symbole
Ecrivez les notations de masse A/Z et symbole pour les ions/atomes de la question précédente.
Solutions
- \(\ce{^{27}_{13}Al^{3+}\) et Al-27
- \(\ce{^{91}_{40}Zr}\) et Zr-91
- \(\ce{^^{32}_{16}S}^{2-}\) et S-32
Si un atome gagne ou perd des électrons, cela doit être représenté sur le format A/Z. Le format symbole-masse n’affiche pas la charge des ions. Rappelez-vous que les neutrons et les protons ne sont pas affectés par les changements d’électrons.
Vous avez besoin de plus de pratique ?
- Voyez la section 3.E de ce REL et travaillez les problèmes n°5 et n°9.
Contributeurs
-
Elizabeth R. Gordon (Furman University)
.