Algo de química esencial del cobre(I)
La desproporción de iones de cobre(I) en solución
La química del cobre(I) está limitada por una reacción que ocurre involucrando simples iones de cobre(I) en solución. Este es un buen ejemplo de desproporción – una reacción en la que algo se oxida y se reduce.
Los iones de cobre(I) en solución se desproporcionan para dar iones de cobre(II) y un precipitado de cobre.
La reacción es:
![]()
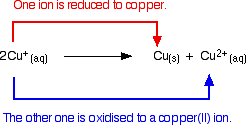
Cualquier intento de producir un compuesto simple de cobre(I) en solución resulta en que esto ocurra.
Por ejemplo, si se hace reaccionar óxido de cobre(I) con ácido sulfúrico diluido caliente, se podría esperar obtener una solución de sulfato de cobre(I) y agua producida. En realidad se obtiene un precipitado marrón de cobre y una solución azul de sulfato de cobre(II) debido a la reacción de desproporción.
![]()
![]()
Equilibrio del estado de oxidación del cobre(I)
Compuestos insolubles de cobre(I)
Ya hemos visto que el yoduro de cobre(I) se produce como un precipitado blanquecino si se añade una solución de yoduro de potasio a una solución que contiene iones de cobre(II). El yoduro de cobre(I) es prácticamente insoluble en agua, por lo que la reacción de desproporción no se produce.
De forma similar, el cloruro de cobre(I) puede producirse como un precipitado blanco (reacción descrita a continuación). Si se separa de la solución y se seca lo más rápidamente posible, permanece blanco. En contacto con el agua, sin embargo, se vuelve lentamente azul a medida que se forman iones de cobre(II).
La reacción de desproporción sólo se produce con iones de cobre(I) simples en solución.
Complejos de cobre(I)
La formación de complejos de cobre(I) (distintos del que tiene agua como ligando) también estabiliza el estado de oxidación del cobre(I).
Por ejemplo, tanto el + como el – son complejos de cobre(I) que no se desproporcionan.
El complejo que contiene cloro se forma si el óxido de cobre(I) se disuelve en ácido clorhídrico concentrado.
Puedes pensar que esto ocurre en dos etapas. Primero, se forma el cloruro de cobre(I):
![]()
![]()
Pero en presencia de un exceso de iones cloruro procedentes del HCl, éste reacciona para dar un complejo de cobre(I) estable y soluble.
![]()
![]()
Puedes obtener el precipitado blanco de cloruro de cobre(I) (mencionado anteriormente) añadiendo agua a esta solución. Esto invierte la última reacción eliminando el ion cloruro extra.
Preguntas para comprobar tu comprensión
Si esta es la primera serie de preguntas que haces, por favor lee la página de introducción antes de empezar. Tendrá que utilizar el BOTÓN ATRÁS de su navegador para volver aquí después.
Preguntas sobre el cobre
Respuestas
¿A dónde quiere ir ahora?
Al menú de metales de transición . .
Al menú de Química Inorgánica . .
Al menú principal . . .