US Pharm. 2014;39(3):HS2-HS8.
ABSTRACT: Az acetaminofen-toxicitás a szándékos és a nem szándékos mérgezések egyik leggyakoribb oka az Egyesült Államokban. Az akut májelégtelenség leggyakoribb okává és a transzplantációt igénylő májelégtelenség második leggyakoribb okává vált. Az acetaminofent gyakran ajánlják az orvosok, és a betegek is nagymértékben használják a vényköteles és vény nélkül kapható termékekben különböző állapotokra. Az FDA már régóta frissíti az acetaminofen használatára vonatkozó ajánlásait a betegek biztonságának javítása érdekében. Ez a cikk áttekinti a paracetamol-toxicitás etiológiáját, jeleit és tüneteit, valamint a gyógyszerész szerepét a paracetamollal való visszaélés megelőzésében.
A paracetamolt gyakran ajánlják az orvosok és a betegek is nagymértékben használják a vényköteles és vény nélkül kapható termékekben a legkülönbözőbb állapotokra, így kétségkívül az egyik leggyakoribb gyógyszer, amellyel a gyógyszerészek találkoznak.1-3. Az Egyesült Államokban a felnőtt lakosság 40%-a számolt be arról, hogy havonta használ vény nélkül kapható paracetamolt, és a felnőtt lakosság 23%-a számolt be arról, hogy hetente használ vény nélkül kapható vagy vényköteles paracetamolt.1,2
A paracetamol (paracetamol vagy APAP) az aszpirinhez hasonló fájdalomcsillapító és lázcsillapító, de minimális gyulladáscsökkentő tulajdonságokkal rendelkezik.4 Enyhe és közepes fájdalom vagy láz esetén javallott, és az ajánlott adagokban nem jár gyomorpanaszokkal vagy vérzéssel. Megfelelő alkalmazás esetén nagyon jól megalapozott biztonsági és hatékonysági profilja van.5 A májtoxicitás azonban a túlzott fogyasztás gyakori következménye, amely számos problémát okozhat, beleértve a májműködés rendellenességeit, akut májelégtelenséget és akár halált is.6
Az acetaminofen-toxicitás az egyik leggyakoribb oka mind a szándékos, mind a nem szándékos mérgezéseknek az Egyesült Államokban. Valójában az elmúlt évtizedben folyamatosan nőtt az acetaminofennel kapcsolatos toxicitás előfordulása.7,8 Ez valószínűleg annak tulajdonítható, hogy az acetaminofen széles körben elérhető mind önálló összetevőként, mind más vény nélküli és vényköteles gyógyszerekkel kombinálva, különböző koncentrációkban és formulákban. Az acetaminofennel összefüggő túladagolás évente körülbelül 56 000 sürgősségi osztályos látogatást, 26 000 kórházi kezelést és több mint 450 halálesetet okoz.9 Az acetaminofen okozta májtoxicitás az akut májelégtelenség leggyakoribb okává és a transzplantációt igénylő májelégtelenség második leggyakoribb okává vált.10, 11 Ezért elengedhetetlen, hogy a gyógyszerészek felismerjék a túladagolás és a toxicitás jeleit és tüneteit, és tanácsot adjanak betegeiknek a megfelelő adagolásról és használatról.
Farmakokinetika
Az acetaminofen lenyeléskor gyorsan felszívódik a gyomor-bélrendszerből (GI) és gyorsan eloszlik a szervezetben. A plazma csúcskoncentrációját 30-60 percen belül éri el4; az étkezés késleltetheti a csúcskoncentráció elérésének idejét, de a felszívódás mértékét ez nem befolyásolja.12 Túladagolás esetén a plazma csúcskoncentrációját általában 4 órán belül éri el13. A paracetamol felezési ideje a terápiás dózisok után körülbelül 2-3 óra, azonban májkárosodásban szenvedő betegeknél ez több mint 4 órára is megnövekedhet.4,12,14
A paracetamol a májban széles körben metabolizálódik három fő májútvonalon keresztül: glükuronidáció, szulfatáció és CYP450 2E1 oxidáció.12 Az acetaminofen körülbelül 90%-a szulfátos és glükuronidált metabolitokká konjugálódik, amelyek renálisan eliminálódnak.14 A fennmaradó paracetamolnak körülbelül 2%-a változatlanul ürül a vizelettel, a többi pedig CYP450 által közvetített oxidáción megy keresztül, és egy reaktív metabolitot, N-acetil-p-benzokinon-imint (NAPQI) képez.15-18 Normál körülmények között ez a toxikus metabolit a glutation szulfhidrilcsoportjaival reagál, és ártalmatlan metabolitokká alakul át, mielőtt a vizelettel ürülne.4
Toxicitás
A gyógyszereknek különböző okok miatt toxikus hatásuk lehet. Egyes gyógyszerek toxicitása egy nemkívánatos metabolit képződésével függ össze; következésképpen a paracetamol toxicitása a NAPQI termelésével függ össze. Nagy akut dózisok vagy krónikus alkalmazás esetén a fő metabolikus útvonalak – a glükuronid és a szulfát konjugációs rendszer – telítetté válnak, és több paracetamol metabolizálódik a CYP450 rendszerben. Ez a NAPQI fokozott termelését eredményezi. Amikor a glutation körülbelül 70%-ban kimerül, a NAPQI elkezd felhalmozódni a hepatocitákban, ami májkárosodáshoz vezet.15,16,18 Ezért a glutation pótlása glutationt utánzó vegyületekkel, például N-acetilciszteinnel hasznos ellenszerként szolgál az acetaminofen-toxicitásban.
Az acetaminofen-toxicitás lehet akut túladagolás vagy krónikus túlhasználat következménye. Az akut túladagolás a gyógyszer toxikus mennyiségének 8 órán belüli elfogyasztása, míg a krónikus túladagolás az ajánlott határértéket elérő vagy meghaladó ismételt adagok eredményeként következik be.12 A nem szándékos túladagolás több paracetamol tartalmú termék elfogyasztása következtében is előfordulhat. A paracetamol ajánlott adagja felnőtteknél 650-1000 mg 4-6 óránként, de 24 óra alatt nem haladhatja meg a 4000 mg-ot; gyermekeknél az ajánlott adag 10-15 mg/kg 4-6 óránként, de 24 óra alatt nem haladhatja meg az 50-70 mg/kg-ot.12 A 150 mg/kg-ot vagy 7,5 g-ot meghaladó egyszeri adagok felnőtteknél potenciálisan toxikusnak tekinthetők, bár a májkárosodással járó minimális dózis 4-10 g között lehet.6,12,14,19 Gyermekeknél 120 mg/kg és 150 mg/kg közötti egyszeri adagok is májkárosodással jártak; azonban a <200 mg/kg dózisok nem valószínű, hogy toxicitást eredményeznek.14,20
Míg a pontos maximális dózis nincs pontosan meghatározva, az American Association of Poison Control Centers (AAPCC) azt ajánlotta, hogy a bevitt gyógyszer mennyiségétől függetlenül a beteget orvosi vizsgálatra kell szállítani, ha a toxicitásra utaló jeleket vagy tüneteket észlel.21 Az AAPCC mind a paracetamol akut, egyszeri, véletlenszerű lenyelése, mind a paracetamol ismételt, szupraterápiás célú lenyelése esetén kórházba utalásra vonatkozó iránymutatásokat adott (1. TÁBLÁZAT).21
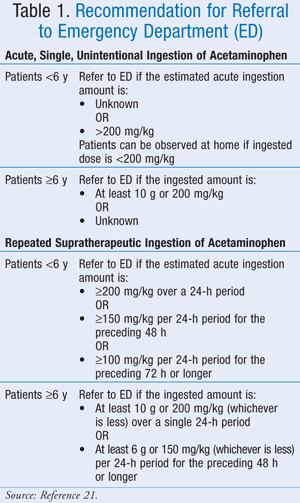
Klinikai megjelenés
Függetlenül attól, hogy az acetaminofen-toxicitás egyszeri túladagolás miatt vagy ismételt szupraterápiás bevétel után következik be, az acetaminofen-mérgezés lefolyása négy egymást követő fázisban írható le: preklinikai toxikus hatások (első fázis), májkárosodás (második fázis), májelégtelenség (harmadik fázis) és gyógyulás (negyedik fázis).6,22 A preklinikai szakaszban kezelt betegeknél átmeneti májkárosodás alakulhat ki, de teljesen felépülhetnek.22 Azoknak a betegeknek, akiket nem kezelnek, amíg a májkárosodás már nem nyilvánvaló, változó a prognózisa; azoknál azonban, akiknél a máj elégtelenség jelentkezik, a halálozási arány 20-40%.22
Az első fázis néhány órával a toxikus dózis lenyelése után következik be, és 12-24 óráig tart. Fontos megjegyezni a tünetek megjelenésének késleltetését, mivel az egészségügyi szolgáltatóknak meg kell érteniük a toxicitás következményeit, amelyek ezt a nyugalmi időszakot követik. Az első 24 órában jelentkező tünetek nem diagnosztikusak vagy specifikusak, és közéjük tartozik a hányinger, hányás, diaforézis, étvágytalanság és letargia, amelyek súlyossága közvetlen összefüggésben áll az elfogyasztott dózis nagyságával.8
A második fázisban, amely a lenyelést követő 24-48 órán belül jelentkezik, a gyógyulás hamis érzése alakulhat ki, mivel a GI-tünetek javulnak vagy eltűnnek.6,8 A hepatotoxicitás további kialakulásával azonban hasi fájdalom vagy a jobb felső kvadránsban jelentkező érzékenység kerülhet felszínre. Ezenkívül a laboratóriumi értékek a hepatotoxicitás jeleit kezdik mutatni; a májenzimek, a laktát, a foszfát, a protrombinidő és a nemzetközi normalizált arány (INR) drámaian megemelkedik.6,8,12 A legtöbb beteg nem lép túl ezen a szakaszon, különösen, ha az antidotumként szolgáló acetilcisztein kerül beadásra.8,12
Egy kevés betegnél alakul ki a harmadik fázis, amely általában 3-5 nap múlva következik be. Ezt a fázist a hányinger és hányás újbóli megjelenése vagy súlyosbodása jellemzi, amelyet rossz közérzet, sárgaság és központi idegrendszeri tünetek kísérnek, beleértve a zavartságot, szomnolenciát és kómát.6 Súlyos és esetleg halálos kimenetelű májnekrózis léphet fel. Bár ritkábban fordul elő, az acetaminofen által kiváltott tubuláris nekrózis következtében veseelégtelenség léphet fel, amelyet oliguria mutat ki.6,8,12 A hepatikus enzimszintek elérik a csúcsot, és akár 10 000 IU/L-t is mérhetnek. Sárgaság, hipoglikémia, vérzés és véralvadási rendellenességek, valamint hepatikus encephalopathia is jelentkezik.8,12 A halál a májelégtelenséggel járó szövődmények következtében következhet be, beleértve a többszervi rendszer elégtelenségét, az agyödémát és a szepszist.15
A negyedik fázis végül a túlélést és a gyógyulást jelenti, általában a teljes májfunkció visszatérésével és hosszú távú hatások nélkül.6
A negyedik fázis a túlélést és a felépülést jelenti. A negyedik fázisba lépő betegek körülbelül 70%-a teljesen felépül, míg a betegek 1-2%-ánál halálos kimenetelű májelégtelenség alakul ki.6 A súlyos, kezeletlen paracetamol-toxicitás a lenyelést követő 4-18 napon belül halálhoz vezet.6
A fokozott kockázatú betegek
Mivel a paracetamol-toxicitás mechanizmusa a NAPQI képződésén keresztül történik, ezért minden olyan tényező, amely befolyásolja a metabolikus enzimek elérhetőségét, befolyásolja a toxicitást. Az alkoholfogyasztás, az alultápláltság és a CYP450 enzimek gyógyszerek általi indukciója, beleértve a karbamazepinnel, primidonnal, rifampinnal, efavirenzzel és orbáncfűvel való hosszú távú kezelést, befolyásolhatja, hogy az egyén hogyan reagál az acetaminofenre23. A fenti tényezők bármelyike által érintett betegeket azonosítani kell, hogy a gyógyszerészek szorosan tanácsot adhassanak nekik az acetaminofen biztonságos használatáról.
Az etanol a CYP2E1 szubsztrátjaként és gátlójaként is szolgál, korlátozva a képződő NAPQI mennyiségét. Ezzel szemben krónikus alkoholfogyasztás esetén az etanol a CYP2E1 induktora, ami acetaminofen-túladagolás esetén a NAPQI képződésének lehetséges növekedéséhez vezet. A krónikus alkoholfogyasztás másik következménye a glutationraktárak kimerülése, ami csökkenti a NAPQI képződésével szembeni utolsó védekezési lehetőséget.17 Nincs bizonyíték arra, hogy a paracetamol terápiás dózisban történő alkalmazása toxikus lenne az alkoholbetegeknél; ezért terápiás mennyiségben a paracetamol biztonságosan alkalmazható mind akut, mind krónikusan.23-25 .
Az éhezés (hosszan tartó koplalás) és az alultápláltság – bár ellentmondásos – az acetaminofen-toxicitás további kockázati tényezői.16,18,23 A krónikus alkoholfogyasztáshoz hasonlóan az alultápláltság a glutationraktárak kimerüléséhez vezet. Ugyanakkor arra is van bizonyíték, hogy a CYP2E1 működése jelentősen csökken ebben a betegpopulációban. Ezek a hatások ezáltal ellensúlyoznák egymást, és potenciálisan nem eredményeznének változást a toxicitásban.26 Mindazonáltal továbbra is bölcs dolog azonosítani az ilyen betegeket, és figyelmeztetni őket fokozott kockázati potenciáljukra.
Kezelés
A beteg megjelenésekor alaposan fel kell mérni a beteget. Részletes gyógyszeres anamnézist kell felvenni. A szérum paracetamolszintet ideális esetben legalább 4 órával a bevétel után kell meghatározni. A gyógyszerészek fontos szerepet játszhatnak a vonatkozó információk összegyűjtésével, mint például a bevett gyógyszer mennyisége, a bevett adagolási forma, az utolsó bevett adag óta eltelt idő, és ha más gyógyszereket is fogyasztottak. Mindezek a tényezők fontosak a szérum paracetamol-koncentrációjának elemzésekor.
Ha a beteg a lenyelést követő egy órán belül jelentkezik, megfontolható a gyomorfertőtlenítés; az aktív szén az egyetlen ajánlott GIfertőtlenítési módszer. Az aktív szén beadása megfontolandó, különösen azoknál a betegeknél, akik paracetamol késleltetett felszabadulású készítményeket vettek be, vagy olyan egyéb gyógyszereket fogyasztottak, amelyek lassítják a paracetamol felszívódását.12 Azonban a paracetamol gyors felszívódási és elosztási fázisa miatt ennek a módszernek egyébként kevés szerepe van az idő múlásával.27-29 Aktív szenet csak akkor szabad beadni, ha a beteg szellemileg éber és ép légutakkal rendelkezik. Kerülni kell továbbá azoknál, akiknél fokozott az aspirációs kockázat, a kontrollálatlan hányás, vagy maró vagy görcsoldó szerek együttes fogyasztása.30
Acetilcisztein: Az acetaminofen-toxicitás kezelésének fő pillére az acetilcisztein. Ez a szer feltölti a máj glutationraktárait és fokozza a szulfátkonjugációt, megakadályozva a NAPQI felhalmozódását.31 Az acetilcisztein előnyös lehet az acetaminofen okozta májelégtelenséggel jelentkező betegeknél, mivel javítja a hemodinamikát és az oxigénfelhasználást, csökkenti az agyi ödémát és javítja a mitokondriális energiatermelést.14,22
Acetilcisztein megelőzheti az acetaminofen-túladagolásból eredő májelégtelenséget, ha elég korán adják (az akut túladagolást követő 8-10 órán belül), de még a bevétel után 48 órával is hasznos lehet.6,11,14,31 Az acetaminofen-toxicitás standard nomogramja, a Rumack-Matthew nomogram felhasználható a súlyos májkárosodás valószínűségének meghatározására. Ez azonban hatástalanná válik, amikor az időben többszöri bevétel miatt bekövetkező esetleges toxicitás értékelésére kerül sor, amikor a bevétel időpontja ismeretlen, vagy amikor megváltozott anyagcsere következik be.11 Ezt figyelembe véve acetilciszteint kell adni minden olyan esetben, amikor akut májelégtelenség lép fel, vagy amikor a májtoxicitás bármilyen jele fennáll, és acetaminofen-túladagolás gyanúja merül fel.11
Acetilcisztein szájon át és intravénásan is elérhető; a választás a klinikai forgatókönyvtől függ.21 Az orális adagolás előnyös lehet preklinikai toxikus hatások vagy májkárosodás esetén, bár a megváltozott mentális állapot és a hányás jelenléte korlátozhatja az alkalmazását.22 Az orális acetilcisztein adagolási sémája 140 mg/kg betöltő dózis, majd 17 adag 70 mg/kg 4 óránként összesen 72 órán keresztül.11 Májelégtelenségben szenvedő betegeknél intravénás kezelést kell alkalmazni.22 Folyamatos intravénás infúzió javasolt 150 mg/ttkg infúziós adaggal, 200 ml D5W-ben 60 perc alatt infundálva, amelyet 4 órán keresztül 50 mg/ttkg fenntartó adag követ, majd egy második fenntartó adag 100 mg/ttkg 1000 ml D5W-ben 16 órán keresztül.11 Ha a beteg 40 kg alatti, a folyadékot az irányelveknek megfelelően kell beállítani a folyadék túlterhelés, a hyponatremia és a görcsrohamok elkerülése érdekében. Ha a beteg jól van, de az ajánlott adagolás után még nem épült fel teljesen, az acetilcisztein-terápia folytatható az utolsó orális adaggal vagy az utolsó infúziós adaggal. Az acetilciszteint a protokoll hosszán túl addig kell folytatni, amíg a paracetamol-koncentráció nem lesz kimutatható, a szérum AST értéke normalizálódik vagy jelentősen javul, és a májelégtelenség bármely jele megszűnik.13
Kellemetlen íze és szaga miatt az acetilcisztein szájon át történő adagolásakor gyakran fordul elő hányás.31,32 Az intravénás acetilciszteinnel kapcsolatos mellékhatások közé tartoznak az anafilaktoid reakciók, beleértve a kiütést, viszketést, angioödémát, hörgőgörcsöt, tachikardiát és hipertóniát.31,32 Ezenkívül az intravénás acetilcisztein alkalmazásakor a gyógyszerészeknek tisztában kell lenniük a gyógyszerelési hibák lehetőségével. A bonyolult kezelés, a terápia hossza és az, hogy több egészségügyi szakembernek kell beadnia az adagokat a különböző kezelési helyeken, nagymértékben növeli a hibák kockázatát.33 Egy retrospektív tanulmány az intravénás acetilcisztein alkalmazásakor a gyógyszerelési hibák 33%-os előfordulását állapította meg.33 A leggyakoribb hibatípus, amelyet ebben a tanulmányban találtak, a terápia késése volt, ami potenciálisan csökkentheti az acetilcisztein hatékonyságát. Egy másik gyakran azonosított hiba az acetilcisztein szükségtelen beadása volt, ami szükségtelen költségeket eredményezett. Fontos, hogy az egészségügyi szolgáltatók acetaminofen-túladagolás esetén konzultáljanak a méregközpontokkal. Ők tudnak a legfrissebb adagolási információkkal és protokollokkal szolgálni az acetilcisztein megfelelő adagolásának biztosítása érdekében.
FDA címkézés
A biztonság növelése és a toxicitás csökkentése reményében az FDA már régóta frissíti az acetaminofen használatára vonatkozó ajánlásait. Az 1990-es évek végén egy kutatás kimutatta, hogy a paracetamol az akut májelégtelenség egyik vezető oka az Egyesült Államokban, és az esetek többsége véletlen túladagolásból adódott.34 1998-ban az FDA figyelmeztető címkét adott ki a paracetamolkészítményekre, amely felszólította a napi három alkoholos italnál többet fogyasztó betegeket, hogy a gyógyszer alkalmazása előtt forduljanak orvoshoz. Ahogy teltek az évek, és az acetaminofen és a májtoxicitás közötti összefüggés még nyilvánvalóbbá vált, az FDA összehívott egy értekezletet, hogy e megállapítások alapján cselekedjen. 2002-ben az FDA tanácsadó bizottsága azt javasolta, hogy minden paracetamol-tartalmú terméken helyezzenek el májtoxicitásra vonatkozó figyelmeztetést. 2009-ben új címkézést dolgoztak ki, hogy a betegek könnyen felismerhessék, mely termékek tartalmaznak paracetamolt, csökkentve ezzel a véletlen túladagolás lehetőségét. Később minden vényköteles paracetamolkészítményen fekete dobozos figyelmeztetést helyeztek el, amely hangsúlyozza a súlyos májkárosodás lehetséges kockázatát, és a ritka, de súlyos anafilaxiára és egyéb túlérzékenységi reakciókra vonatkozó figyelmeztetést is bevezettek.34
2013 augusztusában az FDA figyelmeztette a fogyasztókat az acetaminofen használatához kapcsolódó ritka, de súlyos és potenciálisan halálos bőrreakciókra, mint például a Stevens-Johnson-szindróma (SJS), a toxikus epidermális nekrolízis (TEN) és az akut generalizált exanthematózus pustulózis (AGEP).35 A betegeknek tanácsot kell adni a bőrreakciók jeleire és tüneteire, például hámlásra, hólyagosodásra, bőrpírra és a bőr leválására, amelynek során abba kell hagyniuk a további gyógyszerhasználatot és azonnal orvoshoz kell fordulniuk.
Az FDA azt is bejelentette, hogy 2014 januárjától a vényköteles kombinált készítményekben található paracetamol mennyiségét tablettánként vagy kapszulánként 325 mg-ra kell korlátozni.36,37 2011 májusában a vény nélkül kapható paracetamoltermékek gyártói önkéntesen bejelentették, hogy a folyékony paracetamol egyetlen, gyermekeknek szánt erőssége (160 mg/5 ml) lesz az egyetlen elérhető koncentráció; a koncentrált csecsemőcseppeket a továbbiakban nem gyártják.38
Bár történt előrelépés, néhány dolgot még meg kell határozni. Az FDA tanácsadó bizottsága számos olyan változtatás mellett szavazott, amelyekről úgy gondolják, hogy javítják a biztonságot és csökkentik a toxicitást, az FDA azonban még nem tett lépéseket. Például, míg a paracetamol maximális napi adagját korábban 4 g/napban határozták meg, az FDA tanácsadó bizottsága ennek csökkentését javasolja a túladagolások csökkentése érdekében.37 Fontos megjegyezni, hogy néhány gyártó már frissítette a címkézést, hogy tükrözze ezeket az ajánlásokat, bár ez még nem kötelező. Törekvések történnek továbbá a termékek címkézésének javítására, a betegek oktatásának fokozására, egy univerzális gyermekgyógyászati készítmény létrehozására, a paracetamol kombinált termékek megszüntetésére, valamint az OTC paracetamol termékek erősségének 325 mg/tablettára történő csökkentésére, 650 mg-os maximális egyszeri adaggal.37 Bár egyik kérdésben sem született végleges konszenzus, az egészségügyi szolgáltatóknak fel kell világosítaniuk betegeiket a címkén szereplő utasítások betartásának fontosságáról.
A gyógyszerész szerepe
A gyógyszerészek olyan helyzetben vannak, hogy hatékonyan elősegíthetik a paracetamol biztonságos használatát. Sok beteg nincs tisztában a paracetamol maximális napi adagjával és a toxicitás lehetőségével.39 Emellett a betegek nem biztos, hogy értik, hogy a paracetamol több mint 600 különböző termékben található meg.39 Minden olyan betegnek, aki paracetamol tartalmú készítményt kap receptre, tanácsot kell adni, hogy tisztában legyen a hatóanyaggal. A gyógyszerészeknek proaktív szerepet kell vállalniuk a vény nélkül kapható paracetamol tartalmú termékeket vásárló betegek felvilágosításában. A gyógyszerészek létfontosságúak az acetaminofennel való visszaélés megelőzésében, mivel a betegek felvilágosítása és a betegek gyógyszerelési kórtörténetének áttekintése révén garantálják a gyógyszer biztonságos használatát.
A gyógyszerészeknek emellett azt kell javasolniuk, hogy a betegek lépjenek kapcsolatba a nemzeti mérgezési segélyvonallal, ha acetaminofen-túladagolás gyanúja merül fel. Az ingyenes telefonszám: 1-800-222-1222.40 Ha ezt a számot hívják, a betegeket a legközelebbi regionális mérgezéselhárító központhoz kapcsolják, ahol a hét minden napján, a nap 24 órájában elérhetőek a szakemberek. Ezek a szakemberek segíteni tudnak a lehetséges paracetamol-túladagolás értékelésében és kezelésében. Ezek a tevékenységek minimalizálják a nem megfelelő adagolás, a terápia megkettőzésének és a nem megfelelő gyógyszerhasználatnak a kockázatát.
1. Kaufman DW, Kelly JP, Rosenberg L, et al. Recent patterns of medication use in the ambulatory adult population of the United States: the Slone survey. JAMA. 2002;287:337-344.
2. Paulose-Ram R, Hirsch R, Dillon C, et al. Prescription and nonprescription analgesic use among the US adult population: results from the third National Health and Nutrition Examination Survey (NHANES III). Pharmacoepidemiol Drug Saf. 2003;12:315-326.
3. Paulose-Ram R, Hirsch R, Dillon C, et al. Frequent monthly use of selected non prescription and prescription non-narcotic analgesics among U.S. adults. Pharmacoepidemiol Drug Saf. 2005;14:257-266.
4. Burke A, Smyth EM, Fitzgerald GA. Fájdalomcsillapító-lázcsillapítók; a köszvény farmakoterápiája. In: Brunton LL, Laso JS, Parker K, szerk. Goodman and Gilman’s the Pharmacological Basis of Therapeutics. 11. kiadás. New York, NY: McGraw-Hill; 2006:671-716.
5. Watkins PB, Kaplowitz N, Slattery JT, et al. Amino-transzferáz emelkedések egészséges felnőtteknél, akik napi 4 gramm paracetamolt kapnak: randomizált, kontrollált vizsgálat. JAMA. 2006;296:87-93.
6. Chun LJ, Tong MJ, Busuttil RW, et al. Acetaminophen hepatotoxicity and acute liver failure. J Clin Gastroenterol. 2009;43:342-349.
7. Bronstein AC, Spyker DA, Cantilena LR, et al. 2011 annual report of the American Association of Poison Control Centers’ National Poison Data System (NPDS): 29th annual report. Clin Toxicol. 2012;50:911-1164.
8. Schilling A, Corey R, Leonard M, et al. Acetaminophen: régi gyógyszer, új figyelmeztetések. Cleve Clin J Med. 2010;77:19-27.
9. Nourjah P, Ahmad SR, Karwoski C, et al. Becslések az acetaminofen (paracetamol) okozta túladagolásokról az Egyesült Államokban. Pharmacoepidemiol Drug Saf. 2006;15:398-405.
10. Larson AM, Polson J, Fontana RJ, et al. Acetaminophen-indukált akut májelégtelenség: egy egyesült államokbeli multicentrikus, prospektív vizsgálat eredményei. Hepatológia. 2005;42:1364-1372.
11. Lee WM, Larson AM, Stravitz T. AASLD állásfoglalás: Az akut májelégtelenség kezelése: frissítés 2011. Baltimore, MD: American Association for the Study of Liver Diseases; 2011. szeptember. www.aasld.org/practiceguidelines/Documents/AcuteLiverFailureUpdate2011.pdf. Hozzáférés 2013. december 15.
12. Tylenol (paracetamol) szakmai termékismertető. Fort Washington, PA: McNeil Consumer Healthcare; 2010.
13. Hendrickson RG. Paracetamol. In: Nelson LS, Lewin NA, Howland M, szerk. Goldfrank’s Toxicologic Emergencies. 9. kiadás. New York, NY: McGraw-Hill; 2011:483-99.
14. Hodgman MJ, Garrard AR. Az acetaminofen-mérgezés áttekintése. Crit Care Clin. 2012;499-516.
15. Larson AM. Paracetamol hepatotoxicitás. Clin Liver Dis. 2007;11:525-548.
16. Rumack BH. Paracetamol hepatotoxicitás: az első 35 év. J Toxicol Clin Toxicol. 2002;40:3-20.
17. Nelson SD. Az acetaminofen által okozott hepatotoxicitás molekuláris mechanizmusai. Semin Liver Dis. 1990;10:267-278.
18. Lee WH. Gyógyszer okozta hepatotoxicitás. N Engl J Med. 1995;333:1118-1127.
19. Fontana RJ. Akut májelégtelenség paracetamol-túladagolással együtt. Med Clin North Am. 2008;92:761-794.
20. Amerikai Gyermekgyógyászati Akadémia Kábítószerügyi Bizottsága. Paracetamol-toxicitás gyermekeknél. Pediatrics. 2001;108:1020-1024.
21. Dart RC, Erdman AR, Olson KR, et al. Acetaminofen mérgezés: bizonyítékokon alapuló konszenzusos irányelv a kórházon kívüli kezeléshez. Clin Toxicol. 2006;44:1-18.
22. Heard KJ. Acetilcisztein paracetamol-mérgezés esetén. N Engl J Med. 2008;359:285-292.
23. Ferner RE, Dear JW, Bateman DN. A paracetamol-mérgezés kezelése. BMJ. 2011;342:d2218.
24. Kuffner EK, Dart RC, Bogdan GM, et al. A napi maximális paracetamol adagok hatása alkoholbetegek májára: randomizált, kettős vak, placebokontrollált vizsgálat. Arch Intern Med. 2001;161:2247-2252.
25. Kuffner EK, Green JL, Bogdan GM, et al. A paracetamol (napi négy gramm három egymást követő napon át) hatása alkoholos betegek májvizsgálataira – egy multicentrikus randomizált vizsgálat. BMC Med. 2007;5:13.
26. Rumack BH. Paracetamol tévhitek. Hepatology. 2004;40:10-15.
27. Christophersen AB, Levin D, Hoegberg LC, et al. Aktivált szén önmagában vagy gyomormosást követően: szimulált nagy paracetamolmérgezés. Br J Clin Pharmacol. 2002;53;312-317.
28. Sato RL, Wong JJ, Sumida SM, et al. A szuperaktivált faszén késői (3 óra) adagolásának hatékonysága paracetamol-túladagolás után. Am J Emerg Med. 2003;21:189-191.
29. Spiller HA, Winter ML, Klein-Schwartz W, et al. A paracetamol-túladagolás után több mint négy órával beadott aktív szén hatékonysága. J Emerg Med. 2006;30:1-5.
30. Chyka PA, Seger D, Krenzelok EP, et al. Position paper: single-dose activated charcoal. Clin Toxicol. 2005;43:61-87.
31. Kozer E, Koren G. A paracetamol-túladagolás kezelése: jelenlegi ellentmondások. Gyógyszerbiztonság. 2001;24:503-512.
32. Sandilands EA, Bateman DN. Az acetilciszteinnel kapcsolatos mellékhatások. Clin Toxicol. 2009;47:81-88.
33. Hayes BD, Klein-Schwartz W, Doyon S. Gyógyszerhibák gyakorisága intravénás acetilcisztein alkalmazása esetén paracetamol túladagolás esetén. Ann Pharmacother. 2008;42:766-770.
34. 2009. június 29-30: A gyógyszerbiztonsági és kockázatkezelési tanácsadó bizottság közös ülése az aneszteziológiai és életfenntartó gyógyszerek tanácsadó bizottságával és a vény nélkül kapható gyógyszerek tanácsadó bizottságával: Az FDA tájékoztató anyaga. Frissítve 2013. július 30-án. www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/DrugSafetyandRiskManagementAdvisoryCommittee/UCM164897.pdf. Hozzáférés 2013. december 15.
35. Az FDA gyógyszerbiztonsági közleménye: Az FDA figyelmeztet a fájdalomcsillapító/lázcsillapító paracetamol ritka, de súlyos bőrreakcióira. 2013. augusztus 1. www.fda.gov/Drugs/DrugSafety/ucm363041.htm. Hozzáférés 2013. december 16.
36. Az FDA gyógyszerbiztonsági közleménye: A vényköteles paracetamolkészítményeket adagolási egységenként 325 mg-ra kell korlátozni; a dobozos figyelmeztetés felhívja a figyelmet a súlyos májelégtelenség lehetőségére. 2011. január 13. www.fda.gov/Drugs/DrugSafety/ucm239821.htm. Hozzáférés 2013. december 16.
37. Krenzelok EP. Kommentár: Az FDA acetaminofenes tanácsadó bizottságának ülése. Mi lesz a paracetamol jövője az Egyesült Államokban? Egy bizottsági tag nézőpontja. Clin Toxicol. 2009;47:784-789.
38. Pappas M, Bryan K. Az OTC-iparág önkéntes átállást jelent be az egy hatóanyagú folyékony gyermekgyógyászati paracetamol-gyógyszerek egy koncentrációjára. Egészségügyi fogyasztási cikkek. May 11, 2011. www.chpa.org/05_04_11_PedAcet.aspx. Hozzáférés 2013. december 15.
39. Hornsby LB, Whitley HP, Hester EK, et al. Az acetaminofen felismerésével, adagolásával és toxicitásával kapcsolatos betegismeretek felmérése. J Am Pharm Assoc. 2010;50:485-489.
40. American Association of Poison Control Centers. www.aapcc.org. Hozzáférés 2014. február 25.
.