US Pharm. 2014;39(3):HS2-HS8.
ABSTRACT: Toxicitatea paracetamolului este una dintre cele mai frecvente cauze de otrăvire atât intenționată, cât și neintenționată în Statele Unite. A devenit cea mai frecventă cauză de insuficiență hepatică acută și a doua cea mai răspândită cauză de insuficiență hepatică care necesită transplant. Paracetamolul este adesea recomandat de către medici și foarte utilizat de către pacienți, atât în produse cu prescripție medicală, cât și în produse OTC, pentru o varietate de afecțiuni. FDA își actualizează de mult timp recomandările privind utilizarea paracetamolului pentru a contribui la îmbunătățirea siguranței pacienților. Acest articol trece în revistă etiologia, semnele și simptomele toxicității paracetamolului și rolul farmacistului în prevenirea abuzului de paracetamol.
Acetaminofenul este adesea recomandat de medici și foarte utilizat de pacienți atât în produsele cu prescripție medicală, cât și în cele OTC pentru o varietate de afecțiuni, ceea ce îl face, fără îndoială, unul dintre cele mai frecvente medicamente întâlnite de farmaciști.1-3 În Statele Unite, 40% din populația adultă a raportat că utilizează paracetamol OTC lunar, iar 23% din populația adultă a raportat că utilizează săptămânal paracetamol OTC sau pe bază de prescripție medicală.1,2
Acetaminofenul (paracetamol sau APAP) are proprietăți analgezice și antipiretice similare cu cele ale aspirinei, dar proprietăți antiinflamatorii minime.4 Este indicat pentru dureri ușoare până la moderate sau febră și nu este asociat cu disconfort gastric sau sângerare la dozele recomandate. Atunci când este utilizat în mod corespunzător, are un profil de siguranță și eficacitate foarte bine stabilit.5 Cu toate acestea, hepatotoxicitatea este o consecință frecventă a consumului excesiv, care poate duce la o serie de probleme, inclusiv anomalii ale funcției hepatice, insuficiență hepatică acută și chiar deces.6
Toxicitatea paracetamolului este una dintre cele mai frecvente cauze de otrăvire intenționată și neintenționată în S.U.A. De fapt, a existat o creștere constantă a incidenței toxicității legate de paracetamol în ultimul deceniu.7,8 Acest lucru este probabil atribuit disponibilității pe scară largă a paracetamolului, atât ca ingredient unic, cât și în combinație cu alte medicamente eliberate pe bază de rețetă și OTC, în diferite concentrații și formulări. Supradozele asociate cu paracetamol reprezintă aproximativ 56.000 de vizite la serviciile de urgență, 26.000 de spitalizări și peste 450 de decese anual.9 Toxicitatea hepatică indusă de paracetamol a devenit cea mai frecventă cauză de insuficiență hepatică acută și a doua cauză de insuficiență hepatică care necesită transplant.10,11 Prin urmare, este imperativ ca farmaciștii să recunoască semnele și simptomele supradozajului și ale toxicității și să își sfătuiască pacienții cu privire la dozarea și utilizarea corectă.
Farmacocinetică
După ingestie, paracetamolul este absorbit rapid din tractul gastrointestinal (GI) și distribuit rapid în tot corpul. Concentrațiile plasmatice maxime sunt atinse în decurs de 30 până la 60 de minute4; alimentele pot întârzia timpul până la concentrația maximă, dar gradul de absorbție nu este afectat.12 În cazul supradozelor, concentrațiile plasmatice maxime sunt de obicei atinse în decurs de 4 ore.13 Timpul de înjumătățire al paracetamolului este de aproximativ 2 până la 3 ore după doze terapeutice, dar poate crește la peste 4 ore la pacienții cu leziuni hepatice.4,12,14
Acetaminofenul este metabolizat extensiv de către ficat prin trei căi hepatice principale: glucuronidarea, sulfatarea și oxidarea CYP450 2E1.12 Aproximativ 90% din paracetamol este conjugat în metaboliți sulfatați și glucuronidați care sunt eliminați pe cale renală.14 Din restul paracetamolului, aproximativ 2% este excretat neschimbat în urină, iar restul este supus oxidării mediate de CYP450 pentru a forma un metabolit reactiv, N-acetil-p-benzochinona imină (NAPQI).15-18 În condiții normale, acest metabolit toxic reacționează cu grupările sulfhidril din glutation, transformându-l în metaboliți inofensivi înainte de a fi excretat în urină.4
Toxicitate
Medicamentele pot avea efecte toxice din diverse motive. Toxicitatea unor medicamente este legată de formarea unui metabolit nedorit; în consecință, toxicitatea paracetamolului este legată de producerea de NAPQI. În cazul unor doze acute mari sau în cazul utilizării cronice, căile metabolice majore – sistemele de conjugare glucuronidă și sulfat – devin saturate și mai mult paracetamol este metabolizat de sistemul CYP450. Aceasta are ca rezultat o producție crescută de NAPQI. Atunci când glutationul este epuizat în proporție de aproximativ 70%, NAPQI începe să se acumuleze în hepatocite, ceea ce duce la leziuni hepatice.15,16,18 Prin urmare, înlocuirea glutationului cu compuși care imită glutationul, cum ar fi N-acetilcisteina, servește ca antidot util pentru toxicitatea paracetamolului.
Toxicitatea paracetamolului poate rezulta fie dintr-un supradozaj acut, fie dintr-o utilizare excesivă cronică. Supradozajul acut este definit ca fiind consumul unei cantități toxice de medicament într-o perioadă de 8 ore, în timp ce supradozajul cronic apare ca urmare a unor doze repetate la sau peste limita recomandată.12 Supradozele neintenționate pot apărea, de asemenea, ca urmare a ingestiei mai multor produse care conțin paracetamol. Doza recomandată de paracetamol la adulți este de 650 până la 1.000 mg la fiecare 4 până la 6 ore, fără a depăși 4.000 mg într-o perioadă de 24 de ore; la copii, doza recomandată este de 10 până la 15 mg/kg la fiecare 4 până la 6 ore, fără a depăși 50 până la 70 mg/kg în 24 de ore.12 Dozele unice de peste 150 mg/kg sau 7,5 g la adulți au fost considerate potențial toxice, deși doza minimă asociată cu leziuni hepatice poate varia de la 4 până la 10 g.6,12,14,19 La copii, doze unice de 120 mg/kg până la 150 mg/kg au fost asociate cu hepatotoxicitate; cu toate acestea, este puțin probabil ca dozele <200 mg/kg să ducă la toxicitate.14,20
În timp ce doza maximă exactă nu a fost bine definită, Asociația Americană a Centrelor de Control Toxicologic (AAPCC) a recomandat ca, indiferent de cantitatea de medicament ingerată, un pacient să fie adus pentru evaluare medicală dacă prezintă semne sau simptome compatibile cu toxicitatea.21 AAPCC a oferit ghiduri de trimitere la spital atât pentru ingestia acută, unică, neintenționată de paracetamol, cât și pentru ingestia repetată supraterapeutică de paracetamol (TABELUL 1).21
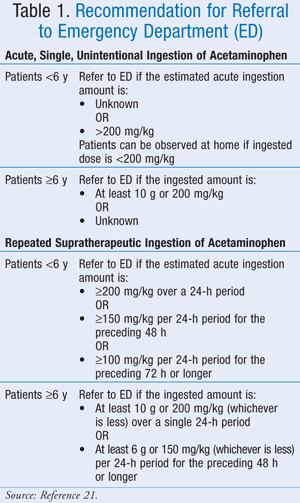
Prezentare clinică
Indiferent dacă toxicitatea acetaminofenului apare din cauza unui supradozaj unic sau după ingestia supraterapeutică repetată, evoluția intoxicației cu paracetamol poate fi descrisă în patru faze secvențiale: efecte toxice preclinice (faza unu), leziuni hepatice (faza doi), insuficiență hepatică (faza trei) și recuperare (faza patru).6,22 Pacienții tratați în faza preclinică pot dezvolta leziuni hepatice tranzitorii, dar se pot recupera complet.22 Pacienții care nu sunt tratați până când leziunile hepatice sunt deja evidente au un prognostic variabil; cu toate acestea, cei care se prezintă cu insuficiență hepatică au o rată de mortalitate de 20% până la 40%.22
Prima fază apare la câteva ore după ingestia unei doze toxice și durează între 12 și 24 de ore. Este important de remarcat întârzierea apariției simptomelor, deoarece furnizorii de asistență medicală trebuie să înțeleagă implicațiile toxicității care vor urma acestei perioade de liniște. Simptomele din primele 24 de ore nu sunt diagnostice sau specifice și includ greață, vărsături, diaforeză, anorexie și letargie, a căror severitate va fi în corelație directă cu mărimea dozei ingerate.8
În a doua fază, care apare până la 24 până la 48 de ore de la ingestie, poate exista un fals sentiment de recuperare, deoarece simptomele gastrointestinale se ameliorează sau dispar.6,8 Cu toate acestea, pe măsură ce hepatotoxicitatea continuă să apară, pot apărea dureri abdominale sau sensibilitate în cadranul superior drept. În plus, valorile de laborator vor începe să arate dovezi de hepatotoxicitate; enzimele hepatice, lactatul, fosfatul, timpul de protrombină și raportul internațional normalizat (INR) vor crește dramatic.6,8,12 Majoritatea pacienților nu progresează dincolo de acest stadiu, mai ales dacă se administrează antidotul acetilcisteină.8,12
Câțiva pacienți vor progresa până la fraza a treia, care apare de obicei la 3 până la 5 zile de la postare. Această fază se caracterizează prin reapariția sau agravarea grețurilor și vărsăturilor însoțite de stare de rău, icter și simptome nervoase centrale, inclusiv confuzie, somnolență și comă.6 Poate apărea necroza hepatică gravă și posibil fatală. Deși mai puțin frecventă, insuficiența renală, demonstrată prin oligurie, se poate manifesta ca urmare a necrozei tubulare induse de paracetamol.6,8,12 Nivelurile enzimelor hepatice vor atinge cote maxime, ajungând să măsoare până la 10.000 UI/L. Icterul, hipoglicemia, hemoragia și anomaliile de coagulare și encefalopatia hepatică vor fi, de asemenea, evidente.8,12 Decesul poate surveni ca urmare a complicațiilor asociate cu insuficiența hepatică, inclusiv insuficiența sistemului multiorganic, edemul cerebral și sepsisul.15
În cele din urmă, faza a patra implică supraviețuirea și recuperarea, în general cu revenirea funcției hepatice complete și fără efecte pe termen lung.6 Aproximativ 70% dintre pacienții care intră în faza patru se recuperează complet, în timp ce 1% până la 2% dintre pacienți dezvoltă insuficiență hepatică fatală.6 Toxicitatea severă, netratată a paracetamolului va duce la deces în decurs de 4 până la 18 zile de la ingestie.6
Pacienți cu risc crescut
Pentru că mecanismul de toxicitate a paracetamolului are loc prin formarea de NAPQI, orice factor care influențează disponibilitatea enzimelor metabolice va afecta, prin urmare, toxicitatea. Consumul de alcool, malnutriția și inducerea enzimelor CYP450 de către medicamente, inclusiv tratamentul pe termen lung cu carbamazepină, primidonă, rifampicină, efavirenz și sunătoare, pot influența modul în care un individ răspunde la paracetamol23. Pacienții afectați de oricare dintre factorii de mai sus trebuie identificați pentru ca farmaciștii să îi poată consilia îndeaproape cu privire la modul în care să utilizeze paracetamolul în condiții de siguranță.
Acutanat, etanolul servește atât ca substrat pentru CYP2E1, cât și ca inhibitor al acestuia, limitând cantitatea de NAPQI formată. Dimpotrivă, în cazul consumului cronic de alcool, etanolul este un inductor al CYP2E1, ceea ce duce la o potențială creștere a formării de NAPQI în cazul în care apare un supradozaj de paracetamol. O altă consecință a consumului cronic de alcool este epuizarea depozitelor de glutation, reducând ultima apărare împotriva formării de NAPQI.17 Nu există dovezi care să sugereze că utilizarea paracetamolului în doze terapeutice este toxică la o persoană alcoolică; prin urmare, în cantități terapeutice paracetamolul poate fi utilizat în siguranță atât în mod acut, cât și cronic.23-25
Deși controversată, înfometarea (postul prelungit) și malnutriția sunt factori de risc suplimentari pentru toxicitatea paracetamolului.16,18,23 Similar consumului cronic de alcool, malnutriția determină epuizarea depozitelor de glutation. Cu toate acestea, există, de asemenea, dovezi că funcția CYP2E1 este redusă în mod semnificativ la această populație de pacienți. Aceste efecte s-ar contracara astfel reciproc, ceea ce ar putea duce la o eventuală neschimbare a toxicității.26 Cu toate acestea, este totuși prudent să se identifice astfel de pacienți și să se avertizeze cu privire la potențialul lor de risc crescut.
Management
La prezentare, pacientul trebuie evaluat amănunțit. Trebuie obținut un istoric medicamentos recent detaliat. Nivelurile serice de paracetamol ar trebui, în mod ideal, să fie prelevate la cel puțin 4 ore după ingestie. Farmaciștii pot juca un rol important prin colectarea de informații pertinente, cum ar fi cantitatea de medicament administrată, forma farmaceutică ingerată, perioada de timp care a trecut de la ultima doză ingerată și dacă au fost consumate și alte medicamente. Toți acești factori sunt importanți atunci când se analizează concentrațiile serice de paracetamol.
Dacă pacientul se prezintă în decurs de o oră de la ingestie, se poate lua în considerare decontaminarea gastrică; cărbunele activat este singura metodă de decontaminare gastrointestinală recomandată. Administrarea de cărbune activat poate fi luată în considerare, în special la pacienții care au ingerat formulări de paracetamol cu eliberare întârziată sau care au consumat alte medicamente care ar putea încetini absorbția paracetamolului.12 Cu toate acestea, datorită fazelor de absorbție și distribuție rapidă a paracetamolului, în rest, această metodă are un rol redus pe măsură ce trece timpul.27-29 Cărbunele activat trebuie administrat numai dacă pacientul este alert din punct de vedere mental și are căile respiratorii intacte. De asemenea, trebuie evitat la cei care prezintă un risc crescut de aspirație, vărsături necontrolate sau coingestie a unui coroziv sau proconvulsivant.30
Acetilcisteină: Principalul pilon al tratamentului pentru toxicitatea paracetamolului este acetilcisteina. Acest agent reface depozitele hepatice de glutation și crește conjugarea sulfatului, împiedicând acumularea de NAPQI.31 Acetilcisteina poate fi benefică la pacienții care prezintă insuficiență hepatică indusă de paracetamol, deoarece îmbunătățește hemodinamica și utilizarea oxigenului, scade edemul cerebral și îmbunătățește producția de energie mitocondrială.14,22
Acetilcisteina poate preveni insuficiența hepatică în urma unui supradozaj de paracetamol atunci când este administrată suficient de devreme (în decurs de 8-10 ore după un supradozaj acut), dar poate fi încă utilă până la 48 de ore de la ingestie.6,11,14,31 Nomograma standard de toxicitate a paracetamolului, nomograma Rumack-Matthew, poate fi utilizată pentru a determina probabilitatea unei leziuni hepatice grave. Cu toate acestea, ea devine ineficientă atunci când se evaluează posibila toxicitate datorată unor ingestii multiple de-a lungul timpului, atunci când momentul ingerării este necunoscut sau când are loc o alterare a metabolismului.11 Având în vedere acest lucru, acetilcisteina trebuie administrată în orice caz de insuficiență hepatică acută sau atunci când există orice dovadă de toxicitate hepatică în care se suspectează supradozaj de paracetamol.11
Acetilcisteina este disponibilă pe cale orală și intravenoasă; alegerea depinde de scenariul clinic.21 Administrarea orală poate fi benefică pentru pacienții cu efecte toxice preclinice sau cu leziuni hepatice, deși prezența stării mentale alterate și a vărsăturilor poate limita utilizarea acesteia.22 Regimul de administrare a acetilcisteinei pe cale orală este o doză de încărcare de 140 mg/kg, urmată de 17 doze de 70 mg/kg la fiecare 4 ore pentru un total de 72 de ore.11 Pacienții cu insuficiență hepatică trebuie să primească tratament intravenos.22 Se recomandă o perfuzie intravenoasă continuă cu o doză de încărcare de 150 mg/kg IV în 200 ml D5W perfuzată timp de 60 de minute, urmată de o doză de întreținere de 50 mg/kg timp de 4 ore, urmată de o a doua doză de întreținere de 100 mg/kg în 1.000 ml D5W administrată timp de 16 ore.11 Dacă pacientul are sub 40 kg, lichidul trebuie ajustat conform ghidurilor pentru a evita supraîncărcarea cu lichid, hiponatremia și convulsiile. Dacă pacientul se simte bine, dar nu și-a revenit complet după administrarea recomandată, tratamentul cu acetilcisteină poate fi continuat folosind fie ultima doză orală, fie ultima rată de perfuzie IV. Acetilcisteina trebuie continuată dincolo de durata protocolului până când concentrațiile de paracetamol sunt nedetectabile, AST seric s-a normalizat sau s-a îmbunătățit semnificativ și există rezolvarea oricărei dovezi de insuficiență hepatică.13
Din cauza gustului și mirosului său neplăcut, la administrarea orală a acetilcisteinei apar frecvent vărsături.31,32 Efectele adverse asociate cu acetilcisteina intravenoasă includ reacții anafilactoide, inclusiv erupții cutanate, prurit, angioedem, bronhospasm, tahicardie și hipertensiune.31,32 În plus, atunci când se utilizează acetilcisteina intravenoasă, farmaciștii trebuie să fie conștienți de potențialul de erori de medicație. Regimul complicat, durata terapiei și necesitatea ca mai mulți profesioniști din domeniul sănătății să administreze doze în diferite locuri de tratament cresc foarte mult riscul de erori.33 Un studiu retrospectiv a identificat o incidență de 33% a erorilor de medicație cu acetilcisteină intravenoasă.33 Cel mai frecvent tip de eroare constatat în acest studiu a fost întârzierea tratamentului, ceea ce poate reduce potențial eficacitatea acetilcisteinei. O altă eroare frecventă identificată a fost administrarea inutilă de acetilcisteină, ceea ce a dus la costuri inutile. Este important ca furnizorii de asistență medicală să se consulte cu centrele de otrăvire în cazul supradozelor de paracetamol. Aceștia pot furniza cele mai actualizate informații despre dozare și protocoale pentru a asigura administrarea corectă a acetilcisteinei.
Etichetarea FDA
În speranța de a crește siguranța și de a reduce toxicitatea, FDA își actualizează de mult timp recomandările privind utilizarea paracetamolului. La sfârșitul anilor 1990, cercetările au demonstrat că paracetamolul era una dintre principalele cauze de insuficiență hepatică acută în SUA, majoritatea cazurilor fiind rezultatul unor supradoze accidentale.34 În 1998, FDA a emis o etichetă de avertizare pe produsele pe bază de paracetamol care îi îndemna pe pacienții care consumau mai mult de trei băuturi alcoolice pe zi să consulte un medic înainte de a utiliza acest medicament. Pe măsură ce anii treceau și corelația dintre paracetamol și toxicitatea hepatică devenea și mai evidentă, FDA a convocat o reuniune pentru a lua măsuri în urma acestor constatări. În 2002, Comitetul consultativ al FDA a recomandat plasarea unui avertisment privind toxicitatea hepatică pe toate produsele care conțin paracetamol. În 2009, a fost elaborată o nouă etichetare pentru a-i ajuta pe pacienți să identifice cu ușurință ce produse conțin paracetamol, reducând potențialul de supradoze accidentale. Ulterior, pe toate produsele care se eliberează pe bază de prescripție medicală cu paracetamol a fost plasat un avertisment de tip „black box” care subliniază riscul potențial de leziuni hepatice grave și a fost implementat un avertisment privind anafilaxia rară, dar gravă, și alte reacții de hipersensibilitate.34
În august 2013, FDA a avertizat consumatorii cu privire la reacții cutanate rare, dar grave și potențial fatale, cum ar fi sindromul Stevens-Johnson (SJS), necroliza epidermică toxică (TEN) și pustuloza exantematoasă generalizată acută (AGEP), legate de utilizarea paracetamolului.35 Pacienții trebuie sfătuiți în legătură cu semnele și simptomele reacțiilor cutanate, cum ar fi descuamarea, formarea de vezicule, înroșirea și desprinderea pielii, în care trebuie să întrerupă orice altă utilizare a medicamentului și să solicite imediat asistență medicală.
De asemenea, FDA a anunțat că, începând cu ianuarie 2014, cantitatea de paracetamol care se găsește în produsele combinate eliberate pe bază de rețetă trebuie să fie limitată la 325 mg pe comprimat sau capsulă.36,37 În mai 2011, producătorii de produse pe bază de paracetamol eliberate fără prescripție medicală au anunțat în mod voluntar că o singură concentrație de paracetamol lichid pentru copii (160 mg/5 ml) va fi singura concentrație disponibilă; picăturile concentrate pentru sugari nu vor mai fi produse.38
Deși s-au făcut progrese, unele lucruri sunt încă de stabilit. Comitetul consultativ al FDA a votat în favoarea multor schimbări considerate a îmbunătăți siguranța și a diminua toxicitatea, dar FDA nu a luat încă măsuri. De exemplu, în timp ce doza zilnică maximă de paracetamol a fost stabilită anterior la 4 g/zi, Comitetul consultativ al FDA sugerează diminuarea acesteia în efortul de a reduce supradozele.37 Este important de remarcat faptul că unii producători și-au actualizat deja etichetarea pentru a reflecta aceste recomandări, deși nu este încă obligatoriu să facă acest lucru. De asemenea, se depun eforturi pentru a îmbunătăți etichetarea produselor, pentru a spori educația pacienților, pentru a crea o formulă pediatrică universală, pentru a elimina produsele combinate cu paracetamol și pentru a reduce concentrația produselor OTC cu paracetamol la 325 mg pe tabletă, cu o doză unică maximă de 650 mg.37 Deși nu s-a ajuns la un consens final cu privire la niciunul dintre aceste aspecte, furnizorii de servicii medicale ar trebui să își educe pacienții cu privire la importanța respectării instrucțiunilor de pe etichetă.
Rolul farmacistului
Farmaciștii sunt în măsură să promoveze în mod eficient utilizarea sigură a paracetamolului. Mulți pacienți nu sunt conștienți de doza zilnică maximă de paracetamol și de potențialul de toxicitate.39 În plus, este posibil ca pacienții să nu înțeleagă că paracetamolul este conținut în peste 600 de produse diferite.39 Toți pacienții care primesc o rețetă pentru un produs care conține paracetamol trebuie să fie consiliați pentru a asigura cunoașterea ingredientului activ. Farmaciștii trebuie să-și asume un rol proactiv în educarea pacienților care cumpără produse cu paracetamol fără prescripție medicală. Farmaciștii sunt esențiali în prevenirea abuzului de paracetamol, garantând utilizarea sigură a medicamentului prin educarea pacienților și prin revizuirea istoricului de medicație al pacienților.
În plus, farmaciștii trebuie să le recomande pacienților să contacteze linia națională de asistență toxicologică dacă suspectează un supradozaj de paracetamol. Numărul gratuit este 1-800-222-1222.40 Prin apelarea acestui număr, pacienții vor fi conectați la cel mai apropiat centru regional de control al otrăvurilor cu specialiști disponibili 24 de ore pe zi, 7 zile pe săptămână. Acești specialiști vor putea ajuta la evaluarea și gestionarea potențialului supradozaj de paracetamol. Astfel de activități vor minimiza riscul de dozare necorespunzătoare, de dublare a terapiei și de utilizare necorespunzătoare a medicamentelor.
1. Kaufman DW, Kelly JP, Rosenberg L, et al. Modele recente de utilizare a medicamentelor în populația adultă ambulatorie din Statele Unite: sondajul Slone. JAMA. 2002;287:337-344.
2. Paulose-Ram R, Hirsch R, Dillon C, et al. Prescription and nonprescription analgesic use among the US adult population: results from the third National Health and Nutrition Examination Survey (NHANES III). Pharmacoepidemiol Drug Saf. 2003;12:315-326.
3. Paulose-Ram R, Hirsch R, Dillon C, et al. Utilizarea lunară frecventă a unor analgezice non-narcotice cu și fără prescripție medicală în rândul adulților din SUA. Pharmacoepidemiol Drug Saf. 2005;14:257-266.
4. Burke A, Smyth EM, Fitzgerald GA. Agenți analgezici-antipiretici; farmacoterapia gutei. În: Gută: Brunton LL, Laso JS, Parker K, eds. Goodman și Gilman’s the Pharmacological Basis of Therapeutics. Ediția a 11-a. New York, NY: McGraw-Hill; 2006:671-716.
5. Watkins PB, Kaplowitz N, Slattery JT, et al. Ridicări ale amino-transferazelor la adulții sănătoși care primesc 4 grame de paracetamol zilnic: un studiu controlat randomizat. JAMA. 2006;296:87-93.
6. Chun LJ, Tong MJ, Busuttil RW, et al. Hepatotoxicitatea paracetamolului și insuficiența hepatică acută. J Clin Gastroenterol. 2009;43:342-349.
7. Bronstein AC, Spyker DA, Cantilena LR, et al. 2011 annual report of the American Association of Poison Control Centers’ National Poison Data System (NPDS): 29th annual report. Clin Toxicol. 2012;50:911-1164.
8. Schilling A, Corey R, Leonard M, et al. Acetaminofen: medicament vechi, avertismente noi. Cleve Clin J Med. 2010;77:19-27.
9. Nourjah P, Ahmad SR, Karwoski C, et al. Estimări ale supradozelor asociate cu paracetamol (acetaminofen) în Statele Unite. Pharmacoepidemiol Drug Saf. 2006;15:398-405.
10. Larson AM, Polson J, Fontana RJ, et al. Insuficiență hepatică acută indusă de paracetamol: rezultatele unui studiu multicentric și prospectiv din Statele Unite. Hepatologie. 2005;42:1364-1372.
11. Lee WM, Larson AM, Stravitz T. AASLD position paper: the management of acute liver failure: update 2011. Baltimore, MD: American Association for the Study of Liver Diseases; septembrie 2011. www.aasld.org/practiceguidelines/Documents/AcuteLiverFailureUpdate2011.pdf. Accesat la 15 decembrie 2013.
12. Tylenol (paracetamol) informații profesionale despre produs. Fort Washington, PA: McNeil Consumer Healthcare; 2010.
13. Hendrickson RG. Acetaminofen. În: Atroce: Nelson LS, Lewin NA, Howland M, eds. Goldfrank’s Toxicologic Emergencies. Ediția a 9-a. New York, NY: McGraw-Hill; 2011:483-99.
14. Hodgman MJ, Garrard AR. O revizuire a otrăvirii cu paracetamol. Crit Care Clin. 2012;499-516.
15. Larson AM. Hepatotoxicitatea acetaminofenului. Clin Liver Dis. 2007;11:525-548.
16. Rumack BH. Hepatotoxicitatea acetaminofenului: primii 35 de ani. J Toxicol Clin Toxicol. 2002;40:3-20.
17. Nelson SD. Mecanismele moleculare ale hepatotoxicității cauzate de paracetamol. Semin Liver Dis. 1990;10:267-278.
18. Lee WH. Hepatotoxicitatea indusă de medicamente. N Engl J Med. 1995;333:1118-1127.
19. Fontana RJ. Insuficiența hepatică acută incluzând supradozajul de paracetamol. Med Clin North Am. 2008;92:761-794.
20. Comisia pentru medicamente a Academiei Americane de Pediatrie. Toxicitatea acetaminofenului la copii. Pediatrie. 2001;108:1020-1024.
21. Dart RC, Erdman AR, Olson KR, et al. Intoxicația cu paracetamol: un ghid de consens bazat pe dovezi pentru gestionarea în afara spitalului. Clin Toxicol. 2006;44:1-18.
22. Heard KJ. Acetilcisteina pentru intoxicația cu paracetamol. N Engl J Med. 2008;359:285-292.
23. Ferner RE, Dear JW, Dear JW, Bateman DN. Managementul intoxicației cu paracetamol. BMJ. 2011;342:d2218.
24. Kuffner EK, Dart RC, Bogdan GM, et al. Efectul dozelor zilnice maxime de paracetamol asupra ficatului pacienților alcoolici: un studiu randomizat, dublu-orb, controlat cu placebo. Arch Intern Med. 2001;161:2247-2252.
25. Kuffner EK, Green JL, Bogdan GM, et al. Efectul paracetamolului (patru grame pe zi timp de trei zile consecutive) asupra testelor hepatice la pacienții alcoolici – un studiu multicentric randomizat. BMC Med. 2007;5:13.
26. Rumack BH. Concepții greșite despre paracetamol. Hepatologie. 2004;40:10-15.
27. Christophersen AB, Levin D, Hoegberg LC, et al. Cărbune activat singur sau după lavaj gastric: o intoxicație simulată cu paracetamol de mari dimensiuni. Br J Clin Pharmacol. 2002;53;312-317.
28. Sato RL, Wong JJ, Sumida SM, et al. Eficacitatea administrării de cărbune super-activat târziu (3 ore) după supradozajul de paracetamol. Am J Emerg Med. 2003;21:189-191.
29. Spiller HA, Winter ML, Klein-Schwartz W, et al. Eficacitatea cărbunelui activat administrat la mai mult de patru ore după supradozajul de paracetamol. J Emerg Med. 2006;30:1-5.
30. Chyka PA, Seger D, Krenzelok EP, et al. Document de poziție: cărbune activat în doză unică. Clin Toxicol. 2005;43:61-87.
31. Kozer E, Koren G. Managementul supradozajului de paracetamol: controverse actuale. Siguranța medicamentelor. 2001;24:503-512.
32. Sandilands EA, Bateman DN. Reacții adverse asociate cu acetilcisteina. Clin Toxicol. 2009;47:81-88.
33. Hayes BD, Klein-Schwartz W, Doyon S. Frecvența erorilor de medicație cu acetilcisteină intravenoasă pentru supradozajul de paracetamol. Ann Pharmacother. 2008;42:766-770.
34. 29-30 iunie 2009: Reuniunea comună a Comitetului consultativ pentru siguranța medicamentelor și gestionarea riscurilor cu Comitetul consultativ pentru medicamente anestezice și de susținere a vieții și Comitetul consultativ pentru medicamente eliberate fără prescripție medicală: Material de informare al FDA. Actualizat la 30 iulie 2013. www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/DrugSafetyandRiskManagementAdvisoryCommittee/UCM164897.pdf. Accesat la 15 decembrie 2013.
35. Comunicarea FDA privind siguranța medicamentelor: FDA avertizează asupra unor reacții cutanate rare, dar grave, cu paracetamolul, analgezic/reducător de febră. 1 august 2013. www.fda.gov/Drugs/DrugSafety/ucm363041.htm. Accesat la 16 decembrie 2013.
36. Comunicarea FDA privind siguranța medicamentelor: Prescription acetaminophen products to be limited to 325 mg per dosage unit; boxed warning will highlight potential for severe liver failure. 13 ianuarie 2011. www.fda.gov/Drugs/DrugSafety/ucm239821.htm. Accesat la 16 decembrie 2013.
37. Krenzelok EP. Comentariu: Reuniunea Comitetului consultativ al FDA pentru paracetamol. Care este viitorul paracetamolului în Statele Unite? Perspectiva unui membru al comitetului. Clin Toxicol. 2009;47:784-789.
38. Pappas M, Bryan K. Bryan K. Industria OTC anunță tranziția voluntară la o singură concentrație de medicamente pediatrice lichide cu paracetamol cu un singur ingredient. Consumer Health Care Products. 11 mai 2011. www.chpa.org/05_04_11_PedAcet.aspx. Accesat la 15 decembrie 2013.
39. Hornsby LB, Whitley HP, Hester EK, et al. Survey of patient knowledge related to acetaminophen recognition, dosing, and toxicity. J Am Pharm Assoc. 2010;50:485-489.
40. Asociația americană a centrelor de control al otrăvurilor. www.aapcc.org. Accesat la 25 februarie 2014.
.