US Pharm. 2014;39(3):HS2-HS8.
ABSTRACT: アセトアミノフェン毒性は、米国における意図的および非意図的な中毒の最も多い原因の1つである。 急性肝不全の最も一般的な原因であり,移植を必要とする肝不全の2番目に多い原因となっている。 アセトアミノフェンは、様々な症状に対して処方薬と一般用医薬品の両方で、医師からしばしば推奨され、患者から非常に利用されています。 FDAは、患者の安全性を向上させるために、アセトアミノフェンの使用に関する推奨事項を長年にわたり更新してきました。 本稿では、アセトアミノフェン中毒の病因、兆候、症状、およびアセトアミノフェンの誤用防止における薬剤師の役割について概説します。
アセトアミノフェンは、医師から勧められることも多く、さまざまな症状のために処方薬と一般用医薬品の両方で患者が多く利用しており、薬剤師にとって最もよく出会う薬物の1つとなっています。 米国では、成人人口の40%がOTCのアセトアミノフェンを毎月使用し、成人人口の23%がOTCまたは処方薬のアセトアミノフェンを毎週使用していると報告されています1、2
アセトアミノフェン(パラセタモールまたはAPAP)は、アスピリンと同様の鎮痛・解熱作用があり、抗炎症作用はほとんどありません4 軽量・中程度の痛みや発熱に適応し、推奨量では胃の不快感や出血は伴わないとのことです。 しかし、過剰摂取により、肝機能の異常、急性肝不全、さらには死亡に至るまで、さまざまな問題を引き起こす可能性のある肝障害がよく知られています6。
薬物動態
摂取されると、アセトアミノフェンは消化管から速やかに吸収され、速やかに全身に分布します。 血漿濃度のピークは30分から60分以内に達成される4。食事によりピーク濃度までの時間が遅れることがあるが、吸収の程度には影響しない。12 過量投与の場合、血漿濃度のピークは通常4時間以内に達成される13。 アセトアミノフェンの半減期は、治療量投与後約2~3時間であるが、肝障害を有する患者では4時間以上に増加する可能性がある4,12,14
アセトアミノフェンは肝臓で、グルクロン酸化、硫酸化、CYP450 2E1 酸化の3つの主要経路で広範に代謝される12。 アセトアミノフェンの約90%は、硫酸化およびグルクロン酸化の代謝物に抱合され、腎臓から排出される14。 残りのアセトアミノフェンのうち、約2%は尿中に未変化で排泄され、残りはCYP450による酸化を受けて反応性代謝物であるN-アセチル-p-ベンゾキノンイミン(NAPQI)を形成する15-18。通常、この毒性のある代謝物はグルタチオン中のスルフヒドリル基と反応して、尿中に排泄される前に無害な代謝物へと変換される4。
毒性
薬物はさまざまな原因で毒性を発揮することがあります。 ある種の薬物の毒性は望ましくない代謝物の生成に関連しており、その結果、アセトアミノフェンの毒性はNAPQIの生成に関連している。 大量の急性投与や慢性的な使用により、主要な代謝経路であるグルクロン酸抱合系および硫酸抱合系が飽和し、CYP450系で代謝されるアセトアミノフェンが多くなる。 その結果、NAPQIの産生が増加する。 したがって、N-アセチルシステインのようなグルタチオン類似化合物でグルタチオンを補充することは、アセトアミノフェン毒性に対する有用な解毒剤として機能することになる。 急性過剰摂取は、8時間以内に毒性のある量の薬物を摂取した場合と定義され、慢性過剰摂取は、推奨限度量以上の量を繰り返し摂取した結果として起こります12。 成人におけるアセトアミノフェンの推奨用量は、4~6時間ごとに650~1,000 mg、24時間では4,000 mgを超えないこと、小児の推奨用量は、4~6時間ごとに10~15 mg/kg、24時間では50~70 mg/kgを超えてはならない。成人における150 mg/kg または 7.5 g以上の単回投与は潜在的毒性があると考えられてきたが、肝臓障害につながる最小量の範囲は4~10 gと考えられる6,12,14,19。 小児では、120mg/kgから150mg/kgの単回投与が肝毒性と関連していますが、<200mg/kgの投与では毒性は起こりにくいでしょう。14,20
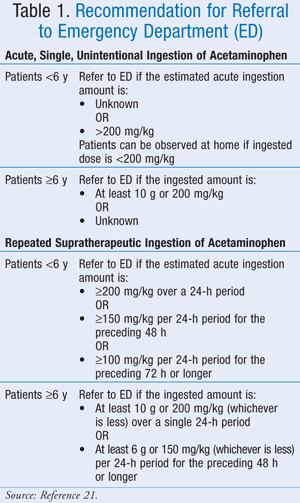
正確な最大投与量は十分に定義されていませんが、米国中毒予防センター協会(AAPCC)は、摂取した薬の量にかかわらず、患者が毒性と一致する兆候や症状を示していれば医師の診断を受けるよう勧告しました(21)。 AAPCCは、アセトアミノフェンの急性、単発、意図的でない摂取と、アセトアミノフェンの治療法を超えた反復摂取の両方について、病院紹介のガイドラインを示しています(表1)。21
臨床症状
アセトアミノフェン中毒の進行は、単回過剰摂取によるものか治療法を超えた反復摂取によるものかにかかわらず、前臨床毒性作用(第1段階)、肝障害(第2段階)、肝障害(第3段階)、回復(第4段階)という連続した4段階で記述することが可能である。6,22 前臨床段階で治療を受けた患者は、一過性の肝障害を起こすことがあるが、完全に回復する22。 22
第1期は、毒物を摂取してから数時間後に発症し、12時間から24時間続く。 医療従事者は、この静止期に続く毒性の意味を理解する必要があるため、症状の出現の遅れに注意することが重要である。 最初の24時間の症状は診断的あるいは特異的なものではなく、吐き気、嘔吐、発汗、食欲不振、嗜眠などがあり、その重症度は摂取した量の大きさに直接相関している8。
摂取後24~48時間までの第2段階では、消化器症状が改善または消失するため、回復したという誤った感覚を持つかもしれません。 さらに、検査値は肝毒性の証拠を示し始め、肝酵素、乳酸、リン酸、プロトロンビン時間、国際標準化比率(INR)が劇的に上昇します。8,12
ほとんどの患者は、特に解毒剤のアセチルシステインが投与されている場合は、この段階を超えて進行することはありません。 この段階は、倦怠感、黄疸、および錯乱、傾眠、および昏睡を含む中枢神経症状を伴う吐き気と嘔吐の再発または悪化によって特徴づけられる6。 頻度は低いものの、アセトアミノフェンによる尿細管壊死の結果として、乏尿に代表される腎機能不全が現れることがあります6、8、12 肝酵素値はピークに達し、10,000 IU/Lにも達します。 黄疸、低血糖、出血および凝固異常、肝性脳症も明らかになります。15
最後に、第4相は生存と回復を伴い、一般的に肝機能が完全に戻り、長期的な影響はありません6。 6
リスクの高い患者
アセトアミノフェン毒性のメカニズムは、NAPQIの形成を介して起こるため、代謝酵素の利用可能性に影響を与える要因はすべて、毒性に影響を与えることになる。 アルコールの使用、栄養失調、およびカルバマゼピン、プリミドン、リファンピン、エファビレンツ、セント・ジョーンズ・ワートによる長期治療などの薬剤によるCYP450酵素の誘導は、アセトアミノフェンに対する個人の反応に影響を与える場合がある23。 上記のいずれかの要因の影響を受ける患者を特定し、薬剤師がアセトアミノフェンを安全に使用する方法について緊密に相談できるようにする必要がある
急性期のエタノールはCYP2E1の基質および阻害剤の両方の役割を果たし、NAPQIの形成量を抑制する。 逆に、慢性的なアルコール使用では、エタノールはCYP2E1の誘導剤であり、アセトアミノフェンの過量投与が起こった場合、NAPQIの形成が増加する可能性があります。 慢性的なアルコール使用のもう一つの結果は、グルタチオンの貯蔵量の枯渇であり、NAPQIの形成に対する最後の防御を低下させる。17 治療量のアセトアミノフェンの使用がアルコール依存症患者において毒性を示すことを示す証拠はないため、治療量のアセトアミノフェンは急性的にも慢性的にも安全に使用できる23-25。
患者が摂取後1時間以内に来院した場合、胃の除染を検討することができる。活性炭は推奨される唯一の消化管除染方法である。 活性炭の投与は、特にアセトアミノフェンの遅延放出製剤を摂取した患者、またはアセトアミノフェンの吸収を遅らせる他の薬剤を摂取した患者において検討される場合がある12。 また、誤嚥のリスクが高い患者、制御できない嘔吐、または腐食剤やプロコンパルサントの同伴は避けるべきである。 アセトアミノフェン毒性に対する治療の主役は、アセチルシステインである。 アセチルシステインは、血行動態と酸素利用を改善し、脳浮腫を減少させ、ミトコンドリアのエネルギー生産を改善するため、アセトアミノフェンによる肝不全を呈する患者にとって有益であろう14,22。
FDA Labeling
安全性の向上と毒性の低減を期待して、FDAは長い間、アセトアミノフェンの使用に関する推奨事項を更新してきました。 1998年、FDAはアセトアミノフェン製品に警告ラベルを貼り、1日に3杯以上のアルコール飲料を摂取する患者には、この薬を使用する前に医師に相談するように促しました。 年月が経ち、アセトアミノフェンと肝毒性との相関関係がさらに明らかになると、FDAはこれらの知見に基づいて行動するための会議を招集した。 2002年、FDA諮問委員会は、すべてのアセトアミノフェン含有製品に肝毒性に関する警告を表示するよう勧告しました。 2009年には、どの製品にアセトアミノフェンが含まれているかを患者さんが簡単に識別できるような新しいラベルが開発され、誤って過剰摂取してしまう可能性を減らすことができました。 その後、重篤な肝障害の潜在的リスクを強調する黒枠警告がすべての処方用アセトアミノフェン製品に表示され、稀ではあるが重篤なアナフィラキシーおよびその他の過敏性反応に対する警告も実施されました34。
2013年8月、FDAは、アセトアミノフェンの使用に関連して、スティーブンス・ジョンソン症候群(SJS)、中毒性表皮壊死症(TEN)、急性全身性発疹性膿疱症(AGEP)などの、まれだが重篤で致命的な皮膚反応について消費者に注意を促しました35。 また、2014年1月より、処方箋配合剤に含まれるアセトアミノフェンの量を、1錠または1カプセルあたり325mgに制限しなければならないと発表しています36,37。 2011年5月、処方箋なしのアセトアミノフェン製品のメーカーは、液体アセトアミノフェンの小児用強度(160 mg/5 mL)1種類を唯一の濃度とし、濃縮乳児用ドロップは今後製造しないことを自主的に発表しました38
進展はありましたが、まだ決定していないこともあります。 FDAの諮問委員会は、安全性の向上と毒性の減少をもたらすと考えられる多くの変更に賛成票を投じたが、FDAはまだ行動を起こしていない。 例えば、アセトアミノフェンの1日の最大投与量はこれまで4g/日とされていましたが、FDA諮問委員会は過剰摂取を減らすためにこれを減らすことを提案しています37。まだ強制ではありませんが、一部のメーカーはすでにこれらの勧告を反映して表示を更新していることは重要な点です。 また、製品表示の改善、患者教育の強化、小児用ユニバーサル製剤の作成、アセトアミノフェン配合剤の廃止、OTCアセトアミノフェン製品の強度を1錠325mg、1回の最大投与量を650mgに引き下げる取り組みも行われている37。 これらの問題のいずれについても最終的なコンセンサスは得られていませんが、医療従事者は、ラベルの指示に従うことの重要性について患者を教育すべきです。
薬剤師の役割
薬剤師は、アセトアミノフェンの安全使用を効果的に促進できる立場にあります。 さらに、患者はアセトアミノフェンが600以上の異なる製品に含まれていることを理解していないかもしれません。39 アセトアミノフェン含有製品の処方を受けるすべての患者に対して、有効成分について確実に認識するようカウンセリングを行う必要があります。 薬剤師は、OTCアセトアミノフェン製品を購入する患者を教育するために積極的な役割を果たす必要があります。 薬剤師は、患者教育や患者の薬歴の確認を通じて薬の安全な使用を保証し、アセトアミノフェンの誤用を防ぐのに不可欠である
さらに、薬剤師は、患者がアセトアミノフェンの過剰摂取を疑ったら全国毒物ヘルプラインに連絡するよう勧めなければならない。 この番号に電話すると、患者は、専門家が1日24時間、週7日利用できる最寄りの地域毒物管理センターに接続されます。 この番号に電話すると、患者は、24時間365日体制で専門家が待機している最寄りの地域毒物管理センターにつながる。この専門家は、アセトアミノフェンの過剰摂取の可能性の評価と管理を支援することができる。 このような活動により、不適切な投与、治療の重複、不適切な薬剤使用のリスクを最小限に抑えることができます
1. Kaufman DW, Kelly JP, Rosenberg L, et al. 米国の外来成人集団における最近の薬物使用パターン:Slone調査。 JAMA。 2002;287:337-344.
2. Paulose-Ram R, Hirsch R, Dillon C, et al. 米国成人人口における処方および非処方の鎮痛剤使用:第3回国民健康・栄養調査(NHANES III)の結果。 Pharmacoepidemiol薬物安全。 2003;12:315-326.
3. Paulose-Ram R, Hirsch R, Dillon C, et al. Frequent monthly use of selected nonprescription and prescription non-narcotic analgesics among U.S. adults.(米国成人の非処方薬と処方薬の鎮痛剤の頻繁な月間使用)。 薬物安全性。 2005;14:257-266.
4. バーク、スマイスEM、フィッツジェラルドGA. 痛風の薬物療法。 で。 また、”痒み “や “痰 “のような症状にも対応する。 において、Goodman and Gilman’s the Pharmacological Basis of Therapeutics. 第11版。 New York, NY: McGraw-Hill; 2006:671-716.
5. ワトキンスPB、カプローウィッツN、スラッタリーJT、他。 毎日4グラムのアセトアミノフェンを投与された健康な成人におけるアミノトランスフェラーゼの上昇:無作為化比較対照試験。 JAMA. Chun LJ, Tong MJ, Busuttil RW, et al. Acetaminophen hepatotoxicity and acute liver failure(アセトアミノフェンの肝毒性と急性肝不全)。 J Clin Gastroenterol. 2009;43:342-349.
7. Bronstein AC, Spyker DA, Cantilena LR, et al. 2011 annual report of the American Association of Poison Control Centers’ National Poison Data System (NPDS): 29th annual report.The American Association of Poison Control Centers’ National Poison Data System (NPDS). Clin Toxicol。 2012;50:911-1164.
8. シリング A、コリー R、レナード M、その他. アセトアミノフェン: 古い薬、新しい警告. クリーブクリン J メッド。 2010;77:19-27.
9. Nourjah P, Ahmad SR, Karwoski C, et al. 米国におけるアセトアミノフェン(パラセタモール)に関連する過剰摂取の推定値。 Pharmacoepidemiol Drug Saf. 2006;15:398-405.
10. Larson AM, Polson J, Fontana RJ, et al. Acetaminophen-induced acute liver failure: Results of a United States multicenter, prospective study(アセトアミノフェンによる急性肝不全:米国の多施設共同前向き研究の結果). Hepatology. 2005;42:1364-1372.
11. リーWM、ラーソンAM、ストラビッツT.AASLDポジションペーパー:急性肝不全の管理:アップデート2011. Baltimore, MD: American Association for the Study of Liver Diseases; September 2011. www.aasld.org/practiceguidelines/Documents/AcuteLiverFailureUpdate2011.pdf. 2013年12月15日アクセス
12. Tylenol (acetaminophen) professional product information. Fort Washington, PA: このような場合、「痒いところに手が届く」という言葉があります。 ヘンドリクソン RG。 アセトアミノフェン。 In: ネルソン LS、ルーイン NA、ハウランド M、eds.Nelson LS、Lewin NA、Howland M。 ゴールドフランクの毒性学的エマージェンシー。 第9版。 New York, NY: McGraw-Hill; 2011:483-99.
14. Hodgman MJ, Garrard AR. アセトアミノフェン中毒のレビュー。 Crit Care Clin. 2012;499-516.
15. ラーソンAM. アセトアミノフェン肝毒性。 Clin Liver Dis. 2007;11:525-548.
16. Rumack BH. アセトアミノフェン肝毒性:最初の35年。 J Toxicol Clin Toxicol。 2002;40:3-20.
17. ネルソンSD. アセトアミノフェンによる肝毒性の分子機構. Semin Liver Dis. 1990;10:267-278.
18. リーWH. 薬物による肝毒性. N Engl J Med. 1995;333:1118-1127.
19. Fontana RJ. アセトアミノフェン過量摂取を含む急性肝不全。 Med Clin North Am. 2008;92:761-794.
20. アメリカ小児科学会薬物委員会。 小児におけるアセトアミノフェン毒性。 小児科医。 2001;108:1020-1024.
21. Dart RC, Erdman AR, Olson KR, et al. Acetaminophen poisoning: an evidence-based consensus guideline for out-of-hospital management(アセトアミノフェン中毒:院外管理のためのエビデンスに基づくコンセンサス・ガイドライン). Clin Toxicol. 2006;44:1-18.
22. Heard KJ. アセトアミノフェン中毒のためのアセチルシステイン。 N Engl J Med. 2008;359:285-292.
23. ファーナーRE、ディアJW、ベイトマンDN. パラセタモール中毒の管理。 BMJ。 2011;342:d2218.
24. Kuffner EK, Dart RC, Bogdan GM, et al. アルコール患者の肝臓に対する1日最大量のアセトアミノフェンの効果:無作為化二重盲検プラセボ対照試験. Arch Intern Med. 2001;161:2247-2252.
25. Kuffner EK, Green JL, Bogdan GM, et al. アルコール患者の肝機能検査に対するアセトアミノフェン(1日4グラム、3日間連続)の効果-多施設共同無作為化試験-. BMC Med. 2007;5:13.
26. Rumack BH. アセトアミノフェンの誤解。 Hepatology. 2004;40:10-15.
27. Christophersen AB, Levin D, Hoegberg LC, et al. 活性炭単独または胃洗浄後:大規模なパラセタモール中毒のシミュレーション. Br J Clin Pharmacol. 2002;53;312-317.
28. を用いた、アセトアミノフェン過剰摂取後3時間経過後の超活性炭投与の有効性. Am J Emerg Med. 2003;21:189-191.
29. Spiller HA, Winter ML, Klein-Schwartz W, et al.アセトアミノフェン過剰摂取後4時間以上経過してからの活性炭投与の有効性. J Emerg Med. 2006;30:1-5.
30. Chyka PA, Seger D, Krenzelok EP, et al. Position paper: Single-dose activated charcoal. Clin Toxicol. 2005;43:61-87.
31. Kozer E, Koren G. Paracetamol overdoseの管理:現在の論争。 薬物安全性。 2001;24:503-512.
32. Sandilands EA, Bateman DN. アセチルシステインに関連する有害反応。 Clin Toxicol. 2009;47:81-88.
33. を参考に、アセトアミノフェン過量投与時のアセチルシステイン静脈内投与による投薬過誤の頻度について検討した。 Ann Pharmacother. 2008;42:766-770.
34. 2009年6月29日~30日 医薬品安全性・リスク管理諮問委員会、麻酔・生命維持薬諮問委員会、非処方薬諮問委員会の合同会議。 FDAの説明資料。 2013 年 7 月 30 日更新。www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/DrugSafetyandRiskManagementAdvisoryCommittee/UCM164897.pdf。 2013年12月15日アクセス
35. FDAの医薬品安全性情報。 FDAは、鎮痛剤/解熱剤のアセトアミノフェンによる稀だが重篤な皮膚反応について警告している。 2013年8月1日。www.fda.gov/Drugs/DrugSafety/ucm363041.htm。 2013年12月16日アクセス
36. FDAの医薬品安全性コミュニケーション。 処方されたアセトアミノフェン製品は、1用量あたり325mgに制限されます。箱書き警告は、重篤な肝不全の可能性を強調するものです。 2011年1月13日。www.fda.gov/Drugs/DrugSafety/ucm239821.htm。 2013年12月16日アクセス
37。 Krenzelok EP. 解説:FDAアセトアミノフェン諮問委員会の会議。 米国におけるアセトアミノフェンの将来はどうなるのか? 委員会メンバーの視点。 Clin Toxicol. 2009;47:784-789.
38. Pappas M, Bryan K. OTC industry announces voluntary transition to one concentration of single-ingredient pediatric liquid acetaminophen medicines(OTC業界、小児用アセトアミノフェン単一成分液剤への自主的移行を発表)。 コンシューマー・ヘルスケア・プロダクツ。 2011年5月11日。www.chpa.org/05_04_11_PedAcet.aspx。 2013年12月15日アクセス
39。 Hornsby LB, Whitley HP, Hester EK, et al. アセトアミノフェンの認識、服用、毒性に関する患者の知識に関する調査。 J Am Pharm Assoc. 2010;50:485-489.
40. American Association of Poison Control Centers(米国毒物管理センター協会)www.aapcc.org. 2014年2月25日アクセス.
.