US Pharm. 2014;39(3):HS2-HS8.
ABSTRACT: La toxicidad por paracetamol es una de las causas más comunes de intoxicación tanto intencional como no intencional en los Estados Unidos. Se ha convertido en la causa más común de insuficiencia hepática aguda y la segunda causa más prevalente de insuficiencia hepática que requiere trasplante. El paracetamol suele ser recomendado por los médicos y muy utilizado por los pacientes, tanto en los productos de prescripción como en los de venta libre, para diversas afecciones. La FDA lleva tiempo actualizando sus recomendaciones sobre el uso del paracetamol para ayudar a mejorar la seguridad de los pacientes. Este artículo revisa la etiología, los signos y los síntomas de la toxicidad del paracetamol y el papel del farmacéutico en la prevención del mal uso del paracetamol.
El paracetamol es a menudo recomendado por los médicos y muy utilizado por los pacientes tanto en productos de prescripción como de venta libre para una variedad de afecciones, lo que lo convierte sin duda en uno de los fármacos más comunes que encuentran los farmacéuticos.1-3 En los Estados Unidos, el 40% de la población adulta declaró utilizar acetaminofén de venta libre mensualmente, y el 23% de la población adulta declaró utilizar acetaminofén de venta libre o de prescripción semanalmente.1,2
El acetaminofén (paracetamol o APAP) tiene propiedades analgésicas y antipiréticas similares a las de la aspirina, pero mínimas propiedades antiinflamatorias.4 Está indicado para el dolor o la fiebre de leve a moderada, y no se asocia con molestias estomacales o hemorragias a las dosis recomendadas. Cuando se utiliza adecuadamente, tiene un perfil de seguridad y eficacia muy bien establecido.5 Sin embargo, la hepatotoxicidad es una consecuencia común del consumo excesivo, que puede dar lugar a una serie de problemas, incluyendo anormalidades en la función hepática, insuficiencia hepática aguda e incluso la muerte.6
La toxicidad del acetaminofeno es una de las causas más comunes de envenenamiento tanto intencional como no intencional en los EE.UU. De hecho, ha habido un aumento constante en la incidencia de la toxicidad relacionada con el acetaminofeno durante la última década.7,8 Esto se atribuye probablemente a la amplia disponibilidad del acetaminofeno como ingrediente único y en combinación con otros medicamentos de venta libre y de prescripción en varias concentraciones y formulaciones. Las sobredosis asociadas al paracetamol suponen aproximadamente 56.000 visitas a urgencias, 26.000 hospitalizaciones y más de 450 muertes al año.9 La toxicidad hepática inducida por el paracetamol se ha convertido en la causa más común de insuficiencia hepática aguda y la segunda causa más común de insuficiencia hepática que requiere trasplante.10,11 Por lo tanto, es imperativo que los farmacéuticos reconozcan los signos y síntomas de sobredosis y toxicidad, y aconsejen a sus pacientes sobre la dosis y el uso adecuados.
Farmacocinética
Al ingerirlo, el paracetamol se absorbe rápidamente en el tracto gastrointestinal (GI) y se distribuye rápidamente por todo el cuerpo. Las concentraciones plasmáticas máximas se alcanzan en un plazo de 30 a 60 minutos4; los alimentos pueden retrasar el tiempo hasta la concentración máxima, pero el grado de absorción no se ve afectado.12 En caso de sobredosis, las concentraciones plasmáticas máximas suelen alcanzarse en 4 horas.13 La vida media del paracetamol es de aproximadamente 2 a 3 horas después de las dosis terapéuticas, aunque puede aumentar a más de 4 horas en pacientes con lesiones hepáticas.4,12,14
El paracetamol se metaboliza ampliamente en el hígado a través de tres vías hepáticas principales: glucuronidación, sulfatación y oxidación del CYP450 2E1.12 Aproximadamente el 90% del paracetamol se conjuga en metabolitos sulfatados y glucuronidados que se eliminan por vía renal.14 Del paracetamol restante, aproximadamente el 2% se excreta sin cambios en la orina y el resto sufre una oxidación mediada por el CYP450 para formar un metabolito reactivo, la N-acetil-p-benzoquinona imina (NAPQI).15-18 En circunstancias normales, este metabolito tóxico reacciona con los grupos sulfhidrilos del glutatión, convirtiéndolo en metabolitos inocuos antes de ser excretado en la orina.4
Toxicidad
Los fármacos pueden tener efectos tóxicos debido a varias razones. La toxicidad de algunos fármacos está relacionada con la formación de un metabolito indeseable; en consecuencia, la toxicidad del paracetamol está relacionada con la producción de NAPQI. Con grandes dosis agudas o con el uso crónico, las principales vías metabólicas -los sistemas de conjugación de glucurónidos y sulfatos- se saturan, y el sistema CYP450 metaboliza más paracetamol. Esto da lugar a una mayor producción de NAPQI. Cuando el glutatión se agota aproximadamente en un 70%, el NAPQI comienza a acumularse en los hepatocitos, lo que provoca daño hepático.15,16,18 Por lo tanto, la sustitución del glutatión por compuestos que imitan al glutatión, como la N-acetilcisteína, es un antídoto útil contra la toxicidad del paracetamol.
La toxicidad del paracetamol puede ser el resultado de una sobredosis aguda o del uso excesivo crónico. La sobredosis aguda se define como el consumo de una cantidad tóxica de un fármaco en un periodo de 8 horas, mientras que la sobredosis crónica se produce como resultado de dosis repetidas iguales o superiores al límite recomendado.12 También pueden producirse sobredosis no intencionadas como resultado de la ingestión de múltiples productos que contienen paracetamol. La dosis recomendada de paracetamol en adultos es de 650 a 1.000 mg cada 4 a 6 horas, sin superar los 4.000 mg en un periodo de 24 horas; en niños, la dosis recomendada es de 10 a 15 mg/kg cada 4 a 6 horas, sin superar los 50 a 70 mg/kg en 24 horas.12 Las dosis únicas de más de 150 mg/kg o 7,5 g en adultos se han considerado potencialmente tóxicas, aunque la dosis mínima asociada a lesiones hepáticas puede oscilar entre 4 y 10 g.6,12,14,19 En los niños, las dosis únicas de 120 mg/kg a 150 mg/kg se han asociado a la hepatotoxicidad; sin embargo, es poco probable que las dosis <200 mg/kg produzcan toxicidad.14,20
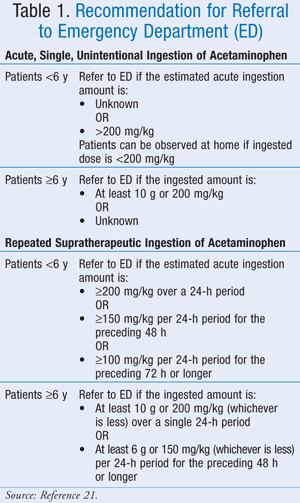
Aunque la dosis máxima exacta no ha sido bien definida, la Asociación Americana de Centros de Control de Intoxicaciones (AAPCC) ha recomendado que, independientemente de la cantidad de fármaco ingerida, un paciente debe ser llevado para su evaluación médica si muestra signos o síntomas consistentes con toxicidad.21 La AAPCC ha proporcionado directrices para la derivación al hospital tanto para la ingestión aguda, única y no intencionada de paracetamol como para la ingestión supraterapéutica repetida de paracetamol (TABLA 1).21
Presentación clínica
Independientemente de que la toxicidad del paracetamol se produzca por una sobredosis única o tras una ingestión supraterapéutica repetida, la progresión de la intoxicación por paracetamol puede describirse en cuatro fases secuenciales: efectos tóxicos preclínicos (fase uno), lesión hepática (fase dos), insuficiencia hepática (fase tres) y recuperación (fase cuatro).6,22 Los pacientes tratados durante la fase preclínica pueden desarrollar un daño hepático transitorio pero se recuperan completamente.22 Los pacientes que no son tratados hasta que la lesión hepática ya es evidente tienen un pronóstico variable; sin embargo, los que se presentan con insuficiencia hepática tienen una tasa de mortalidad del 20% al 40%.22
La primera fase se produce unas horas después de la ingestión de una dosis tóxica, y dura de 12 a 24 horas. Es importante tener en cuenta el retraso en la aparición de los síntomas, ya que los profesionales sanitarios deben comprender las implicaciones de la toxicidad que seguirán a este periodo de reposo. Los síntomas durante las primeras 24 horas no son diagnósticos ni específicos e incluyen náuseas, vómitos, diaforesis, anorexia y letargo, cuya gravedad estará en correlación directa con el tamaño de la dosis ingerida.8
En la segunda fase, que se produce entre 24 y 48 horas después de la ingestión, puede haber una falsa sensación de recuperación, ya que los síntomas gastrointestinales mejoran o desaparecen.6,8 Sin embargo, a medida que la hepatotoxicidad sigue apareciendo, puede aparecer dolor abdominal o sensibilidad en el cuadrante superior derecho. Además, los valores de laboratorio comenzarán a mostrar evidencias de hepatotoxicidad; las enzimas hepáticas, el lactato, el fosfato, el tiempo de protrombina y el cociente internacional normalizado (INR) aumentarán drásticamente.6,8,12 La mayoría de los pacientes no progresan más allá de esta fase, especialmente si se administra el antídoto acetilcisteína.8,12
Unos pocos pacientes progresarán a la fase tres, que suele ocurrir entre 3 y 5 días después de la administración. Esta fase se caracteriza por la reaparición o el empeoramiento de las náuseas y los vómitos, acompañados de malestar general, ictericia y síntomas nerviosos centrales que incluyen confusión, somnolencia y coma.6 Puede producirse una necrosis hepática grave y posiblemente mortal. Aunque es menos común, la insuficiencia renal, demostrada por la oliguria, puede manifestarse como resultado de la necrosis tubular inducida por el acetaminofén.6,8,12 Los niveles de enzimas hepáticas alcanzarán su máximo, llegando a medir hasta 10.000 UI/L. También serán evidentes la ictericia, la hipoglucemia, las anomalías hemorrágicas y de coagulación, y la encefalopatía hepática.8,12 Puede producirse la muerte como consecuencia de las complicaciones asociadas al fallo hepático, incluido el fallo del sistema multiorgánico, el edema cerebral y la sepsis.15
Por último, la fase cuatro implica la supervivencia y la recuperación, generalmente con el retorno de la función hepática completa y sin efectos a largo plazo.6 Aproximadamente el 70% de los pacientes que entran en la fase cuatro se recuperan por completo, mientras que entre el 1% y el 2% de los pacientes desarrollan una insuficiencia hepática mortal.6 La toxicidad grave por paracetamol no tratada provocará la muerte entre 4 y 18 días después de la ingestión.6
Pacientes con mayor riesgo
Debido a que el mecanismo de la toxicidad por paracetamol se produce a través de la formación de NAPQI, cualquier factor que influya en la disponibilidad de enzimas metabólicas afectará por tanto a la toxicidad. El consumo de alcohol, la desnutrición y la inducción de las enzimas CYP450 por fármacos, incluido el tratamiento a largo plazo con carbamazepina, primidona, rifampicina, efavirenz y hierba de San Juan, pueden influir en la respuesta de un individuo al paracetamol.23 Los pacientes afectados por cualquiera de los factores anteriores deben ser identificados para que los farmacéuticos puedan aconsejarles estrechamente sobre cómo utilizar el paracetamol de forma segura.
De forma aguda, el etanol sirve tanto de sustrato como de inhibidor del CYP2E1, limitando la cantidad de NAPQI formada. Por el contrario, en el consumo crónico de alcohol, el etanol es un inductor del CYP2E1, lo que conduce a un aumento potencial de la formación de NAPQI si se produce una sobredosis de paracetamol. Otra consecuencia del consumo crónico de alcohol es el agotamiento de las reservas de glutatión, lo que reduce la última defensa contra la formación de NAPQI.17 No hay pruebas que sugieran que el uso del paracetamol en dosis terapéuticas sea tóxico en una persona alcohólica; por lo tanto, en cantidades terapéuticas el paracetamol puede utilizarse con seguridad tanto de forma aguda como crónica.23-25
Aunque es controvertido, la inanición (ayuno prolongado) y la malnutrición son factores de riesgo adicionales para la toxicidad del paracetamol.16,18,23 Al igual que el consumo crónico de alcohol, la malnutrición provoca el agotamiento de las reservas de glutatión. Sin embargo, también hay pruebas de que la función del CYP2E1 está notablemente reducida en esta población de pacientes. Estos efectos se contrarrestarían mutuamente, por lo que potencialmente no se produciría ningún cambio en la toxicidad.26 No obstante, sigue siendo prudente identificar a estos pacientes y advertirles de su mayor potencial de riesgo.
Manejo
Al presentarse, el paciente debe ser evaluado exhaustivamente. Debe obtenerse un historial detallado de medicamentos recientes. Los niveles de acetaminofeno en suero deben extraerse idealmente al menos 4 horas después de la ingestión. Los farmacéuticos pueden desempeñar un papel importante recopilando información pertinente, como la cantidad de fármaco ingerido, la forma farmacéutica ingerida, el tiempo transcurrido desde la última dosis ingerida y si se han consumido otros fármacos. Todos estos factores son importantes a la hora de analizar las concentraciones séricas de paracetamol.
Si el paciente se presenta en la hora siguiente a la ingesta, puede considerarse la descontaminación gástrica; el carbón activado es el único método de descontaminación GI recomendado. Puede considerarse la administración de carbón activado, especialmente en pacientes que hayan ingerido fórmulas de liberación retardada de paracetamol o que hayan consumido otros medicamentos que ralenticen la absorción del paracetamol.12 Sin embargo, debido a las rápidas fases de absorción y distribución del paracetamol, por lo demás, este método tiene poca utilidad a medida que pasa el tiempo.27-29 El carbón activado sólo debe administrarse si el paciente está mentalmente alerta y con las vías respiratorias intactas. También debe evitarse en aquellos con un mayor riesgo de aspiración, vómitos incontrolados o coingestión de un corrosivo o proconvulsivo.30
Acetilcisteína: El pilar del tratamiento de la toxicidad del paracetamol es la acetilcisteína. Este agente repone las reservas hepáticas de glutatión y aumenta la conjugación del sulfato, impidiendo la acumulación de NAPQI.31 La acetilcisteína puede ser beneficiosa en los pacientes que presentan insuficiencia hepática inducida por el paracetamol, ya que mejora la hemodinámica y el uso del oxígeno, disminuye el edema cerebral y mejora la producción de energía mitocondrial.14,22
La acetilcisteína puede prevenir la insuficiencia hepática de una sobredosis de paracetamol cuando se administra con suficiente antelación (en las 8-10 horas siguientes a una sobredosis aguda), pero puede seguir siendo útil hasta 48 horas después de la ingestión.6,11,14,31 El nomograma estándar de toxicidad del paracetamol, el nomograma de Rumack-Matthew, puede utilizarse para determinar la probabilidad de daño hepático grave. Sin embargo, resulta ineficaz cuando se evalúa la posible toxicidad debida a múltiples ingestas a lo largo del tiempo, cuando se desconoce el momento de la ingestión o cuando se produce una alteración del metabolismo.11 Teniendo esto en cuenta, debe administrarse acetilcisteína en cualquier caso de insuficiencia hepática aguda o cuando exista cualquier evidencia de toxicidad hepática en la que se sospeche una sobredosis de paracetamol.11
La acetilcisteína está disponible por vía oral e intravenosa; la elección depende del escenario clínico.21 La administración oral puede ser beneficiosa para los pacientes con efectos tóxicos preclínicos o lesión hepática, aunque la presencia de alteración del estado mental y vómitos puede limitar su uso.22 El régimen de dosificación para la acetilcisteína oral es una dosis de carga de 140 mg/kg, seguida de 17 dosis de 70 mg/kg cada 4 horas durante un total de 72 horas.11 Los pacientes con insuficiencia hepática deben recibir terapia IV.22 Se recomienda la infusión IV continua con una dosis de carga de 150 mg/kg IV en 200 mL de D5W infundida durante 60 minutos, seguida de una dosis de mantenimiento de 50 mg/kg durante 4 horas, seguida de una segunda dosis de mantenimiento de 100 mg/kg en 1.000 mL de D5W administrada durante 16 horas.11 Si el paciente pesa menos de 40 kg, los líquidos deben ajustarse según las directrices para evitar la sobrecarga de líquidos, la hiponatremia y las convulsiones. Si el paciente se encuentra bien pero no se ha recuperado del todo tras la dosis recomendada, el tratamiento con acetilcisteína puede continuarse utilizando la última dosis oral o la última tasa de infusión intravenosa. La acetilcisteína debe continuarse más allá de la duración del protocolo hasta que las concentraciones de paracetamol sean indetectables, la AST sérica se haya normalizado o haya mejorado significativamente y haya resolución de cualquier evidencia de insuficiencia hepática.13
Debido a su sabor y olor desagradables, con frecuencia se producen vómitos con la administración de acetilcisteína por vía oral.31,32 Los efectos adversos asociados a la acetilcisteína por vía intravenosa incluyen reacciones anafilactoides, como erupción cutánea, prurito, angioedema, broncoespasmo, taquicardia e hipotensión.31,32 Además, al utilizar acetilcisteína por vía intravenosa, los farmacéuticos deben ser conscientes del potencial de errores de medicación. El complicado régimen, la duración de la terapia y la necesidad de que varios profesionales de la salud administren las dosis en varios lugares de tratamiento aumentan en gran medida el riesgo de que se produzcan errores.33 Un estudio retrospectivo identificó una incidencia del 33% de errores de medicación con la acetilcisteína IV.33 El tipo de error más común encontrado en este estudio fue un retraso en la terapia, que puede reducir potencialmente la eficacia de la acetilcisteína. Otro error común identificado fue la administración innecesaria de acetilcisteína, lo que resulta en costes innecesarios. Es importante que los profesionales sanitarios consulten con los centros de intoxicación en caso de sobredosis de paracetamol. Ellos pueden proporcionar la información más actualizada sobre la dosificación y los protocolos para garantizar la administración adecuada de acetilcisteína.
Etiquetado de la FDA
Con la esperanza de aumentar la seguridad y reducir la toxicidad, la FDA lleva mucho tiempo actualizando sus recomendaciones sobre el uso del paracetamol. A finales de la década de 1990, las investigaciones demostraron que el paracetamol era una de las principales causas de insuficiencia hepática aguda en EE.UU., y que la mayoría de los casos se debían a sobredosis accidentales.34 En 1998, la FDA publicó una etiqueta de advertencia en los productos de paracetamol en la que se instaba a los pacientes que consumían más de tres bebidas alcohólicas al día a consultar a un médico antes de utilizar este medicamento. A medida que pasaban los años y la correlación entre el paracetamol y la toxicidad hepática se hacía aún más evidente, la FDA convocó una reunión para actuar sobre estos hallazgos. En 2002, el Comité Consultivo de la FDA recomendó que se incluyera una advertencia de toxicidad hepática en todos los productos que contuvieran paracetamol. En 2009, se desarrolló un nuevo etiquetado para ayudar a los pacientes a identificar fácilmente qué productos contenían paracetamol, reduciendo así la posibilidad de sobredosis accidentales. Posteriormente, se incluyó una advertencia en un recuadro negro en todos los productos con acetaminofén de venta con receta, en la que se hacía hincapié en el riesgo potencial de lesiones hepáticas graves, y se implementó una advertencia para la anafilaxia, poco frecuente pero grave, y otras reacciones de hipersensibilidad.34
En agosto de 2013, la FDA alertó a los consumidores de reacciones cutáneas raras pero graves y potencialmente mortales, como el síndrome de Stevens-Johnson (SJS), la necrólisis epidérmica tóxica (TEN) y la pustulosis exantemática aguda generalizada (AGEP), vinculadas al uso del paracetamol35. Se debe aconsejar a los pacientes sobre los signos y síntomas de las reacciones cutáneas, como la descamación, las ampollas, el enrojecimiento y el desprendimiento de la piel, por lo que deben interrumpir el uso del medicamento y buscar atención médica inmediatamente.
La FDA también ha anunciado que, a partir de enero de 2014, la cantidad de paracetamol que se encuentra en los productos combinados de venta con receta debe limitarse a 325 mg por comprimido o cápsula.36,37 En mayo de 2011, los fabricantes de productos de acetaminofén de venta sin receta anunciaron voluntariamente que una única concentración de acetaminofén líquido para niños (160 mg/5 mL) será la única disponible; las gotas concentradas para bebés dejarán de producirse.38
Aunque se han hecho progresos, aún quedan algunas cosas por determinar. El Comité Asesor de la FDA ha votado a favor de muchos cambios que se cree que mejoran la seguridad y disminuyen la toxicidad, pero la FDA aún no ha tomado medidas. Por ejemplo, mientras que la dosis máxima diaria de paracetamol se fijó anteriormente en 4 g/día, el Comité Asesor de la FDA sugiere disminuirla en un esfuerzo por reducir las sobredosis.37 Es importante señalar que algunos fabricantes ya han actualizado su etiquetado para reflejar estas recomendaciones, aunque todavía no es obligatorio hacerlo. También se están realizando esfuerzos para mejorar el etiquetado de los productos, mejorar la educación de los pacientes, crear una formulación pediátrica universal, eliminar los productos combinados de paracetamol y reducir la potencia de los productos de paracetamol de venta libre a 325 mg por comprimido con una dosis única máxima de 650 mg.37 Aunque no se ha llegado a un consenso definitivo sobre ninguna de estas cuestiones, los profesionales sanitarios deberían educar a sus pacientes sobre la importancia de seguir las instrucciones del etiquetado.
Papel del farmacéutico
Los farmacéuticos están en posición de promover eficazmente el uso seguro del paracetamol. Muchos pacientes desconocen la dosis máxima diaria de paracetamol y el potencial de toxicidad.39 Además, es posible que los pacientes no comprendan que el paracetamol está contenido en más de 600 productos diferentes.39 Todos los pacientes que reciban una receta de un producto que contenga paracetamol deben ser asesorados para garantizar el conocimiento del principio activo. Los farmacéuticos deben desempeñar un papel proactivo en la educación de los pacientes que adquieren productos de acetaminofén de venta libre. Los farmacéuticos son vitales para prevenir el uso indebido del paracetamol garantizando el uso seguro del fármaco mediante la educación de los pacientes y la revisión de sus historiales de medicación.
Además, los farmacéuticos deben recomendar a los pacientes que se pongan en contacto con la línea nacional de ayuda contra el envenenamiento si sospechan una sobredosis de paracetamol. El número gratuito es el 1-800-222-1222.40 Al llamar a este número, los pacientes serán conectados con el centro regional de control de intoxicaciones más cercano, con especialistas disponibles las 24 horas del día, los 7 días de la semana. Estos especialistas podrán ayudar a evaluar y gestionar la posible sobredosis de paracetamol. Estas actividades minimizarán el riesgo de dosificación inadecuada, la duplicación de la terapia y el uso inapropiado del medicamento.
1. Kaufman DW, Kelly JP, Rosenberg L, et al. Patrones recientes de uso de medicamentos en la población adulta ambulatoria de los Estados Unidos: la encuesta Slone. JAMA. 2002;287:337-344.
2. Paulose-Ram R, Hirsch R, Dillon C, et al. Prescription and nonprescription analgesic use among the US adult population: results from the third National Health and Nutrition Examination Survey (NHANES III). Pharmacoepidemiol Drug Saf. 2003;12:315-326.
3. Paulose-Ram R, Hirsch R, Dillon C, et al. Frequent monthly use of selected nonprescription and prescription non-narcotic analgesics among U.S. adults. Pharmacoepidemiol Drug Saf. 2005;14:257-266.
4. Burke A, Smyth EM, Fitzgerald GA. Analgesic-antipyretic agents; pharmacotherapy of gout. En: Brunton LL, Laso JS, Parker K, eds. Goodman and Gilman’s the Pharmacological Basis of Therapeutics. 11th ed. Nueva York, NY: McGraw-Hill; 2006:671-716.
5. Watkins PB, Kaplowitz N, Slattery JT, et al. Amino-transferase elevations in healthy adults receiving 4 grams of acetaminophen daily: a randomized controlled trial. JAMA. 2006;296:87-93.
6. Chun LJ, Tong MJ, Busuttil RW, et al. Acetaminophen hepatotoxicity and acute liver failure. J Clin Gastroenterol. 2009;43:342-349.
7. Bronstein AC, Spyker DA, Cantilena LR, et al. 2011 annual report of the American Association of Poison Control Centers’ National Poison Data System (NPDS): 29th annual report. Clin Toxicol. 2012;50:911-1164.
8. Schilling A, Corey R, Leonard M, et al. Acetaminofén: viejo medicamento, nuevas advertencias. Cleve Clin J Med. 2010;77:19-27.
9. Nourjah P, Ahmad SR, Karwoski C, et al. Estimaciones de las sobredosis asociadas al acetaminofén (paracetamol) en los Estados Unidos. Pharmacoepidemiol Drug Saf. 2006;15:398-405.
10. Larson AM, Polson J, Fontana RJ, et al. Acetaminophen-induced acute liver failure: results of a United States multicenter, prospective study. Hepatology. 2005;42:1364-1372.
11. Lee WM, Larson AM, Stravitz T. AASLD position paper: the management of acute liver failure: update 2011. Baltimore, MD: Asociación Americana para el Estudio de las Enfermedades del Hígado; septiembre de 2011. www.aasld.org/practiceguidelines/Documents/AcuteLiverFailureUpdate2011.pdf. Consultado el 15 de diciembre de 2013.
12. Información profesional del producto Tylenol (acetaminofén). Fort Washington, PA: McNeil Consumer Healthcare; 2010.
13. Hendrickson RG. Acetaminofeno. En: Nelson LS, Lewin NA, Howland M, eds. Goldfrank’s Toxicologic Emergencies. 9th ed. New York, NY: McGraw-Hill; 2011:483-99.
14. Hodgman MJ, Garrard AR. Una revisión de la intoxicación por paracetamol. Crit Care Clin. 2012;499-516.
15. Larson AM. Hepatotoxicidad por paracetamol. Clin Liver Dis. 2007;11:525-548.
16. Rumack BH. Acetaminophen hepatotoxicity: the first 35 years. J Toxicol Clin Toxicol. 2002;40:3-20.
17. Nelson SD. Molecular mechanisms of the hepatotoxicity caused by acetaminophen. Semin Liver Dis. 1990;10:267-278.
18. Lee WH. Drug-induced hepatotoxicity. N Engl J Med. 1995;333:1118-1127.
19. Fontana RJ. Acute liver failure including acetaminophen overdose. Med Clin North Am. 2008;92:761-794.
20. Comité de medicamentos de la Academia Americana de Pediatría. Toxicidad del paracetamol en niños. Pediatrics. 2001;108:1020-1024.
21. Dart RC, Erdman AR, Olson KR, et al. Acetaminophen poisoning: an evidence-based consensus guideline for out-of-hospital management. Clin Toxicol. 2006;44:1-18.
22. Heard KJ. Acetylcysteine for acetaminophen poisoning. N Engl J Med. 2008;359:285-292.
23. Ferner RE, Dear JW, Bateman DN. Manejo de la intoxicación por paracetamol. BMJ. 2011;342:d2218.
24. Kuffner EK, Dart RC, Bogdan GM, et al. Efecto de las dosis máximas diarias de paracetamol en el hígado de pacientes alcohólicos: un ensayo aleatorizado, doble ciego y controlado con placebo. Arch Intern Med. 2001;161:2247-2252.
25. Kuffner EK, Green JL, Bogdan GM, et al. The effect of acetaminophen (four grams a day for three consecutive days) on hepatic tests in alcoholic patients-a multicenter randomized study. BMC Med. 2007;5:13.
26. Rumack BH. Acetaminophen misconceptions. Hepatology. 2004;40:10-15.
27. Christophersen AB, Levin D, Hoegberg LC, et al. Activated charcoal alone or after gastric lavage: a simulated large paracetamol intoxication. Br J Clin Pharmacol. 2002;53;312-317.
28. Sato RL, Wong JJ, Sumida SM, et al. Eficacia de la administración de carbón superactivado tarde (3 horas) después de la sobredosis de paracetamol. Am J Emerg Med. 2003;21:189-191.
29. Spiller HA, Winter ML, Klein-Schwartz W, et al. Eficacia del carbón activado administrado más de cuatro horas después de la sobredosis de paracetamol. J Emerg Med. 2006;30:1-5.
30. Chyka PA, Seger D, Krenzelok EP, et al. Position paper: single-dose activated charcoal. Clin Toxicol. 2005;43:61-87.
31. Kozer E, Koren G. Management of paracetamol overdose: current controversies. Drug Safety. 2001;24:503-512.
32. Sandilands EA, Bateman DN. Adverse reactions associated with acetylcysteine. Clin Toxicol. 2009;47:81-88.
33. Hayes BD, Klein-Schwartz W, Doyon S. Frecuencia de errores de medicación con acetilcisteína intravenosa para la sobredosis de paracetamol. Ann Pharmacother. 2008;42:766-770.
34. 29-30 de junio de 2009: Reunión conjunta del Drug Safety and Risk Management Advisory Committee con el Anesthetic and Life Support Drugs Advisory Committee y el Nonprescription Drugs Advisory Committee: Material informativo de la FDA. Actualizado el 30 de julio de 2013. www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/DrugSafetyandRiskManagementAdvisoryCommittee/UCM164897.pdf. Consultado el 15 de diciembre de 2013.
35. Comunicación de seguridad de medicamentos de la FDA: La FDA advierte de reacciones cutáneas raras pero graves con el analgésico/reductor de la fiebre acetaminofén. 1 de agosto de 2013. www.fda.gov/Drugs/DrugSafety/ucm363041.htm. Consultado el 16 de diciembre de 2013.
36. Comunicación de seguridad de medicamentos de la FDA: Los productos de acetaminofén de prescripción se limitarán a 325 mg por unidad de dosis; la advertencia en el recuadro destacará el potencial de insuficiencia hepática grave. 13 de enero de 2011. www.fda.gov/Drugs/DrugSafety/ucm239821.htm. Consultado el 16 de diciembre de 2013.
37. Krenzelok EP. Comentario: la reunión del Comité Asesor de Acetaminofeno de la FDA. Cuál es el futuro del paracetamol en Estados Unidos? La perspectiva de un miembro del comité. Clin Toxicol. 2009;47:784-789.
38. Pappas M, Bryan K. OTC industry announces voluntary transition to one concentration of single-ingredient pediatric liquid acetaminophen medicines. Productos para el cuidado de la salud del consumidor. May 11, 2011. www.chpa.org/05_04_11_PedAcet.aspx. Consultado el 15 de diciembre de 2013.
39. Hornsby LB, Whitley HP, Hester EK, et al. Encuesta sobre los conocimientos de los pacientes relacionados con el reconocimiento, la dosificación y la toxicidad del paracetamol. J Am Pharm Assoc. 2010;50:485-489.
40. American Association of Poison Control Centers. www.aapcc.org. Consultado el 25 de febrero de 2014.