Ora guardiamo il quadro completo. C’è una scala per gli acidi e le basi proprio come ogni altra cosa. Ecco un paio di definizioni che dovresti conoscere:
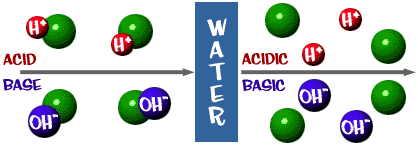
Acido: Una soluzione che ha un eccesso di ioni H+. Deriva dalla parola latina acidus, che significa “acuto” o “acido”.
Base: Una soluzione che ha un eccesso di ioni OH-. Un’altra parola per base è alcali.
Aqueo: Una soluzione che è principalmente acqua. Pensate alla parola acquario. AQUA significa acqua.
Acido forte: Un acido che ha un pH molto basso (0-4).
Base forte: Una base che ha un pH molto alto (10-14).
Acido Debole: Un acido che si ionizza solo parzialmente in una soluzione acquosa. Questo significa che non tutte le molecole si rompono. Gli acidi deboli di solito hanno un pH vicino a 7 (3-6).
Base debole: Una base che si ionizza solo parzialmente in una soluzione acquosa. Questo significa che non tutte le molecole si separano. Le basi deboli di solito hanno un pH vicino a 7 (8-10).
Neutro: Una soluzione che ha un pH di 7. Non è né acida né basica.
Ti abbiamo parlato di quel tizio Arrhenius e delle sue idee sulle concentrazioni di ioni idrogeno e idrossido. Imparerai anche le idee di Brønsted-Lowry. Questi due chimici danesi e inglesi consideravano gli acidi come donatori e le basi come accettatori. Che cosa donavano e accettavano? Gli ioni di idrogeno. È molto simile alla prima definizione che abbiamo dato, dove un acido si rompe e rilascia/dona uno ione idrogeno. Questa nuova definizione è un po’ più dettagliata. Gli scienziati hanno usato la nuova definizione per descrivere più basi, come l’ammoniaca (NH3). Poiché le basi sono accettori di protoni, quando l’ammoniaca veniva vista accettare un H+ e creare uno ione ammonio (NH4+), poteva essere etichettata come una base. Non ci si doveva più preoccupare degli ioni idrossido. Se otteneva l’H+ da una molecola d’acqua, allora l’acqua (H2O) era il donatore di protoni. Questo significa che l’acqua era l’acido in questa situazione? Sì.
Un chimico di nome Lewis ha offerto un terzo modo di guardare agli acidi e alle basi. Invece di guardare agli ioni di idrogeno, guardò alle coppie di elettroni (ricordate le nostre immagini con le strutture a punti in Atomi ed elementi?) Secondo Lewis, gli acidi accettano coppie di elettroni e le basi donano coppie di elettroni. Sappiamo che entrambe queste descrizioni di acidi e basi usano termini completamente opposti, ma l’idea è la stessa. Gli ioni idrogeno vogliono ancora accettare due elettroni per formare un legame. Le basi vogliono cederli. Nel complesso, la definizione di Lewis è stata in grado di classificare ancora più composti come acidi o basi.
Cosa succede veramente?
Cosa succede veramente in queste soluzioni? Qui diventa un po’ complicato. Guardiamo la rottura delle molecole nelle soluzioni acquose (a base d’acqua) ancora una volta, per buona misura. Gli acidi sono composti che si dissociano (si rompono) in ioni idrogeno (H+) e un altro composto quando vengono posti in una soluzione acquosa. Ricordate l’esempio dell’acido acetico? Le basi sono composti che si scindono in ioni idrossido (OH-) e un altro composto quando vengono posti in una soluzione acquosa. Parleremo del bicarbonato di sodio tra qualche paragrafo.
Cambiamo un po’ la formulazione. Se avete un composto ionico/elettrovalente e lo mettete in acqua, si scinderà in due ioni. Se uno di questi ioni è H+, la soluzione è acida. Il forte acido cloruro di idrogeno (HCl) è un esempio. Se uno degli ioni è OH-, la soluzione è basica. Un esempio di base forte è l’idrossido di sodio (NaOH). Ci sono altri ioni che rendono le soluzioni acide e basiche, ma non ne parleremo qui.
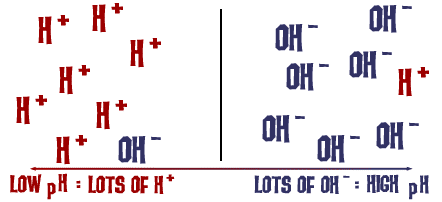
La scala del pH di cui abbiamo parlato è in realtà una misura del numero di ioni H+ in una soluzione. Se ci sono molti ioni H+, il pH è molto basso. Se ci sono molti ioni OH- rispetto al numero di ioni H+, il pH è alto.
Pensa a questa idea per un secondo: perché un liquido con alti livelli di NaOH sarebbe molto basico, ma allo stesso tempo pericoloso? Il legame Na-OH si rompe in soluzione e si hanno ioni sodio (positivi) e ioni idrossido (negativi). Gli ioni di sodio non costituiscono davvero un pericolo in soluzione, ma c’è un numero enorme di ioni idrossido in soluzione rispetto agli ioni idrogeno che potrebbero galleggiare in giro come H3O+ (uno ione idronio). tutti quegli ioni OH- in eccesso rendono il pH super alto, e la soluzione reagirà facilmente con molti composti. La stessa cosa accade su una scala meno pericolosa quando si aggiunge bicarbonato di sodio all’acqua. Durante la dissociazione, ioni OH- e acido carbonico vengono rilasciati nella soluzione. Il numero di ioni OH- è maggiore del numero di ioni H3O+ (H+ e H2O), e il pH aumenta. Solo che non è una differenza così forte come nell’idrossido di sodio.
Questo è praticamente tutto. (Ha ha! Capito?)
Più informazioni nella prima parte.
Video correlati…
Encyclopædia Britannica: Basi
Wikipedia: Acidi
Wikipedia: Basi
Encyclopedia.com: Acidi
Enciclopedia.com: Basi