Veamos ahora el cuadro completo. Hay una escala para los ácidos y las bases como todo lo demás. Aquí hay un par de definiciones que debes conocer:
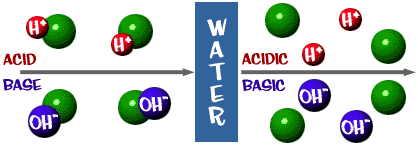
Ácido: Una solución que tiene un exceso de iones H+. Viene de la palabra latina acidus, que significa «agudo» o «agrio».
Base: Una solución que tiene un exceso de iones OH-. Otra palabra para base es álcali.
Acuosa: Una solución que es principalmente agua. Piensa en la palabra acuario. AQUA significa agua.
Ácido fuerte: Un ácido que tiene un pH muy bajo (0-4).
Base fuerte: Una base que tiene un pH muy alto (10-14).
Ácido débil: Un ácido que sólo se ioniza parcialmente en una solución acuosa. Esto significa que no todas las moléculas se rompen. Los ácidos débiles suelen tener un pH cercano a 7 (3-6).
Base débil: Una base que sólo se ioniza parcialmente en una solución acuosa. Esto significa que no todas las moléculas se rompen. Las bases débiles suelen tener un pH cercano a 7 (8-10).
Neutral: Una solución que tiene un pH de 7. No es ni ácida ni básica.
Te hemos hablado del tal Arrhenius y de sus ideas sobre las concentraciones de iones hidrógeno e hidróxido. También vas a conocer las ideas de Brønsted-Lowry. Estos dos químicos de Dinamarca e Inglaterra consideraban a los ácidos como donantes y a las bases como aceptantes. ¿Qué estaban donando y aceptando? Iones de hidrógeno. Se parece mucho a la primera definición que dimos, en la que un ácido se rompe y libera/dona un ion hidrógeno. Esta nueva definición es un poco más detallada. Los científicos utilizaron la nueva definición para describir más bases, como el amoníaco (NH3). Dado que las bases son aceptantes de protones, cuando se veía que el amoníaco aceptaba un H+ y creaba un ion amonio (NH4+), podía etiquetarse como base. Ya no tenía que preocuparse por los iones hidróxido. Si obtenía el H+ de una molécula de agua, entonces el agua (H2O) era el donante de protones. ¿Significa eso que el agua era el ácido en esta situación? Sí.
Un químico llamado Lewis ofreció una tercera forma de ver los ácidos y las bases. En lugar de mirar a los iones de hidrógeno, miró a los pares de electrones (¿recuerdas nuestras imágenes con estructuras de puntos en Átomos y Elementos?). Según Lewis, los ácidos aceptan pares de electrones y las bases donan pares de electrones. Sabemos que ambas descripciones de ácidos y bases utilizan términos completamente opuestos, pero la idea es la misma. Los iones de hidrógeno siguen queriendo aceptar dos electrones para formar un enlace. Las bases quieren renunciar a ellos. En general, la definición de Lewis fue capaz de clasificar aún más compuestos como ácidos o bases.
¿Qué ocurre realmente?
¿Qué ocurre realmente en esas soluciones? Aquí la cosa se complica un poco. Veamos una vez más la ruptura de las moléculas en las soluciones acuosas (a base de agua). Los ácidos son compuestos que se disocian (rompen) en iones de hidrógeno (H+) y otro compuesto cuando se colocan en una solución acuosa. ¿Recuerdas el ejemplo del ácido acético? Las bases son compuestos que se rompen en iones de hidróxido (OH-) y otro compuesto cuando se colocan en una solución acuosa. Hablaremos del bicarbonato de sodio en unos pocos párrafos.
Cambiemos un poco la redacción. Si tienes un compuesto iónico/electrovalente y lo pones en agua, se romperá en dos iones. Si uno de esos iones es H+, la solución es ácida. El ácido fuerte cloruro de hidrógeno (HCl) es un ejemplo. Si uno de los iones es OH-, la solución es básica. Un ejemplo de base fuerte es el hidróxido de sodio (NaOH). Hay otros iones que hacen soluciones ácidas y básicas, pero no hablaremos de ellos aquí.
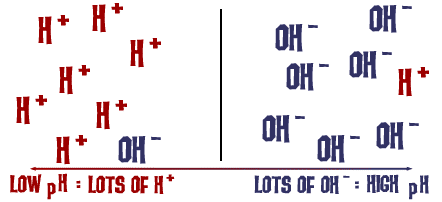
La escala de pH de la que hablamos es en realidad una medida del número de iones H+ en una solución. Si hay muchos iones H+, el pH es muy bajo. Si hay muchos iones OH- en comparación con el número de iones H+, el pH es alto.
Piensa en esta idea por un segundo: ¿Por qué un líquido con altos niveles de NaOH sería muy básico, pero peligroso al mismo tiempo? El enlace Na-OH se rompe en la solución y tienes iones de sodio (positivos) e iones de hidróxido (negativos). Los iones de sodio no suponen realmente un peligro en la solución, pero hay un gran número de iones de hidróxido en la solución en comparación con los iones de hidrógeno que podrían estar flotando como H3O+ (un ion hidronio).Todo ese exceso de iones OH- hace que el pH sea muy alto, y la solución reaccionará fácilmente con muchos compuestos. Lo mismo ocurre a una escala menos peligrosa cuando se añade bicarbonato al agua. Durante la disociación, se liberan iones OH- y ácido carbónico en la solución. El número de iones OH- es mayor que el número de iones H3O+ (H+ y H2O), y el pH aumenta. Sólo que no es una diferencia tan fuerte como en el hidróxido de sodio.
Eso es básicamente. (¡Ja, ja! ¿Lo pillas?)
Más información en la primera parte.
Vídeo relacionado…
Encyclopædia Britannica: Bases
Wikipedia: Ácidos
Wikipedia: Bases
Enciclopedia.com: Acids
Encyclopedia.com: Bases