Niezbędna chemia miedzi(I)
Dysproporcjonowanie jonów miedzi(I) w roztworze
Chemia miedzi(I) jest ograniczona przez reakcję, która zachodzi z udziałem prostych jonów miedzi(I) w roztworze. Jest to dobry przykład dysproporcjonowania – reakcji, w której coś się utlenia i redukuje.
Jony miedzi(I) w roztworze ulegają dysproporcjonowaniu dając jony miedzi(II) i osad miedzi.
Reakcja jest następująca:
![]()
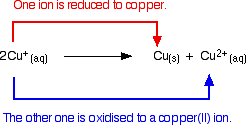
Każda próba wytworzenia prostego związku miedzi(I) w roztworze prowadzi do tego zjawiska.
Na przykład, jeśli zareagujesz na tlenek miedzi(I) z gorącym rozcieńczonym kwasem siarkowym, możesz oczekiwać, że otrzymasz roztwór siarczanu miedzi(I) i wodę. W rzeczywistości otrzymujemy brązowy osad miedzi i niebieski roztwór siarczanu miedzi(II) z powodu reakcji dysproporcjonowania.
![]()
![]()
Stabilizowanie stanu utlenienia miedzi(I)
Nierozpuszczalne związki miedzi(I)
Widzieliśmy już, że jodek miedzi(I) powstaje w postaci białego osadu, jeśli dodamy roztwór jodku potasu do roztworu zawierającego jony miedzi(II). Jodek miedzi(I) jest praktycznie nierozpuszczalny w wodzie, a więc reakcja dysproporcjonowania nie zachodzi.
Podobnie chlorek miedzi(I) może być produkowany jako biały osad (reakcja opisana poniżej). Pod warunkiem, że zostanie on oddzielony od roztworu i wysuszony tak szybko jak to możliwe, pozostaje biały. Jednak w kontakcie z wodą powoli staje się niebieski, ponieważ tworzą się jony miedzi(II).
Reakcja dysproporcjonowania zachodzi tylko z prostymi jonami miedzi(I) w roztworze.
Kompleksy miedzi(I)
Tworzenie kompleksów miedzi(I) (innych niż ten z wodą jako ligandem) również stabilizuje stan utlenienia miedzi(I).
Na przykład, zarówno + jak i – są kompleksami miedzi(I), które nie ulegają dysproporcjonowaniu.
Kompleks zawierający chlor powstaje, gdy tlenek miedzi(I) jest rozpuszczony w stężonym kwasie solnym.
Można myśleć o tym, że dzieje się to w dwóch etapach. Po pierwsze, powstaje chlorek miedzi(I):
![]()
![]()
Ale w obecności nadmiaru jonów chlorkowych z HCl, reaguje on dając stabilny, rozpuszczalny kompleks miedzi(I).
![]()
![]()
Można uzyskać biały osad chlorku miedzi(I) (wspomniany powyżej) dodając wodę do tego roztworu. Odwraca to ostatnią reakcję poprzez usunięcie dodatkowego jonu chlorkowego.
Pytania sprawdzające zrozumienie
Jeśli jest to pierwszy zestaw pytań, które wykonujesz, proszę przeczytaj stronę wprowadzającą przed rozpoczęciem. Będziesz musiał użyć PRZYCISKU WSTECZ w swojej przeglądarce, aby wrócić tutaj później.
Pytania dotyczące miedzi
odpowiedzi
Gdzie chciałbyś teraz pójść?
Do menu metali przejściowych . . .
Do menu Chemia nieorganiczna . . .
Do menu głównego . . .