- Mariposas acasalamento (Tineidae, Ditrysia, Lepidoptera) preservadas como comportamento congelado inclusão no Baltic Amber (Eocene)
- ABSTRACT
- INTRODUCTION
- MATERIAIS E MÉTODOS
- SYSTEMATIC PALAEONTOLOGY
- DISCUSSÃO
- Coincidência Aleatória ou um Acasalamento Preservado?
- Tafonomia
- Dimorfismo sexual
- Habitat
- CONCLUSÃO
- ACKNOWLEDGMENTS
Mariposas acasalamento (Tineidae, Ditrysia, Lepidoptera) preservadas como comportamento congelado inclusão no Baltic Amber (Eocene)
Thilo C. Fischer e Marie K. Hörnig
Número de artigo: 22.1.7
https://doi.org/10.26879/829
Copyright Paleontological Society, fevereiro de 2019
Biografias dos autores
Resumos em linhagens e em vários idiomas
Versão PDF
Submissão: 22 Octobere 2017. Aceitação: 23 Januiary 2019
{flike id=2421}
ABSTRACT
A investigação das inclusões de âmbar proporciona uma visão única da biologia dos animais que viveram há milhões de anos, devido à sua excepcional preservação em condições quase vitais. Isto não é verdade apenas para aspectos morfológicos, aspectos do comportamento também podem ser deduzidos destes fósseis.
Aqui, Microlepidópteros são relatados do âmbar do Báltico Eoceno muito provavelmente como uma primeira ocorrência de Lepidópteros fósseis encontrados em cópula. As mariposas pertencem a Tineidae (mariposas tíneas incluem mariposas do vestuário) e são descritas como uma nova espécie e um novo gênero, Forcepsites michalskii. O órgão de fecho do macho é bastante incomum para as mariposas do âmbar do Báltico, com uma parte ventral e dorsal, cada uma terminando em duas protuberâncias paralelas, em forma de espinhos, e aparentemente não sendo formada pela valva. A co-ocorrência de machos e fêmeas, muito provavelmente em cópula, permitiu estudar diretamente seu dimorfismo sexual, e há evidências de que o habitat desta espécie é o local de produção de resina na floresta de âmbar do Báltico. A partir do dimorfismo sexual das antenas e da morfologia dos olhos é interpretado que a fêmea foi o chamado sexo para o acasalamento nesta espécie.
Thilo C. Fischer. Förderverein der Bayerischen Staatssammlung für Paläontologie und Historische Geologie München Richard-Wagner-Straße 10, D-80333 München, Alemanha.
Marie K. Hörnig. Universidade de Greifswald, Instituto Zoológico e Museu, Cytology and Evolutionary Biology, Soldmannstr. 23, D-17489 Greifswald, Alemanha.
PALAVRAS-CHAVE: Traças de roupa; habitat em cópula; Microlepidópteros; novas espécies e género; dimorfismo sexual
Citação final: Fischer, Thilo C, e Hörnig, Marie K. 2019. Traças acasaladoras (Tineidae, Ditrysia, Lepidoptera) preservadas como inclusão de comportamento congelado no Baltic Amber (Eocene). Paleontologia Electrónica 22.1.7A 1-11. https://doi.org/10.26879/829
palaeo-electronica.org/content/2019/2421-mating-moths
Copyright: Fevereiro 2019 Sociedade Paleontológica.
Este é um artigo de acesso aberto distribuído nos termos da Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0), que permite aos usuários copiar e redistribuir o material em qualquer meio ou formato, desde que não seja utilizado para fins comerciais e que o autor original e a fonte sejam creditados, com indicações se alguma alteração for feita.
creativecommons.org/licenses/by-nc-sa/4.0/
http://zoobank.org/BCF64D89-6879-4805-8021-7CE926CE4B12
INTRODUCTION
Insectos acasalados raramente são encontrados no âmbar como casos do chamado ‘comportamento congelado’ (Arillo, 2007, e suas referências). Tais foram relatados do âmbar do Báltico Eoceno, por exemplo, dos grupos Diptera, Coleoptera, Hemiptera, Hymenoptera e muito raramente Trichoptera (Weitschat e Wichard, 2002; Weitschat, 2009; Boucot e Poinar Jr., 2010; Gröhn, 2016).
No âmbar do Báltico, Lepidoptera são geralmente raros e ocorrem com cerca de uma em 250 inclusões (para comparação: Os dípteros representam cerca de 64% de todos os insectos no âmbar do Báltico, os Lepidoptera representam cerca de 0,4%; Hoffeins e Hoffeins 2003; Gröhn 2016). Como em outros insetos, os imagos preservados em cópula são muito mais raros e Lepidoptera em cópula ainda não foram descritos, nem mesmo em outros âmbares ou de localidades de insetos não-marítimos (Sohn et al., 2012; Sohn e Lamas, 2013). Uma ocorrência em cópula permite a afiliação de boa fé de ambas as formas sexuais uma à outra e de ambas juntas a uma espécie distinta e, portanto, a descrição exata do dimorfismo sexual de uma espécie. Alternativamente, o dimorfismo sexual de insetos fósseis só pode ser estudado por meios estatísticos quando os achados de uma espécie são abundantes como em muitos Nematocera (por exemplo, Borkent, 1995).
Tineidae são representantes basais altamente divergentes do grupo lepidóptero Ditrysia (Regier et al., 2014), suas larvas se alimentam de uma ampla gama de substratos (detritos, fungos, líquens ou queratina) (Scoble, 1995), sendo assim generalistas (85,7%) (Menken et al., 2009). Como inclusões de âmbar do Báltico, os Tineidae representam cerca de um quarto de todas as descobertas de lepidópteros (Skalski, 1977). Aqui, uma espécie rara e nova de Tineidae é descrita com suas formas sexuais a partir de uma suposta ocorrência em cópula.
MATERIAIS E MÉTODOS
O espécime âmbar foi encontrado e comprado de Artur Michalski (Wroclaw, Polônia). Foi preservado por tratamento com verniz acrílico e é da colecção do autor (TF) com o número de colecção 7131. O armazenamento ocorreu a temperatura constante em sacos de plástico com clipes dentro de caixas metálicas, excluindo oxigénio e luz. Será depositado na Bayerische Paläontologische Staatssammlung München com o número SNSB-BSPG 2017 I 113.
A amostra foi fotografada com uma Canon EOS 70d equipada com uma objectiva Canon MP-E 65 mm e um Canon Twin Flash MT-24. Para evitar reflexos, filtros de polarização foram montados e ajustados na frente dos flashes e da objetiva da câmera (luz polimerizada cruzada). Para reduzir a convexidade e as concavidades da superfície âmbar, foi aplicada uma gota de glicerina e coberta com um slip de cobertura. As imagens gravadas foram fundidas com Combine ZP e posteriormente processadas com o Adobe Photoshop CS 3. A inclusão não pôde ser estudada por microcomputador-tomografia, devido à presença de inclusões metálicas, aparentemente piríticas, que causam artefatos fortes.
SYSTEMATIC PALAEONTOLOGY
Sistemática (de acordo com van Nieukerken et al., 2011)
Ordem LEPIDOPTERA Linnaeus, 1758
Clade DITRYSIA Börner, 1925
Superfamily TINEOIDEA Latreille, 1810
Family TINEIDAE Latreille, 1810
Genus Forcepsites nov. gen.
zoobank.org/DDB6884D-845A-4A87-981E-A2953ADD8964
Etymology. “Forceps”, latim para fórceps, referente ao órgão masculino de fecho.
Espécie Forcepsites michalskii nov. spec.
zoobank.org/5494D58E-7773-473C-AFB2-140DDD049226
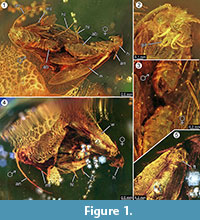 Holotypus. Espécimen ex coll. Fischer no. 7131, Figura 1.2
Holotypus. Espécimen ex coll. Fischer no. 7131, Figura 1.2
Locus typicus. Mina de Yantarni, GUS
Stratum typicum. “Blaue Erde” (Eoceno superior – Oligoceno inferior)
Etimologia. O nome da espécie michalskii é escolhido para reconhecer Artur Michalski por fornecer este espécime.
Repositório. Bayerische Staatssammlung für Paläontologie und Geologie, Munique, Alemanha; número de adesão SNSB-BSPG 2017 I 113.
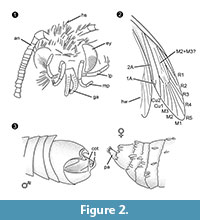
Diagnóstico do gênero. Género monotípico com o órgão de fecho do macho (Figura 2.3) com uma parte ventral e dorsal, cada uma terminando em duas protuberâncias paralelas, em forma de espinhos, como o carácter definidor.
 Diagnóstico das espécies. Os respectivos caracteres qualitativos e quantitativos dos imagos feminino e masculino (Figura 1) foram determinados e estão resumidos na Tabela 1.
Diagnóstico das espécies. Os respectivos caracteres qualitativos e quantitativos dos imagos feminino e masculino (Figura 1) foram determinados e estão resumidos na Tabela 1.
Diagnóstico diferencial. A combinação de caracteres probóscitos pequenos com galeia separada, paletas maxilares longas e dobradas com cinco segmentos, para cima e paletas labiais levemente dobradas com cerdas laterais, cabeça com muitas escamas eretas em forma de cabelo sugerem fortemente uma afiliação a Tineidae, mas nenhuma delas é apomórfica, nem tal apomorfia é atualmente conhecida para Tineidae adultos (Regier et al., 2014). As veias R4 e R5 não são fundidas / perseguidas, o que seria indicativo para Gelechioidea (Gelechiidae e Oecophoridae) (Scoble, 1995), o outro grande grupo de Lepidoptera encontrado no âmbar do Báltico. A espécie é diferente de qualquer representante de Tineidae ou outras famílias do âmbar báltico (Rebel, 1934, 1935; Kuznezov, 1941; Skalski, 1973; Kozlov, 1987, 1988; Sohn et al., 2012; Sohn e Lamas, 2013), especialmente no que diz respeito ao seu aparelho genital masculino. A maioria dos similares parece Tineosemopsis decurtatus Skalski 1974 (feminino conhecido) mas difere na ausência de pêlos erectos no vértice e nos seus olhos mais pequenos. Tillyardinea eocaenica Kusnezov 1941 (fêmea), que tem escamas eretas no vértice e uma venação semelhante, difere em seus frons e palpitações labiais. Simulotinea intermedia Skalski 1977 tem um hábito semelhante mas também difere na presença de uma veia bifurcada, que divide a grande célula na asa anterior (M2+3).
Tafonomia. Macho e fêmea de Forcepsites michalskii são fossilizados nas proximidades e com a parte posterior do abdômen dirigida um para o outro. As duas inclusões estão numa peça cilíndrica de âmbar báltico não autoclavado com um diâmetro de 15 mm e uma altura de 11 mm que está dividida em cerca de metade da sua altura por uma borda desnivelada entre duas camadas de fluxo de resina. Esta borda mostra uma camada de pirita como parte do seu plano. Um fluxo de resina contém as duas traças expondo os seus respectivos lados dorsais a esta borda. As longas escamas que derivam da borda da asa feminina são preservadas. A imago fêmea perdeu duas pernas e o seu tórax está danificado. O outro fluxo contém séries não lineares de bolhas. Ambos os indivíduos parecem ter surgido recentemente, a julgar pela completa vestimenta das escamas nas asas, e as asas não estão esfarrapadas. Nenhum órgão perfumado pode ser identificado nas asas, abdômen ou pernas. As únicas sininclusões preservadas com a Microlepidoptera são tricomas, típicos do âmbar báltico.
DISCUSSÃO
Coincidência Aleatória ou um Acasalamento Preservado?
As traças fechadas são representantes masculinos e femininos da mesma espécie e estão dispostas nas proximidades com os abdômens orientados um para o outro. No entanto, os genitais das mariposas não estão em contacto directo, mas numa posição próxima. A orientação dorsal/ventral de macho e fêmea difere ligeiramente, o que é causado por uma leve rotação dentro do eixo do corpo (especialmente do macho). A orientação da parte posterior do abdômen de ambas as mariposas é em direção uma à outra.
Existem vários casos conhecidos, onde a situação de enclausuramento na resina ainda líquida pode induzir uma resposta de estresse, como a oviposição (Weitschat, 2009). A indução do comportamento de acasalamento pelo fluxo de resina geralmente não é plausível, mas a situação do recinto demonstra que movimentos leves dentro da resina fresca foram possíveis.
Há também a questão se este achado também poderia representar uma co-ocorrência aleatória. A probabilidade de uma tal co-ocorrência aleatória pode ser estimada de forma aproximada. Entre as inclusões de insetos ocorrem traças com uma freqüência de cerca de uma em 250 inclusões no âmbar do Báltico (Krzeminskaet al., 1991 (0,6%); Hoffeins e Hoffeins, 2003 (0,4%); Sontag, 2003 (0,27%), e observação própria). Dado um âmbar individual com inclusão de uma traça, a hipótese de co-ocorrência aleatória de outra traça é simplesmente 1:250 (as traças não ocorrem em enxames). A co-ocorrência do mesmo táxon, ou de um táxon abundante que pode estar equivocado, é estimada em 1:10 na melhor das hipóteses (Skalski, 1977), e outra cerca de 1:2 por ter diferentes sexos. Considerando as chances adicionais de arranjo próximo, tanto o alinhamento dos eixos do corpo, quanto uma orientação corporal adequada, a probabilidade de uma co-ocorrência aleatória que poderia ser mal interpretada como um evento de acasalamento é muito menor do que a freqüência observada como uma das 920 inclusões de lepidópteros na coleção do autor estudado.
Em conclusão, a interpretação mais provável para este achado é que as traças estavam em cópula, e os genitais tinham estado em contato, mas os indivíduos estavam ligeiramente distraídos uns dos outros devido ao fluxo de resina (ver discussão abaixo).
Tafonomia
A relevância de uma análise cuidadosa dos fluxos de resina para a taphonomia das inclusões de âmbar foi demonstrada por Coty et al. (2014) com seu estudo de uma interação formiga – cupim preservada em Chiapas âmbar mexicano.
A ocorrência de um evento em cópula é fortemente suportada pelo achado de longas escalas derivadas da borda da asa feminina, que se deslocaram por alguma distância na direção do macho. Isto poderia indicar um forte fluxo de resina laminar neste local que se movia ao longo do seu eixo comum, e poderia tê-los afastado para a curta distância observada agora. Durante o acasalamento das traças, o macho pode perder o contato com o local de acasalamento e só pode ser fixado à fêmea pelo órgão de fecho, com apenas a fêmea fazendo um contato com a superfície. Este comportamento e o arrastamento do fluxo repentino de resina pode ser a razão pela qual a fêmea perdeu ambas as pernas traseiras. No lado dorsal das traças, que tinham sido expostas na superfície convexa deste primeiro fluxo laminar de resina, a asa da fêmea e seu tórax subjacente é parcialmente danificado (Figura 1.5). Putativamente, estas áreas destruídas representam vestígios de alimentação causados por outros insectos, muito provavelmente formigas, como frequentemente observado em espécimes de cor âmbar. Assim, após o primeiro fluxo de resina como evento de incorporação, os lados dorsais terão sido expostos durante algum tempo, tempo suficiente para permitir que os predadores andassem sobre esta superfície sólida. O segundo fluxo de resina, que cobriu este lado mais tarde, poderia ter sido um fluxo rápido e turbulento de resina, como indicado por uma série de pequenas bolhas dispostas em curvas irregulares encontradas dentro dela. Este seria um típico processo taphonômico para um chamado “Schlaube” de âmbar do Báltico (Gröhn, 2016).
Dimorfismo sexual
Dimorfismo sexual é difícil de observar em espécies fósseis, das quais apenas alguns espécimes são normalmente conhecidos. Os caracteres não influenciados pelo sexo têm que ser diagnosticados para permitir a determinação segura das espécies como base para uma maior diferenciação entre os sexos e a elucidação do dimorfismo sexual. Considerando espécies extintas altamente dimórficas sexualmente, por exemplo, com fêmeas braquicíferas como em muitos Psychidae (Scoble, 1995), uma inferência de ambos os sexos pertencentes a uma espécie dificilmente seria possível. Assim, apenas casos de dimorfismo sexual fraco podem ser reconhecidos de forma confiável em espécies fósseis por meios estatísticos e sem encontrá-los em cópula. Isto sublinha a importância do comportamento de acasalamento identificado nas espécies fósseis para a descrição de tais casos de dimorfismo sexual forte. Tais achados preservados do acasalamento fóssil também podem aprovar a correlação de formas dimórficas sexualmente conhecidas anteriormente para pertencer a uma espécie, mesmo sem a possibilidade de muito apoio estatístico. Há alguma chance de que um evento de acasalamento preservado possa representar um acasalamento interespecífico ou intergenérico como estes são conhecidos das mariposas e borboletas (Ganyard e Brady, 1972; Deering and Scriber, 2002). Contudo, estes fenómenos são muito menos abundantes do que o acasalamento intra-específico e dificilmente podem ser encontrados como uma rara inclusão fóssil.
Um dimorfismo sexual não alométrico observado a partir de Forcepsites michalskii é a gálea separada na probóscide do macho. Isto pode sugerir um estado não-funcional, sendo que as imagens dos machos desta espécie não se alimentam, como visto em muitos Psychidae existentes (machos) com probóscide vestigial ou ausente (Scoble, 1995). Os dimorfismos sexuais alométricos aqui encontrados são: (1) A fêmea é maior que o macho, tanto no tamanho do corpo como no comprimento da asa. No entanto, as respectivas relações são quase as mesmas. (2) Na mulher, o abdômen é relativamente e absolutamente mais largo em comparação com o masculino. (3) As antenas do macho são muito maiores e mais grossas do que na fêmea imago. Em várias espécies de antenas existentes são sexualmente dimórficas (Scoble, 1995), as antenas masculinas bem desenvolvidas servem para a quimiossensação das feromonas femininas. (4) As palas maxilares do macho são duas vezes mais grossas que as da fêmea e têm uma estrutura nervurada. (5) Os olhos do macho também são maiores, mas o número de ommatideias é aproximadamente o mesmo. Os olhos maiores só receberão mais luz e poderão ser mais sensíveis; no entanto, a resolução seria a mesma.
O reconhecimento de longo alcance das traças que chamam traças femininas ocorre através de quimiorreceptores masculinos, enquanto o reconhecimento de curto alcance depende da identificação visual (Groot, 2014). Em Forcepsites michalskii, parece também que a fêmea foi o sexo chamador – como sugerido pelo maior aparelho antenal e olhos do macho.
Habitat
Baseado na discussão apresentada acima, fica claro que indivíduos capturados em cópula só podem ocorrer no local onde esta espécie viveu e acasalou. Indivíduos solteiros podem ser arrastados pelo vento ou visitar locais não habitados, como insectos aquáticos raramente encontrados no âmbar do Báltico (Wichardet al., 2009); para os indivíduos acasalados, em vez disso, isto dificilmente poderia ser o caso sem se separarem. Parece não haver evidência na literatura para o acasalamento de traças em voo. Em contraste, na maioria dos Lepidópteros e na maioria dos microlepidópteros noturnos (mariposas), as fêmeas “chamam” os machos por feromonas, determinando assim os locais de acasalamento (Groot, 2014). Podem estar voando antes de acasalar, mas na maioria dos casos parecem ser sésseis e fanning para distribuição de feromonas. Entretanto, os sexos que chamam ou procuram também podem ser invertidos em alguns taxa, mas para Tineidae a fêmea é reportada como sendo o sexo que chama (Wagner e Rosovsky, 1991; Scoble, 1995). Em qualquer caso, o local do fluxo de resina, ou seja, o biótopo com as árvores produtoras de âmbar, muito provavelmente foi também o habitat da traça de roupa aqui descrita.
CONCLUSÃO
Uma traça de tineoides com um notável aparelho genital masculino é descrita como a nova espécie e gênero Forcepsites michalskii do âmbar do Báltico Eoceno. Fêmea e macho são preservados juntos em posição próxima e com o abdômen orientado um para o outro, sugerindo que estas traças foram presas na resina fresca durante o acasalamento. Um forte fluxo laminar de resina, que é indicado por várias partes derivadas do corpo da fêmea, poderia tê-las afastado para a curta distância agora observada. Este espécime poderia, portanto, representar o primeiro exemplo de Lepidoptera fóssil capturado em cópula.
Supõe-se que o Forcepsites michalskii era uma espécie residente na floresta, uma vez que os indivíduos capturados em cópula só podem ser documentados a partir do local onde esta espécie viveu e acasalou.
Fêmea e macho de F. michalskii mostram dimorfismos sexuais no tamanho do corpo, comprimento das asas, proporção do abdômen, tamanho dos olhos compostos, e morfologia das palas maxilares, assim como das antenas. Baseado nas distintas antenas maiores e mais grossas do macho, bem como em seus olhos maiores, sugere-se que a fêmea poderia ser o sexo de chamada nesta espécie, como também relatado para as espécies Tineidae existentes.
ACKNOWLEDGMENTS
A. Michalski (Wroclaw, Polónia) é reconhecido por fornecer este espécime excepcional e por conduzir a nossa atenção para ele. M. Schwarz do Oberösterreichisches Landesmuseum (Linz, Áustria) gentilmente apoiou a triagem da sua coleção de Lepidoptera. MKH foi gentilmente financiado por uma bolsa do Studienstiftung des deutschen Volkes e agradece a S. Harzsch (Greifswald, Alemanha) pelo seu apoio. Agradecemos os valiosos comentários científicos de M. Heikkilä e C. Haug (Munique, Alemanha) sobre o manuscrito, assim como os comentários de J. Krieger (Greifswald, Alemanha) e o apoio de C. MacGraphery (Freising, Alemanha) e Y. Goldman (Collinsville, CT, EUA) para verificar o texto em inglês como falantes nativos. Além disso, agradecemos a dois revisores anônimos por seus comentários úteis.
Arillo, A. 2007. Paleoetologia: comportamentos fossilizados em âmbar. Geologica Acta, 5(2):159-166. https://doi.org/10.1344/105.000000301
Börner, C. 1925. Lepidoptera, Schmetterlinge, p. 358-387. Em Brohmer, P. (ed.). Fauna von Deutschland. Ein Bestimmungsbuch unserer heimischen Tierwelt. Quelle und Meyer, Leipzig.
Borkent, A. 1995. Biting Midges in the Cretaceous Amber of North America (Diptera: Ceratopogonidae). Backhuys Publishers, Leiden, The Netherlands.
Boucot, A.J. e Poinar Jr., G.O. 2010. Compêndio de Comportamento Fóssil. CRC Press, Boca Raton, p. 147-151.
Coty, D., Aria, C., Garrouste, R., Wils, P., Legendre, F. e Nel, A. 2014. A primeira sininclusão de formiga em âmbar com análise de tomografia computadorizada da taphonomia. PLOS um, 9(8):e104410. https://doi.org/10.1371/journal.pone.0104410
Deering, M.D. and Scriber, J.M. 2002. Bioensaios de campo mostram assimetria de preferência hetero-específica de acasalamento entre espécies de borboletas Papilio (Lepidoptera: Papilionidae) da América do Norte hibridizando. Journal of Ethology 20:25-33. https://doi.org/10.1007/s10164-002-0050-2
Fletcher, T.B. 1940. Novos nomes genéricos para microlepidópteros. Entomologist’s Record, 52:17-19.
Ganyard, M.C. and Brady, Jr.U.E. 1972. Atração Intersecífica em Lepidoptera no campo. Anais da Sociedade Entomológica da América, 65 (6): 1279-1282. https://doi.org/10.1093/aesa/65.6.1279
Gröhn, C. 2016. Inclusões no âmbar do Báltico. Wachholtz Verlag – Murmann Publishers, Kiel, Hamburg.
Groot, A.T. 2014. Ritmos circadianos de atividades sexuais em mariposas: Uma revisão. Frontiers in Ecology and Evolution 2:43. https://doi.org/10.3389/fevo.2014.00043
Hoffeins, C. and Hoffeins, H.W. 2003. Estudos sobre a abundância de inclusões no Báltico e Bitterfeld amber (Terciário, Eoceno) de colecções não seleccionadas com especial referência à ordem Diptera. Studia Dipterologica, 10(2):381-392.
Kozlov, M.V. 1987. Novo Lepidoptera parecido com uma mariposa do âmbar do Báltico. Paleontological Journal, 4:59-67.
Kozlov, M.V. 1988. Paleontologia de lepidópteros e problemas de filogenia da ordem Papilionida, p. 16-69. Em Ponomarenko A.G. (ed.), The Mesozoic-Cenozoic Crisis in the Evolution of Insects. Academia de Ciências, Moscou.
Krzeminska, E., Krzeminski, W., Haenni, J.-P., e Dufour, C. 1991. Les Fantomes De L’Ambre. Muséed’histoire naturelle de Neuchâtel, Neuchâtel, Suíça.
Kusnezov, N. 1941. Uma Revisão de Amber Lepidoptera. Instituto Paleontológico, Academia de Ciências da URSS, Moscou & Leningrado.
Latreille, P.A. 1810. Considerações gerais sobre a ordem natural dos animais que compõem as classes de crustáceos, aracnídeos e insetos: com uma tabela metódica de seus gêneros, disposta em famílias. Paris, Schoell.
Menken, S.B.J., Boomsma, J.J. e van Nieukerken, E.J. 2009. Padrões evolutivos em grande escala de associações de plantas hospedeiras na Lepidoptera. Evolução, 64(4):1098-1119. https://doi.org/10.1111/j.1558-5646.2009.00889.x
Rebel, H. 1934. Bernstein-Lepidopteren (aus der Sammlung Bachofen-Echt). Palaeobiologica, 6:1-16.
Rebel, H. 1935. Bernstein-Lepidopteren. Entomologische Zeitschrift Iris, 49:162-186.
Regier, J.C., Mitter, C., Davis, D.R., Harrison, T.L., Sohn J.-C., Cummings, M.P., Zwick, A., e Mitter, K.T. 2014. Uma filogenia molecular e uma classificação revista para as linhagens de traças mais antigas (Lepidoptera: Tineoidea), com implicações nos hábitos alimentares ancestrais da mega-diversa Ditrysia. Entomologia Sistemática, 40(2). https://doi.org/10.1111/syen.12110
Scoble, M.J. 1995. The Lepidoptera – Form, Function and Diversity. The Natural History Museum / Oxford University Press, Oxford.
Skalski, A.W. 1973. Estudos sobre o Lepidoptera a partir de resinas fósseis. Parte II. Epiborkhausenites obscurotrimaculatus gen. et sp. nov. (Oecophoridae) e uma Tineid-moth descoberta no âmbar do Báltico. Acta Palaeontologica Polonica, 18(1):153-160.
Skalski, A.W. 1974. Zwei neue Gattungen und Arten der Familie Tineidae aus dem Baltischen Bernstein. Studien an Lepidopteren aus fossilen Harzen V. Beiträge zur Entomologie, 1/4(24):97-104.
Skalski, A.W. 1977. Estudos sobre o Lepidoptera a partir de resinas fósseis. Parte I. Observações gerais e descrições de novos gêneros e espécies das famílias Tineidae e Oecophoridae do âmbar báltico. Prace Museum Ziemi, 26:3-24.
Sohn, J.-C., Labandeira, C., Davis, D., e Mitter, C. 2012. Um catálogo anotado de Lepidoptera (Insecta: Holometabola) fóssil e subfóssil do mundo. Zootaxa, 3286:1-132.
Sohn, J.-C. e Lamas, G. 2013. Correções, adições e notas nomenclaturais do catálogo mundial de Lepidoptera fóssil e subfóssil, recentemente publicado. Zootaxa, 3599:395-399.
Sontag, E. 2003. Inclusões de animais em uma amostra de âmbar báltico não selecionado. Acta Zoologica Cracoviensia, 46 (suppl.-Fossil Insects):431-440.
van Nieukerken, E.J., Kaila, L., Kitching, I.J., Kristensen, N.P., Lees, D.C., Minet, J., Mitter, C., Mutanen, M., Regier, J.C., Simonsen, T.J., Wahlberg, N., Yen, S.-H., Zahiri, R., Adamski, D., Baixeras, J., Bartsch, D., Bengtsson, B.Å., Brown, J.W., Bucheli, S.R., Davis, D.R., De Prins, J., De Prins, W., Epstein, M.E., Gentili-Poole, P., Gielis, C., Hätteschwiler, P., Hausmann, A., Holloway, J.D., Kallies, A., Karsholt, O., Kawahara, A.Y., Koster, S.J.C., Kozlov, M.V., Lafontaine, J.D., Lamas, G., Landry, J.-F., Lee, S., Nuss, M., Park, K.-T., Penz, C., Rota, J., Schintlmeister, A., Schmidt, B.C., Sohn, J.-C, Solis, M.A., Tarmann, G.M., Warren, A.D., Weller, S., Yakovlev, R.V., Zolotuhin, V.V., e Zwick, A. 2011. Ordem Lepidoptera Linnaeus, 1758. Em Zhang, Z.-Q. (ed.), Animal biodiversity: Um esboço de classificação de nível superior e levantamento da riqueza taxonómica. Zootaxa, 3148:212-221.
von Linné, C. 1758. traduzido por William Turton (1806). Volume 1. Um Sistema Geral da Natureza: Através dos Três Grandes Reinos de Animais, Vegetais e Minerais, Sistematicamente Divididos em suas Várias Classes, Ordens, Gêneros, Espécies, e Variedades. Lackington, Allen, and Co, London.
Wagner, D.L. e Rosovsky, J. 1991. Sistemas de acasalamento em Lepidoptera primitivo, com ênfase no comportamento reprodutivo de Korscheltellus gracilis (Hepialidae). Zoological Journal of the Linnean Society, 102:277-303. https://doi.org/10.1111/j.1096-3642.1991.tb00003.x
Weitschat, W. and Wichard, W. 2002. Atlas de Plantas e Animais em âmbar do Báltico. Verlag Friedrich Pfeil, München.
Weitschat, W. 2009. Jäger, Gejagte, Parasiten und blinde Passagiere – Momentaufnahmen aus dem Bernsteinwald. Denisia, 26(86):243-256.
Wichard, W., Gröhn, C., e Seredszus, F. 2009. Insectos aquáticos em âmbar do Báltico. Verlag Kessel, Remagen-Oberwinter.