- Motyle godowe (Tineidae, Ditrysia, Lepidoptera) zachowane jako mrożona inkluzja behawioralna w bursztynie bałtyckim (Eocen)
- ABSTRACT
- WPROWADZENIE
- MATERIAŁ I METODY
- PALAEONTOLOGIA SYSTEMATYCZNA
- DISCUSSION
- Random Co-occurrence or a Preserved Mating?
- Tafonomia
- Dymorfizm płciowy
- Siedlisko
- Podsumowanie
- PODZIĘKOWANIA
Motyle godowe (Tineidae, Ditrysia, Lepidoptera) zachowane jako mrożona inkluzja behawioralna w bursztynie bałtyckim (Eocen)
Thilo C. Fischer i Marie K. Hörnig
Numer artykułu: 22.1.7
https://doi.org/10.26879/829
Copyright Paleontological Society, February 2019
Biogramy autorów
Ambstrakty w języku polskim i wielojęzyczne
Wersja PDF
Submission: 22 Octobere 2017. Acceptance: 23 Januiary 2019
{flike id=2421}
ABSTRACT
Badanie inkluzji bursztynowych zapewnia unikalny wgląd w biologię zwierząt żyjących miliony lat temu, ze względu na ich wyjątkowe zachowanie w warunkach niemalże zbliżonych do naturalnych. Dotyczy to nie tylko aspektów morfologicznych, na podstawie tych skamieniałości można również wnioskować o aspektach behawioralnych.
Niniejszy artykuł przedstawia Microlepidoptera z eoceńskiego bursztynu bałtyckiego, najprawdopodobniej jako pierwsze wystąpienie kopalnych Lepidoptera znalezionych w kopule. Ćmy te należą do Tineidae (ćmy tineidalne obejmują ćmy odzieżowe) i zostały opisane jako nowy gatunek i nowy rodzaj, Forcepsites michalskii. Narząd czepny samca jest dość nietypowy dla ćm z bursztynu bałtyckiego, z częścią brzuszną i grzbietową, z których każda zakończona jest dwoma równoległymi, kolczastymi wypustkami i wydaje się nie być uformowana przez walwy. Współwystępowanie samca i samicy, najprawdopodobniej w kopule, pozwoliło na bezpośrednie badanie ich dymorfizmu płciowego, a ponadto istnieją dowody na to, że siedliskiem tego gatunku jest miejsce produkcji żywicy w bałtyckich lasach bursztynowych. Z dymorfizmu płciowego anten i morfologii oka wynika, że samica była u tego gatunku płcią wzywającą do godów.
Thilo C. Fischer. Förderverein der Bayerischen Staatssammlung für Paläontologie und Historische Geologie München Richard-Wagner-Straße 10, D-80333 München, Germany.
Marie K. Hörnig. University of Greifswald, Zoological Institute and Museum, Cytology and Evolutionary Biology, Soldmannstr. 23, D-17489 Greifswald, Germany.
KEYWORDS: Clothes moths; habitat in copula; Microlepidoptera; new species and genus; sexual dimorphism
Final citation: Fischer, Thilo C, and Hörnig, Marie K. 2019. Moths Mating (Tineidae, Ditrysia, Lepidoptera) preserved as frozen behavior inclusion in Baltic Amber (Eocene). Palaeontologia Electronica 22.1.7A 1-11. https://doi.org/10.26879/829
palaeo-electronica.org/content/2019/2421-mating-moths
Copyright: Luty 2019 Towarzystwo Paleontologiczne.
This is an open access article distributed under the terms of Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0), which allows users to copy and redistribute the material in any medium or format, provided it is not used for commercial purposes and the original author and source are credited, with indications if any changes are made.
creativecommons.org/licenses/by-nc-sa/4.0/
http://zoobank.org/BCF64D89-6879-4805-8021-7CE926CE4B12
WPROWADZENIE
Odkryte w bursztynie owady kopulujące rzadko występują jako przypadki tak zwanego „zamrożonego zachowania” (Arillo, 2007, i referencje tamże). Takie odnotowano z eoceńskiego bursztynu bałtyckiego, na przykład z grup Diptera, Coleoptera, Hemiptera, Hymenoptera i dość rzadko Trichoptera (Weitschat i Wichard, 2002; Weitschat, 2009; Boucot i Poinar Jr., 2010; Gröhn, 2016).
W bursztynie bałtyckim Lepidoptera są generalnie rzadkie i występują w ilości około jednej na 250 inkluzji (dla porównania: Dipterans stanowią około 64% wszystkich owadów w bursztynie bałtyckim, Lepidoptera około 0,4%; Hoffeins i Hoffeins 2003; Gröhn 2016). Podobnie jak u innych owadów, imagosy zachowane w copula są znacznie rzadsze, a Lepidoptera in copula nie zostały dotychczas opisane, nawet w innych bursztynach lub z innych niż bursztynowe stanowisk owadów (Sohn i in., 2012; Sohn i Lamas, 2013). Występowanie in copula umożliwia bona fide przynależność obu form płciowych do siebie nawzajem, a obu razem do odrębnego gatunku, a tym samym dokładny opis dymorfizmu płciowego gatunku. Alternatywnie, dymorfizm płciowy owadów kopalnych może być badany metodami statystycznymi tylko wtedy, gdy znaleziska danego gatunku są obfite, jak u wielu Nematocera (np., Borkent, 1995).
Tineidae są wysoce dywergencyjnymi bazalnymi przedstawicielami lepidopteranowej grupy Ditrysia (Regier i in., 2014), ich larwy odżywiają się szerokim spektrum substratów (detrytus, grzyby, porosty czy keratyna) (Scoble, 1995), stąd są generalistami (85,7%) (Menken i in., 2009). Jako inkluzje w bursztynie bałtyckim, Tineidae stanowią około jednej czwartej wszystkich znalezisk lepidoptera (Skalski, 1977). Opisano tu rzadki i nowy gatunek Tineidae wraz z jego formami płciowymi z przypuszczalnego miejsca występowania in copula.
MATERIAŁ I METODY
Okaz bursztynu został znaleziony i zakupiony od Artura Michalskiego (Wrocław, Polska). Został zakonserwowany lakierem akrylowym i pochodzi z kolekcji autora (TF) o numerze 7131. Przechowywany był w stałej temperaturze w plastikowych torebkach zaciskowych w metalowych skrzynkach, bez dostępu tlenu i światła. Zostanie on zdeponowany w Bayerische Paläontologische Staatssammlung München z numerem SNSB-BSPG 2017 I 113.
Okaz został sfotografowany aparatem Canon EOS 70d wyposażonym w obiektyw Canon MP-E 65 mm i lampę błyskową Canon Twin Flash MT-24. Aby uniknąć odbić, przed lampą błyskową i obiektywem aparatu zamontowano i wyregulowano filtry polaryzacyjne (światło spolaryzowane krzyżowo). W celu zmniejszenia wypukłości i wklęsłości powierzchni bursztynu nanoszono kroplę gliceryny i przykrywano szkiełkiem nakrywkowym. Zarejestrowane obrazy z-stacków były łączone za pomocą programu Combine ZP i poddawane dalszej obróbce w programie Adobe Photoshop CS 3. Inkluzja nie mogła być badana metodą mikrokomputerowo-tomograficzną, ze względu na obecność metalicznych, pozornie pirytowych inkluzji, które powodują silne artefakty.
PALAEONTOLOGIA SYSTEMATYCZNA
Systematyka (wg van Nieukerken i in., 2011)
Order LEPIDOPTERA Linnaeus, 1758
Clade DITRYSIA Börner, 1925
Nadrodzina TINEOIDEA Latreille, 1810
Rodzina TINEIDAE Latreille, 1810
Genus Forcepsites nov. gen.
zoobank.org/DDB6884D-845A-4A87-981E-A2953ADD8964
Etymology. „Forceps”, łac. forceps, odnoszące się do męskiego narządu czepnego.
Gatunek Forcepsites michalskii nov. spec.
zoobank.org/5494D58E-7773-473C-AFB2-140DD049226
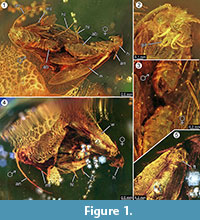 Holotyp. Specimen ex coll. Fischer no. 7131, Figure 1.2
Holotyp. Specimen ex coll. Fischer no. 7131, Figure 1.2
Locus typicus. Kopalnia bursztynu w Jantarni, GUS
Stratum typicum. „Blaue Erde” (górny eocen – dolny oligocen)
Etymologia. Nazwa gatunkowa michalskii została wybrana w celu podziękowania Arturowi Michalskiemu za dostarczenie tego okazu.
Repozytorium. Bayerische Staatssammlung für Paläontologie und Geologie, Monachium, Niemcy; numer akcesyjny SNSB-BSPG 2017 I 113.
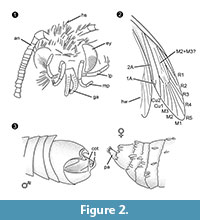
Diagnoza rodzaju. Rodzaj monotypowy z narządem czepnym samca (ryc. 2.3) z częścią brzuszną i grzbietową, z których każda zakończona jest dwoma równoległymi, kolczastymi wypustkami, jako cechą definiującą.
 Diagnoza gatunku. Określono odpowiednie cechy jakościowe i ilościowe imagos samicy i samca (Ryc. 1), które zestawiono w Tabeli 1.
Diagnoza gatunku. Określono odpowiednie cechy jakościowe i ilościowe imagos samicy i samca (Ryc. 1), które zestawiono w Tabeli 1.
Diagnoza różnicowa. Kombinacja cech mały proboscis z oddzielonymi galeae, długie i pofałdowane paliczki szczękowe z pięcioma segmentami, skierowane ku górze i lekko wygięte paliczki wargowe z bocznymi szczecinkami, głowa z wieloma wzniesionymi włoskowatymi łuskami silnie sugeruje przynależność do Tineidae, ale żadna z nich nie jest apomorficzna, nie jest też taka apomorfia obecnie znana u dorosłych Tineidae (Regier i in., 2014). Żyły R4 i R5 nie są zlepione / szypułkowe, co wskazywałoby na Gelechioidea (Gelechiidae i Oecophoridae) (Scoble, 1995), inną główną grupę Lepidoptera występującą w bursztynie bałtyckim. Gatunek ten jest niepodobny do żadnego z opisanych przedstawicieli Tineidae i innych rodzin z bursztynu bałtyckiego (Rebel, 1934, 1935; Kuznezov, 1941; Skalski, 1973; Kozlov, 1987, 1988; Sohn i in., 2012; Sohn i Lamas, 2013), zwłaszcza pod względem męskiego aparatu płciowego. Najbardziej podobna wydaje się Tineosemopsis decurtatus Skalski 1974 (samica znana), ale różni się brakiem wzniesionych włosów na wierzchołku i mniejszymi oczami. Tillyardinea eocaenica Kusnezov 1941 (samica), która ma wzniesione łuski na wierzchołku i podobną żyłkę, różni się przednią częścią ciała i paliczkami wargowymi. Simulotinea intermedia Skalski 1977 ma pokrój podobny, ale różni się także obecnością rozwidlonej żyłki, która dzieli dużą komórkę w skrzydle przednim (M2+3).
Tafonomia. Samiec i samica Forcepsites michalskii są skamieniałe obok siebie i z tylną częścią odwłoka skierowaną do siebie. Obie inkluzje znajdują się w cylindrycznym kawałku nie autoklawowanego bursztynu bałtyckiego o średnicy 15 mm i wysokości 11 mm, który w około połowie swojej wysokości przedzielony jest nierówną granicą między dwiema warstwami spływającej żywicy. Granica ta ukazuje warstwę pirytu jako część swojej płaszczyzny. Jeden strumień żywicy zawiera dwie ćmy odsłaniające swoje grzbietowe strony do tej granicy. Zachowane są długie łuski odchodzące od brzegu skrzydła samicy. Samica imago straciła dwie nogi, a jej tułów jest uszkodzony. Drugi przepływ zawiera nieliniowe serie pęcherzyków powietrza. Oba osobniki wydają się być świeżo wylęgłe, o czym świadczy kompletny zestaw łusek na skrzydłach i brak potarganych skrzydeł. Na skrzydłach, odwłoku i nogach nie udało się zidentyfikować narządów zapachowych. Jedyne syninkluzje zachowane z Microlepidoptera to trichomy, typowe dla bursztynu bałtyckiego.
DISCUSSION
Random Co-occurrence or a Preserved Mating?
Zamknięte ćmy są męskimi i żeńskimi przedstawicielami tego samego gatunku i są ułożone obok siebie z odwłokami skierowanymi do siebie. Narządy płciowe ćmy nie są jednak w bezpośrednim kontakcie, lecz w bliskiej pozycji. Orientacja grzbietowo-wentralna samca i samicy różni się nieznacznie, co jest spowodowane niewielką rotacją w obrębie osi ciała (zwłaszcza u samca). Orientacja tylnej części odwłoka obu ćm jest skierowana ku sobie.
Znanych jest kilka przypadków, w których sytuacja zamknięcia w jeszcze płynnej żywicy może wywołać reakcję stresową, taką jak owulacja (Weitschat, 2009). Indukcja zachowań godowych przez przepływ żywicy jest generalnie mało prawdopodobna, ale sytuacja zamknięcia pokazuje, że niewielkie ruchy w świeżej żywicy były możliwe.
Jest też pytanie, czy to odkrycie mogło reprezentować przypadkowe współwystępowanie. Prawdopodobieństwo takiego przypadkowego współwystępowania można w przybliżeniu oszacować. Wśród inkluzji owadzich ćmy występują z częstością około jednej na 250 inkluzji w bursztynie bałtyckim (Krzemińska i in., 1991 (0,6%); Hoffeins i Hoffeins, 2003 (0,4%); Sontag, 2003 (0,27%) oraz obserwacje własne). W przypadku pojedynczego bursztynu z inkluzją ćmy, szansa na przypadkowe współwystępowanie innej ćmy wynosi po prostu 1:250 (ćmy nie występują w rojach). Współwystępowanie tego samego taksonu, lub obfitego, który mógłby zostać pomylony, szacuje się w najlepszym przypadku na 1:10 (Skalski, 1977), a w przypadku posiadania różnych płci – na około 1:2. Biorąc pod uwagę dalsze szanse na bliskie ułożenie, zarówno wyrównanie osi ciała, jak i odpowiednią orientację ciała, prawdopodobieństwo przypadkowego współwystępowania, które mogłoby być mylnie zinterpretowane jako zdarzenie godowe, jest znacznie niższe niż obserwowana częstość jako jedna na 920 inkluzji lepidopterologicznych w badanym zbiorze autora.
W podsumowaniu, najbardziej prawdopodobną interpretacją tego znaleziska jest to, że ćmy były w kopulacji, a genitalia stykały się ze sobą, ale osobniki były od siebie nieco oddalone z powodu przepływu żywicy (patrz dyskusja poniżej).
Tafonomia
Ważność dokładnej analizy spływu żywicy dla taponomii inkluzji bursztynowych wykazali Coty et al. (2014) badając interakcję mrówka – termit zachowaną w meksykańskim bursztynie z Chiapas.
Za wystąpieniem zdarzenia in copula silnie przemawia znalezienie długich łusek pochodzących z brzegu skrzydła samicy, które dryfowały przez pewien dystans w kierunku samca. Mogłoby to wskazywać na silny laminarny przepływ żywicy w tym miejscu, który przemieszczał się wzdłuż ich wspólnej osi i mógł oddalić je od siebie na obserwowaną obecnie niewielką odległość. Podczas godów ćmy samiec może stracić kontakt z miejscem godów i może być przytwierdzony do samicy tylko przez narząd czepny, a samica może tylko stykać się z powierzchnią. Takie zachowanie oraz opór spowodowany nagłym wypływem żywicy może być powodem utraty obu tylnych odnóży przez samicę. Na grzbietowej stronie ćmy, która została odsłonięta na wypukłej powierzchni pierwszego laminarnego strumienia żywicy, skrzydło samicy i leżący pod nim tułów są częściowo uszkodzone (Rysunek 1.5). Przypuszczalnie te zniszczone obszary stanowią ślady żerowania innych owadów, najprawdopodobniej mrówek, co często obserwowano w okazach bursztynowych. Tak więc po pierwszym spływie żywicy jako zdarzeniu związanym z osadzaniem, strony grzbietowe były przez jakiś czas odsłonięte, wystarczająco długo, by drapieżniki mogły chodzić po tej litej powierzchni. Drugi strumień żywicy, który pokrył tę stronę później, mógł być szybkim i turbulentnym przepływem żywicy, na co wskazuje seria małych pęcherzyków ułożonych w nieregularne krzywe, znalezionych w jej obrębie. Byłby to typowy proces taphonomiczny dla tzw. „Schlaube” bursztynu bałtyckiego (Gröhn, 2016).
Dymorfizm płciowy
Dymorfizm płciowy jest trudny do zaobserwowania u gatunków kopalnych, z których znanych jest zwykle tylko kilka okazów. Cechy, na które płeć nie ma wpływu, muszą być diagnostyczne, aby umożliwić bezpieczne oznaczenie gatunku, jako podstawy do dalszego różnicowania płci i wyjaśnienia dymorfizmu płciowego. W przypadku silnie dymorficznych gatunków, np. z brachypterycznymi samicami, jak u wielu Psychidae (Scoble, 1995), wnioskowanie o przynależności obu płci do jednego gatunku byłoby prawie niemożliwe. Stąd tylko przypadki słabego dymorfizmu płciowego mogą być wiarygodnie rozpoznane u gatunków kopalnych za pomocą środków statystycznych i bez odnajdywania ich w kopulacjach. Podkreśla to znaczenie zidentyfikowanych zachowań godowych u gatunków kopalnych dla opisu takich przypadków silnego dymorfizmu płciowego. Takie zachowane znaleziska kopalnych kojarzeń mogą również zatwierdzić korelację wcześniej znanych form dymorficznych płciowo do jednego gatunku, nawet bez możliwości dużego wsparcia statystycznego. Istnieje pewna szansa, że zachowany przypadek krycia może reprezentować krycie międzygatunkowe lub międzyrodzajowe, jako że są one znane z ćm i motyli (Ganyard i Brady, 1972; Deering i Scriber, 2002). Zjawiska te są jednak znacznie mniej obfite niż kojarzenie wewnątrzgatunkowe i mało prawdopodobne, by można je było znaleźć jako rzadką kopalną inkluzję.
Nieallometrycznym dymorfizmem płciowym zaobserwowanym u Forcepsites michalskii jest oddzielone galeae w proboscisin u samca. Może to wskazywać na niefunkcjonalny stan, w którym samce tego gatunku nie są zdolne do żerowania, co zaobserwowano u wielu wymarłych (samców) Psychidae z niestałym lub nieobecnym proboscis (Scoble, 1995). Allometryczne dymorfizmy płciowe, jakie tu stwierdzono, to: (1) samica jest większa od samca, zarówno pod względem rozmiarów ciała, jak i długości skrzydeł. Jednak odpowiednie relacje są prawie takie same. (2) U samicy odwłok jest relatywnie i bezwzględnie szerszy w porównaniu do samca. (3) Antenki samca są znacznie większe i grubsze niż u samicy imago. U kilku wymarłych gatunków czułki są dymorficzne płciowo (Scoble, 1995), dobrze rozwinięte czułki samców służą do chemosensorycznego odbierania feromonów samic. (4) Paliczki szczękowe samca są dwa razy grubsze niż u samicy i mają strukturę żebrowaną. (5) Oczy samca są również większe, ale liczba ommatidiów jest mniej więcej taka sama. Większe oczy odbierają tylko więcej światła i mogą być bardziej wrażliwe, jednak rozdzielczość będzie taka sama.
Długodystansowe rozpoznawanie samic ćmy odbywa się poprzez chemoreceptory samca, podczas gdy rozpoznawanie krótkodystansowe opiera się na identyfikacji wizualnej (Groot, 2014). U Forcepsites michalskii wydaje się również, że to samica była płcią wołającą – co sugeruje większy aparat antenowy i oczy samca.
Siedlisko
Na podstawie dyskusji przedstawionej powyżej jasne jest, że osobniki złapane w kopulację mogą występować tylko w miejscu, gdzie ten gatunek żył i kopulował. Pojedyncze osobniki mogą być znoszone przez wiatr lub odwiedzać miejsca pozasiedliskowe, jak rzadko spotykane w bursztynie bałtyckim owady wodne (Wichardet i in., 2009), natomiast w przypadku osobników kopulujących raczej nie mogłoby się to odbyć bez ich rozdzielenia. Wydaje się, że w literaturze nie ma dowodów na kojarzenie się ćmy w locie. Natomiast u większości Lepidoptera i u przeważnie nocnych mikrolepidoptera (ćmy), samice „wołają” samców feromonami, wyznaczając w ten sposób miejsca godowe (Groot, 2014). Mogą one latać przed kryciem, ale w większości przypadków wydają się być osowiałe i wachlować w celu rozprowadzenia feromonów. Jednak płcie wołające lub szukające mogą być również odwrotne u niektórych taksonów, ale w przypadku Tineidae podaje się, że płeć żeńska jest płcią wołającą (Wagner i Rosovsky, 1991; Scoble, 1995). W każdym razie miejsce spływu żywicy, tj. biotop z drzewami wytwarzającymi bursztyn, najprawdopodobniej było również siedliskiem opisywanej tu ćmy ubraniowej.
Podsumowanie
Jako nowy gatunek i rodzaj Forcepsites michalskii z eoceńskiego bursztynu bałtyckiego opisano ćmę tineoidalną z niezwykłym męskim aparatem płciowym. Samica i samiec zachowały się razem w bliskiej pozycji i z odwłokiem skierowanym do siebie, co sugeruje, że ćmy te zostały uwięzione w świeżej żywicy podczas godów. Silny laminarny przepływ żywicy, na który wskazuje kilka znoszonych fragmentów ciała samicy, mógł odciągnąć je od siebie na tak niewielką odległość, jaką obecnie obserwujemy. Okaz ten może więc stanowić pierwszy przykład kopalnego Lepidoptera uchwyconego w kopule.
Przyjęto, że Forcepsites michalskii był gatunkiem zamieszkującym lasy, gdyż osobniki uchwycone w kopule można udokumentować tylko z miejsca, gdzie gatunek ten żył i kopulował.
Samice i samce F. michalskii wykazują dymorfizm płciowy w wielkości ciała, długości skrzydeł, proporcjach odwłoka, wielkości oczu złożonych i morfologii paliczków szczękowych, a także czułków. Na podstawie wyraźnie większych i grubszych czułków samca, jak również jego większych oczu, sugeruje się, że samica może być płcią wywołującą u tego gatunku, jak podawano również u wymarłych gatunków Tineidae.
PODZIĘKOWANIA
A. Michalski (Wrocław, Polska) jest wdzięczny za dostarczenie tego wyjątkowego okazu i zwrócenie na niego naszej uwagi. M. Schwarz z Oberösterreichisches Landesmuseum (Linz, Austria) udzielił nam uprzejmej zgody na przegląd ich kolekcji Lepidoptera. MKH był finansowany przez stypendium Studienstiftung des deutschen Volkes i dziękuje S. Harzschowi (Greifswald, Niemcy) za jego wsparcie. Dziękujemy za cenne uwagi naukowe M. Heikkilä i C. Haug (Monachium, Niemcy) dotyczące manuskryptu, jak również za komentarze J. Krieger (Greifswald, Niemcy) oraz wsparcie C. MacGraphery (Freising, Niemcy) i Y. Goldman (Collinsville, CT, USA) przy sprawdzaniu tekstu angielskiego jako rodzimych użytkowników języka. Furthermore, we thank two anonymous reviewers for their helpful comments.
Arillo, A. 2007. Paleoetologia: skamieniałe zachowania w bursztynie. Geologica Acta, 5(2):159-166. https://doi.org/10.1344/105.000000301
Börner, C. 1925. Lepidoptera, Schmetterlinge, s. 358-387. In Brohmer, P. (ed.). Fauna von Deutschland. Ein Bestimmungsbuch unserer heimischen Tierwelt. Quelle und Meyer, Leipzig.
Borkent, A. 1995. Biting Midges in the Cretaceous Amber of North America (Diptera: Ceratopogonidae). Backhuys Publishers, Leiden, The Netherlands.
Boucot, A.J. and Poinar Jr, G.O. 2010. Fossil Behavior Compendium. CRC Press, Boca Raton, s. 147-151.
Coty, D., Aria, C., Garrouste, R., Wils, P., Legendre, F. and Nel, A. 2014. The first ant-termite syninclusion in amber with CT-scan analysis of taphonomy. PLOS one, 9(8):e104410. https://doi.org/10.1371/journal.pone.0104410
Deering, M.D. and Scriber, J.M. 2002. Field bioassays show heterospecific mating preference asymmetry between hybridizing North American Papilio butterfly species (Lepidoptera: Papilionidae). Journal of Ethology 20:25-33. https://doi.org/10.1007/s10164-002-0050-2
Fletcher, T.B. 1940. New generic names for microlepidoptera. Entomologist’s Record, 52:17-19.
Ganyard, M.C. and Brady, Jr.U.E. 1972. Interspecific attraction in Lepidoptera in the field. Annals of the Entomological Society of America, 65 (6): 1279-1282. https://doi.org/10.1093/aesa/65.6.1279
Gröhn, C. 2016. Inkluzje w bursztynie bałtyckim. Wachholtz Verlag – Murmann Publishers, Kiel, Hamburg.
Groot, A.T. 2014. Circadian rhythms of sexual activities in moths: Przegląd. Frontiers in Ecology and Evolution 2:43. https://doi.org/10.3389/fevo.2014.00043
Hoffeins, C. i Hoffeins, H.W. 2003. Badania nad zasobnością inkluzji w bursztynie bałtyckim i bitterfeldzkim (trzeciorzęd, eocen) z nieselekcjonowanych kolekcji ze szczególnym uwzględnieniem rzędu Diptera. Studia Dipterologica, 10(2):381-392.
Kozlov, M.V. 1987. Nowe ćmopodobne Lepidoptera z bursztynu bałtyckiego. Paleontological Journal, 4:59-67.
Kozlov, M.V. 1988. Paleontologia lepidopterans i problemy filogenezy rzędu Papilionida, s. 16-69. In Ponomarenko A.G. (ed.), The Mesozoic-Cenozoic Crisis in the Evolution of Insects. Academy of Sciences, Moscow.
Krzemińska, E., Krzemiński, W., Haenni, J.-P., and Dufour, C. 1991. Les Fantomes De L’Ambre. Muséed’histoire naturelle de Neuchâtel, Neuchâtel, Switzerland.
Kusnezov, N. 1941. Rewizja bursztynowych Lepidoptera. Instytut Paleontologiczny, Akademia Nauk ZSRR, Moskwa & Leningrad.
Latreille, P.A. 1810. Ogólne rozważania na temat naturalnego porządku zwierząt tworzących klasy skorupiaków, pajęczaków i owadów: z tablicą metodyczną ich rodzajów, ułożonych w rodziny. Paris, Schoell.
Menken, S.B.J., Boomsma, J.J. and van Nieukerken, E.J. 2009. Wielkoskalowe wzorce ewolucyjne związków roślin żywicielskich u Lepidoptera. Evolution, 64(4):1098-1119. https://doi.org/10.1111/j.1558-5646.2009.00889.x
Rebel, H. 1934. Bernstein-Lepidopteren (aus der Sammlung Bachofen-Echt). Palaeobiologica, 6:1-16.
Rebel, H. 1935. Bernstein-Lepidopteren. Entomologische Zeitschrift Iris, 49:162-186.
Regier, J.C., Mitter, C., Davis, D.R., Harrison, T.L., Sohn J.-C., Cummings, M.P., Zwick, A., and Mitter, K.T. 2014. A molecular phylogeny and revised classification for the oldest ditrysian moth lineages (Lepidoptera: Tineoidea), with implications for ancestral feeding habits of the mega-diverse Ditrysia. Systematic Entomology, 40(2). https://doi.org/10.1111/syen.12110
Scoble, M.J. 1995. The Lepidoptera – Form, Function and Diversity (Lepidoptera – forma, funkcja i różnorodność). The Natural History Museum / Oxford University Press, Oxford.
Skalski, A.W. 1973. Studia nad Lepidoptera z żywic kopalnych. Część II. Epiborkhausenites obscurotrimaculatus gen. et sp. nov. (Oecophoridae) oraz ćma z gatunku Tineid odkryta w bursztynie bałtyckim. Acta Palaeontologica Polonica, 18(1):153-160.
Skalski, A.W. 1974. Zwei neue Gattungen und Arten der Familie Tineidae aus dem Baltischen Bernstein. Studien an Lepidopteren aus fossilen Harzen V. Beiträge zur Entomologie, 1/4(24):97-104.
Skalski, A.W. 1977. Studia nad Lepidoptera z żywic kopalnych. Część I. Uwagi ogólne oraz opisy nowych rodzajów i gatunków z rodzin Tineidae i Oecophoridae z bursztynu bałtyckiego. Prace Muzeum Ziemi, 26:3-24.
Sohn, J.-C., Labandeira, C., Davis, D., and Mitter, C. 2012. An annotated catalog of fossil and subfossil Lepidoptera (Insecta: Holometabola) of the world. Zootaxa, 3286:1-132.
Sohn, J.-C. and Lamas, G. 2013. Corrections, additions, and nomenclatural notes to the recently published world catalog of fossil and subfossil Lepidoptera. Zootaxa, 3599:395-399.
Sontag, E. 2003. Inkluzje zwierzęce w próbce nieselekcjonowanego bursztynu bałtyckiego. Acta Zoologica Cracoviensia, 46 (suppl.-Fossil Insects):431-440.
van Nieukerken, E.J., Kaila, L., Kitching, I.J., Kristensen, N.P., Lees, D.C., Minet, J., Mitter, C., Mutanen, M., Regier, J.C., Simonsen, T.J., Wahlberg, N., Yen, S.-H., Zahiri, R., Adamski, D., Baixeras, J., Bartsch, D., Bengtsson, B.Å., Brown, J.W., Bucheli, S.R., Davis, D.R., De Prins, J., De Prins, W., Epstein, M.E., Gentili-Poole, P., Gielis, C., Hätteschwiler, P., Hausmann, A., Holloway, J.D., Kallies, A., Karsholt, O., Kawahara, A.Y., Koster, S.J.C., Kozlov, M.V., Lafontaine, J.D., Lamas, G., Landry, J.-F., Lee, S., Nuss, M., Park, K.-T., Penz, C., Rota, J., Schintlmeister, A., Schmidt, B.C., Sohn, J.-C., Solis, M.A., Tarmann, G.M., Warren, A.D., Weller, S., Yakovlev, R.V., Zolotuhin, V.V., and Zwick, A. 2011. Order Lepidoptera Linnaeus, 1758. In Zhang, Z.-Q. (red.), Animal biodiversity: An outline of higher-level classification and survey of taxonomic richness. Zootaxa, 3148:212-221.
von Linné, C. 1758. translated by William Turton (1806). Tom 1. A General System of Nature: Through the Three Grand Kingdoms of Animals, Vegetables, and Minerals, Systematically Divided into their Several Classes, Orders, Genera, Species, and Varieties. Lackington, Allen, and Co, London.
Wagner, D.L. i Rosovsky, J. 1991. Mating systems in primitive Lepidoptera, with emphasis on the reproductive behaviour of Korscheltellus gracilis (Hepialidae). Zoological Journal of the Linnean Society, 102:277-303. https://doi.org/10.1111/j.1096-3642.1991.tb00003.x
Weitschat, W. i Wichard, W. 2002. Atlas roślin i zwierząt w bursztynie bałtyckim. Verlag Friedrich Pfeil, München.
Weitschat, W. 2009. Jäger, Gejagte, Parasiten und blinde Passagiere – Momentaufnahmen aus dem Bernsteinwald. Denisia, 26(86):243-256.
Wichard, W., Gröhn, C., and Seredszus, F. 2009. Owady wodne w bursztynie bałtyckim. Verlag Kessel, Remagen-Oberwinter.