- Papillons de nuit reproducteurs (Tineidae, Ditrysia, Lepidoptera) conservés sous forme d’inclusion de comportement congelé dans l’ambre baltique (Eocène)
- ABSTRACT
- INTRODUCTION
- MATERIELS ET METHODES
- PALAÉONTOLOGIE SYSTÉMATIQUE
- DISCUSSION
- Cooccurrence aléatoire ou accouplement préservé ?
- Taphonomie
- Dimorphisme sexuel
- Habitat
- CONCLUSION
- ACKNOWLEDGMENTS
Papillons de nuit reproducteurs (Tineidae, Ditrysia, Lepidoptera) conservés sous forme d’inclusion de comportement congelé dans l’ambre baltique (Eocène)
Thilo C. Fischer et Marie K. Hörnig
Numéro d’article : 22.1.7
https://doi.org/10.26879/829
Copyright Paleontological Society, février 2019
Biographies des auteurs
Résumés en langue claire et en plusieurs langues
Version PDF
Soumission : 22 octobere 2017. Acceptation : 23 Januiary 2019
{flike id=2421}
ABSTRACT
L’étude des inclusions d’ambre fournit un aperçu unique de la biologie des animaux vivant il y a des millions d’années, en raison de leur préservation exceptionnelle dans des conditions presque similaires à celles de la vie. Ceci n’est pas seulement vrai pour les aspects morphologiques, des aspects du comportement peuvent également être déduits de ces fossiles.
Ici, des Microlepidoptères sont rapportés de l’ambre balte éocène très probablement comme une première occurrence de Lépidoptères fossiles trouvés dans la copule. Les papillons de nuit appartiennent à Tineidae (les papillons de nuit tineid incluent les mites de vêtements) et sont décrits comme une nouvelle espèce et un nouveau genre, Forcepsites michalskii. L’organe de préhension du mâle est assez inhabituel pour les papillons de l’ambre baltique, avec une partie ventrale et une partie dorsale, chacune se terminant par deux protubérances parallèles, semblables à des épines, et ne semblant pas être formée par les valvules. La co-occurrence du mâle et de la femelle, très probablement en copule, a permis d’étudier directement leur dimorphisme sexuel, et il y a des preuves que l’habitat de cette espèce est le site de production de résine dans la forêt d’ambre baltique. A partir du dimorphisme sexuel des antennes et de la morphologie des yeux, il est interprété que la femelle était le sexe appelant pour l’accouplement chez cette espèce.
Thilo C. Fischer. Förderverein der Bayerischen Staatssammlung für Paläontologie und Historische Geologie München Richard-Wagner-Straße 10, D-80333 München, Allemagne.
Marie K. Hörnig. Université de Greifswald, Institut et musée zoologiques, Cytologie et biologie évolutive, Soldmannstr. 23, D-17489 Greifswald, Allemagne.
MOTS CLÉS : Teignes ; habitat dans la copule ; Microlépidoptères ; nouvelles espèces et nouveaux genres ; dimorphisme sexuel
Citation finale : Fischer, Thilo C, et Hörnig, Marie K. 2019. Les papillons de nuit qui s’accouplent (Tineidae, Ditrysia, Lepidoptera) préservés comme inclusion de comportement congelé dans l’ambre baltique (Éocène). Palaeontologia Electronica 22.1.7A 1-11. https://doi.org/10.26879/829
palaeo-electronica.org/content/2019/2421-mating-moths
Copyright: Février 2019 Société de paléontologie.
C’est un article en accès libre distribué selon les termes de l’Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0), qui permet aux utilisateurs de copier et de redistribuer le matériel dans n’importe quel support ou format, à condition qu’il ne soit pas utilisé à des fins commerciales et que l’auteur original et la source soient crédités, avec des indications si des modifications sont apportées.
creativecommons.org/licenses/by-nc-sa/4.0/
http://zoobank.org/BCF64D89-6879-4805-8021-7CE926CE4B12
INTRODUCTION
Les insectes reproducteurs sont rarement trouvés dans l’ambre comme des cas de ce que l’on appelle le « comportement gelé » (Arillo, 2007, et ses références). De tels insectes ont été signalés dans l’ambre baltique éocène, par exemple dans les groupes des Diptères, des Coléoptères, des Hémiptères, des Hyménoptères et assez rarement des Trichoptères (Weitschat et Wichard, 2002 ; Weitschat, 2009 ; Boucot et Poinar Jr., 2010 ; Gröhn, 2016).
Dans l’ambre baltique, les Lépidoptères sont généralement rares et se rencontrent à environ une inclusion sur 250 (pour comparaison : Les diptères représentent environ 64 % de tous les insectes dans l’ambre balte, les lépidoptères représentent environ 0,4 % ; Hoffeins et Hoffeins 2003 ; Gröhn 2016). Comme chez les autres insectes, les imagos préservées in copula sont beaucoup plus rares et les Lépidoptères in copula n’ont pas encore été décrits, pas même dans d’autres ambres ou à partir de localités d’insectes non ambrées (Sohn et al., 2012 ; Sohn et Lamas, 2013). Une occurrence in copula permet de rattacher de bonne foi les deux formes sexuelles l’une à l’autre et les deux ensemble à une espèce distincte, et donc la description exacte du dimorphisme sexuel d’une espèce. Alternativement, le dimorphisme sexuel des insectes fossiles ne peut être étudié par des moyens statistiques que lorsque les découvertes d’une espèce sont abondantes comme chez de nombreux Nématocères (par ex, Borkent, 1995).
Les Tineidae sont des représentants basaux très divergents du groupe des lépidoptères Ditrysia (Regier et al., 2014), leurs larves se nourrissent d’une large gamme de substrats (détritus, champignons, lichens ou kératine) (Scoble, 1995), donc sont généralistes (85,7%) (Menken et al., 2009). En tant qu’inclusions d’ambre baltique, les Tineidae représentent environ un quart de toutes les découvertes de lépidoptères (Skalski, 1977). Ici, une espèce rare et nouvelle de Tineidae est décrite avec ses formes sexuelles provenant d’une occurrence in copula putative.
MATERIELS ET METHODES
Le spécimen d’ambre a été trouvé par et acheté à Artur Michalski (Wroclaw, Pologne). Il a été conservé par traitement avec un vernis acrylique et provient de la collection de l’auteur (TF) avec le numéro de collection 7131. Il a été conservé à température constante dans des sacs à pince en plastique à l’intérieur de boîtes métalliques, à l’abri de l’oxygène et de la lumière. Il sera déposé à la Bayerische Paläontologische Staatssammlung München sous le numéro SNSB-BSPG 2017 I 113.
Le spécimen a été photographié avec un Canon EOS 70d équipé d’un objectif Canon MP-E 65 mm et d’un Canon Twin Flash MT-24. Pour éviter les réflexions, des filtres de polarisation ont été montés et ajustés devant les flashs et l’objectif de l’appareil photo (lumière à polarisation croisée). Pour réduire la convexité et les concavités de la surface de l’ambre, une goutte de glycérine a été appliquée et recouverte d’une lamelle. Les piles z des images enregistrées ont été fusionnées avec Combine ZP et traitées ensuite avec Adobe Photoshop CS 3. L’inclusion n’a pas pu être étudiée par micro-tomographie, en raison de la présence d’inclusions métalliques, apparemment pyritiques, qui provoquent de forts artefacts.
PALAÉONTOLOGIE SYSTÉMATIQUE
Systématique (selon van Nieukerken et al, 2011)
Ordre LEPIDOPTERA Linnaeus, 1758
Clade DITRYSIA Börner, 1925
Superfamille TINEOIDEA Latreille, 1810
Famille TINEIDAE Latreille, 1810
Genus Forcepsites nov. gen.
zoobank.org/DDB6884D-845A-4A87-981E-A2953ADD8964
Etymology. « Forceps », latin pour forceps, en référence à l’organe de préhension mâle.
Espèce Forcepsites michalskii nov. spec.
zoobank.org/5494D58E-7773-473C-AFB2-140DDD049226
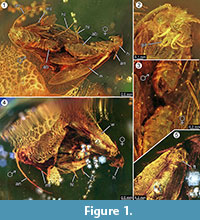 Holotypus. Spécimen ex coll. Fischer no. 7131, figure 1.2
Holotypus. Spécimen ex coll. Fischer no. 7131, figure 1.2
Locus typicus. Mine d’ambre de Yantarni, GUS
Stratum typicum. « Blaue Erde » (Eocène supérieur – Oligocène inférieur)
Etymologie. Le nom d’espèce michalskii est choisi pour reconnaître Artur Michalski pour avoir fourni ce spécimen.
Dépôt. Bayerische Staatssammlung für Paläontologie und Geologie, Munich, Allemagne ; numéro d’accession SNSB-BSPG 2017 I 113.
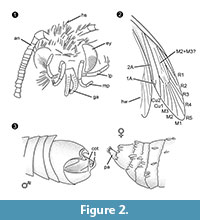
Diagnostic du genre. Genre monotypique dont le caractère déterminant est l’organe de préhension du mâle (figure 2.3) avec une partie ventrale et une partie dorsale, chacune se terminant par deux protubérances parallèles, semblables à des épines.
 Diagnostic de l’espèce. Les caractères qualitatifs et quantitatifs respectifs des imagos femelles et mâles (figure 1) ont été déterminés et sont résumés dans le tableau 1.
Diagnostic de l’espèce. Les caractères qualitatifs et quantitatifs respectifs des imagos femelles et mâles (figure 1) ont été déterminés et sont résumés dans le tableau 1.
Diagnostic différentiel. La combinaison de caractères petit proboscis avec des galéas séparés, palpes maxillaires longs et pliés avec cinq segments, palpes labiaux pointant vers le haut et légèrement pliés avec des soies latérales, tête avec de nombreuses écailles dressées ressemblant à des poils suggèrent fortement une affiliation à Tineidae, mais aucun d’entre eux n’est apomorphe, et une telle apomorphie n’est pas non plus connue actuellement pour les Tineidae adultes (Regier et al., 2014). Les veines R4 et R5 ne sont pas fusionnées / pédonculées, ce qui serait indicatif pour les Gelechioidea (Gelechiidae et Oecophoridae) (Scoble, 1995), l’autre grand groupe de Lépidoptères trouvé dans l’ambre baltique. L’espèce ne ressemble à aucun représentant décrit des Tineidae ou d’autres familles dans l’ambre balte (Rebel, 1934, 1935 ; Kuznezov, 1941 ; Skalski, 1973 ; Kozlov, 1987, 1988 ; Sohn et al., 2012 ; Sohn et Lamas, 2013), surtout en ce qui concerne son appareil génital mâle. Le plus similaire semble Tineosemopsis decurtatus Skalski 1974 (femelle connue) mais diffère par l’absence de poils dressés au vertex et ses yeux plus petits. Tillyardinea eocaenica Kusnezov 1941 (femelle), qui a des écailles érigées au vertex et une nervation similaire, diffère par ses frons et ses palpes labiaux. Simulotinea intermedia Skalski 1977 a un habitus similaire mais diffère également par la présence d’une veine bifurquée, qui divise la grande cellule de l’aile antérieure (M2+3).
Taphonomie. Le mâle et la femelle de Forcepsites michalskii sont fossilisés à proximité et avec la partie postérieure de l’abdomen dirigée l’un vers l’autre. Les deux inclusions se trouvent dans un morceau cylindrique d’ambre baltique non autoclavé d’un diamètre de 15 mm et d’une hauteur de 11 mm qui est divisé à environ la moitié de sa hauteur par une bordure inégale entre deux couches d’écoulement de résine. Cette bordure présente une couche de pyrite qui fait partie de son plan. Une coulée de résine contient les deux papillons qui exposent leur face dorsale respective à cette bordure. De longues écailles dérivant du bord de l’aile de la femelle sont préservées. L’imago femelle a perdu deux pattes, et son thorax est endommagé. L’autre flux contient des séries non linéaires de bulles. Les deux individus semblent avoir émergé récemment, comme en témoigne la vesture complète d’écailles sur les ailes et le fait que les ailes ne sont pas en lambeaux. Aucun organe olfactif n’a pu être identifié sur les ailes, l’abdomen ou les pattes. Les seules syninclusions conservées avec les microlépidoptères sont des trichomes, typiques de l’ambre baltique.
DISCUSSION
Cooccurrence aléatoire ou accouplement préservé ?
Les papillons de nuit enfermés sont des représentants mâles et femelles de la même espèce et sont disposés à proximité avec les abdominaux orientés l’un vers l’autre. Pourtant, les organes génitaux des papillons de nuit ne sont pas en contact direct, mais dans une position proche. L’orientation dorsale/ventrale du mâle et de la femelle diffère légèrement, ce qui est dû à une légère rotation dans l’axe du corps (surtout chez le mâle). L’orientation de la partie postérieure de l’abdomen des deux papillons est l’une vers l’autre.
Il existe plusieurs cas connus, où la situation d’enfermement dans la résine encore liquide peut induire une réponse de stress, comme la ponte (Weitschat, 2009). L’induction d’un comportement d’accouplement par le flux de résine n’est généralement pas plausible, mais la situation d’enfermement démontre que de légers mouvements dans la résine fraîche étaient possibles.
Il y a aussi la question de savoir si cette découverte pourrait aussi représenter une cooccurrence aléatoire. La probabilité d’une telle cooccurrence aléatoire peut être estimée grossièrement. Parmi les inclusions d’insectes, les mites sont présentes avec une fréquence d’environ une inclusion sur 250 dans l’ambre balte (Krzeminskaet al., 1991 (0,6%) ; Hoffeins et Hoffeins, 2003 (0,4%) ; Sontag, 2003 (0,27%), et ma propre observation). Si l’on considère un ambre individuel avec une inclusion de papillon de nuit, la probabilité de cooccurrence aléatoire d’un autre papillon de nuit est simplement de 1:250 (les papillons de nuit ne se produisent pas en essaim). La cooccurrence du même taxon, ou d’un taxon abondant qui pourrait être confondu, est estimée à 1:10 au mieux (Skalski, 1977), et à environ 1:2 pour des sexes différents. Si l’on considère les chances supplémentaires d’une disposition proche, à la fois d’un alignement des axes du corps et d’une orientation corporelle appropriée, une probabilité pour une cooccurrence aléatoire qui pourrait être interprétée à tort comme un événement d’accouplement est bien inférieure à la fréquence observée comme une sur 920 inclusions de lépidoptères dans la collection de l’auteur étudié.
En conclusion, l’interprétation la plus probable de cette constatation est que les papillons de nuit étaient en copula, et que les organes génitaux avaient été en contact mais que les individus étaient légèrement distraits les uns des autres en raison de l’écoulement de la résine (voir discussion ci-dessous).
Taphonomie
La pertinence d’une analyse minutieuse des flux de résine pour la taphonomie des inclusions d’ambre a été démontrée par Coty et al. (2014) avec leur étude d’une interaction fourmi – termite préservée dans l’ambre mexicain du Chiapas.
L’occurrence d’un événement in copula est fortement soutenue par la découverte de longues écailles dérivées du bord de l’aile de la femelle, qui ont dérivé sur une certaine distance en direction du mâle. Cela pourrait indiquer un fort flux de résine laminaire à cet endroit qui s’est déplacé le long de leur axe commun, et qui aurait pu les éloigner sur la courte distance observée maintenant. Pendant l’accouplement des papillons de nuit, le mâle peut perdre le contact avec le site d’accouplement et peut n’être fixé à la femelle que par l’organe d’agrippement, la femelle étant seule à entrer en contact avec la surface. Ce comportement et la résistance à l’écoulement soudain de la résine pourraient être la raison pour laquelle la femelle a perdu ses deux pattes arrière. Sur la face dorsale des papillons, qui a été exposée à la surface convexe de ce premier flux de résine laminaire, l’aile de la femelle et son thorax sous-jacent sont partiellement endommagés (figure 1.5). On peut supposer que ces zones détruites représentent des traces d’alimentation causées par d’autres insectes, très probablement des fourmis, comme on l’observe souvent dans les spécimens d’ambre. Ainsi, après la première coulée de résine, les faces dorsales ont été exposées pendant un certain temps, suffisamment longtemps pour permettre aux prédateurs de marcher sur cette surface solide. Le deuxième flux de résine, qui a recouvert cette face plus tard, pourrait avoir été un flux de résine rapide et turbulent, comme l’indique la série de petites bulles disposées en courbes irrégulières que l’on y trouve. Il s’agirait d’un processus taphonomique typique pour un soi-disant « Schlaube » d’ambre baltique (Gröhn, 2016).
Dimorphisme sexuel
Le dimorphisme sexuel est difficile à observer chez les espèces fossiles, dont on ne connaît généralement que quelques spécimens. Les caractères qui ne sont pas influencés par le sexe doivent être diagnostiqués pour permettre une détermination sûre de l’espèce comme base pour la différenciation ultérieure entre les sexes et l’élucidation du dimorphisme sexuel. Si l’on considère des espèces existantes très dimorphiques sexuellement, par exemple avec des femelles brachyptères comme chez de nombreux Psychidae (Scoble, 1995), il serait difficile de conclure que les deux sexes appartiennent à une seule espèce. Par conséquent, seuls les cas de dimorphisme sexuel faible peuvent être reconnus de manière fiable dans les espèces fossiles par des moyens statistiques et sans les trouver dans la copule. Ceci souligne l’importance de l’identification du comportement d’accouplement chez les espèces fossiles pour la description de tels cas de dimorphisme sexuel fort. De tels résultats préservés d’accouplement fossile peuvent également approuver la corrélation de formes sexuellement dimorphiques précédemment connues pour appartenir à une seule espèce, même sans la possibilité d’un soutien statistique important. Il existe une certaine chance qu’un événement d’accouplement préservé puisse représenter un accouplement interspécifique ou intergénérique, comme cela est connu chez les papillons de nuit et les papillons diurnes (Ganyard et Brady, 1972 ; Deering et Scriber, 2002). Cependant, ces phénomènes sont beaucoup moins abondants que l’accouplement intraspécifique et il est peu probable qu’on les trouve sous forme d’inclusion fossile rare.
Un dimorphisme sexuel non allométrique observé chez Forcepsites michalskii est la séparation des galéas dans le proboscisdu mâle. Cela peut faire allusion à un état non fonctionnel, avec des imagos mâles de cette espèce qui ne se nourrissent pas, comme on le voit chez de nombreux Psychidae (mâles) existants avec un proboscis vestigial ou absent (Scoble, 1995). Les dimorphismes sexuels allométriques trouvés ici sont : (1) La femelle est plus grande que le mâle, tant pour la taille du corps que pour la longueur des ailes. Cependant, les rapports respectifs sont presque les mêmes. (2) Chez la femelle, l’abdomen est relativement et absolument plus large par rapport au mâle. (3) Les antennes du mâle sont beaucoup plus grandes et plus épaisses que chez l’imago femelle. Chez plusieurs espèces existantes, les antennes sont sexuellement dimorphiques (Scoble, 1995), les antennes mâles bien développées servent à la chimiosensation des phéromones femelles. (4) Les palpes maxillaires du mâle sont deux fois plus épais que chez la femelle et ont une structure nervurée. (5) Les yeux du mâle sont également plus grands mais le nombre d’ommatidies est à peu près le même. Des yeux plus grands ne recevront que plus de lumière et pourraient être plus sensibles ; cependant, la résolution serait la même.
La reconnaissance à longue portée des papillons femelles appelantes se fait via les chimiorécepteurs des mâles alors que la reconnaissance à courte portée repose plutôt sur l’identification visuelle (Groot, 2014). Chez Forcepsites michalskii, il semble également que la femelle était le sexe appelant -comme le suggère l’appareil antennaire et les yeux plus grands du mâle.
Habitat
Sur la base de la discussion présentée ci-dessus, il est clair que les individus pris dans la copule ne peuvent se produire que dans le lieu où cette espèce a vécu et s’est accouplée. Les individus isolés peuvent être emportés par le vent ou visiter des sites sans habitat, comme les insectes aquatiques rarement trouvés dans l’ambre de la Baltique (Wichardet al., 2009) ; pour les individus s’accouplant plutôt, cela pourrait difficilement être le cas sans être séparés. Il ne semble pas y avoir de preuve dans la littérature de l’accouplement des papillons de nuit en vol. En revanche, chez la plupart des lépidoptères et chez les microlépidoptères (papillons de nuit) à prédominance nocturne, les femelles » appellent » les mâles par des phéromones, déterminant ainsi les lieux d’accouplement (Groot, 2014). Elles peuvent être en vol avant l’accouplement mais dans la plupart des cas, elles semblent être sessiles et en éventail pour la distribution des phéromones. Cependant, les sexes qui appellent ou cherchent peuvent aussi être inversés chez certains taxons, mais pour les Tineidae, la femelle serait le sexe appelant (Wagner et Rosovsky, 1991 ; Scoble, 1995). En tout cas, le site d’écoulement de la résine, c’est-à-dire le biotope avec les arbres producteurs d’ambre, était très probablement aussi l’habitat de la teigne décrite ici.
CONCLUSION
Un papillon de nuit tinéoïde avec un appareil génital mâle remarquable est décrit comme la nouvelle espèce et le genre Forcepsites michalskii de l’ambre baltique éocène. La femelle et le mâle sont préservés ensemble en position rapprochée et avec l’abdomen orienté l’un vers l’autre, ce qui suggère que ces papillons ont été piégés dans la résine fraîche pendant l’accouplement. Un fort flux laminaire de résine, qui est indiqué par plusieurs parties dérivées du corps de la femelle, aurait pu les séparer sur la courte distance observée maintenant. Ce spécimen pourrait donc représenter le premier exemple de Lépidoptère fossile capturé dans la copule.
On suppose que Forcepsites michalskii était une espèce forestière, car les individus capturés dans la copule ne peuvent être documentés qu’à partir du lieu où cette espèce vivait et s’accouplait.
Les femelles et les mâles de F. michalskii présentent des dimorphismes sexuels dans la taille du corps, la longueur des ailes, la proportion de l’abdomen, la taille des yeux composés, et la morphologie des palpes maxillaires, ainsi que des antennes. Sur la base des antennes distinctes plus grandes et plus épaisses du mâle, ainsi que de ses yeux plus grands, il est suggéré que la femelle pourrait être le sexe appelant chez cette espèce, comme cela a également été rapporté pour les espèces de Tineidae existantes.
ACKNOWLEDGMENTS
A. Michalski (Wroclaw, Pologne) est remercié pour avoir fourni ce spécimen exceptionnel et attiré notre attention sur lui. M. Schwarz du Oberösterreichisches Landesmuseum (Linz, Autriche) a aimablement soutenu le dépistage de leur collection de lépidoptères. MKH a bénéficié d’une bourse de la Studienstiftung des deutschen Volkes et remercie S. Harzsch (Greifswald, Allemagne) pour son soutien. Nous reconnaissons les précieux commentaires scientifiques de M. Heikkilä et C. Haug (Munich, Allemagne) sur le manuscrit, ainsi que les commentaires de J. Krieger (Greifswald, Allemagne) et le soutien de C. MacGraphery (Freising, Allemagne) et Y. Goldman (Collinsville, CT, US) pour la vérification du texte anglais en tant que locuteurs natifs. En outre, nous remercions deux réviseurs anonymes pour leurs commentaires utiles.
Arillo, A. 2007. Paléoéthologie : des comportements fossilisés dans l’ambre. Geologica Acta, 5(2):159-166. https://doi.org/10.1344/105.000000301
Börner, C. 1925. Les lépidoptères, Schmetterlinge, p. 358-387. Dans Brohmer, P. (ed.). Fauna von Deutschland. Ein Bestimmungsbuch unserer heimischen Tierwelt. Quelle und Meyer, Leipzig.
Borkent, A. 1995. Les moucherons piqueurs dans l’ambre crétacé d’Amérique du Nord (Diptera : Ceratopogonidae). Backhuys Publishers, Leiden, Pays-Bas.
Boucot, A.J. et Poinar Jr, G.O. 2010. Compendium des comportements fossiles. CRC Press, Boca Raton, p. 147-151.
Coty, D., Aria, C., Garrouste, R., Wils, P., Legendre, F. et Nel, A. 2014. La première syninclusion d’ant-termites dans l’ambre avec une analyse CT-scan de la taphonomie. PLOS one, 9(8):e104410. https://doi.org/10.1371/journal.pone.0104410
Deering, M.D. et Scriber, J.M. 2002. Field bioassays show heterospecific mating preference asymmetry between hybridizing North American Papilio butterfly species (Lepidoptera : Papilionidae). Journal of Ethology 20:25-33. https://doi.org/10.1007/s10164-002-0050-2
Fletcher, T.B. 1940. Nouveaux noms génériques pour les microlépidoptères. Entomologist’s Record, 52:17-19.
Ganyard, M.C. et Brady, Jr.U.E. 1972. Attraction interspécifique chez les lépidoptères sur le terrain. Annals of the Entomological Society of America, 65 (6) : 1279-1282. https://doi.org/10.1093/aesa/65.6.1279
Gröhn, C. 2016. Les inclusions dans l’ambre de la Baltique. Wachholtz Verlag – Murmann Publishers, Kiel, Hambourg.
Groot, A.T. 2014. Rythmes circadiens des activités sexuelles chez les papillons de nuit : A review. Frontiers in Ecology and Evolution 2:43. https://doi.org/10.3389/fevo.2014.00043
Hoffeins, C. and Hoffeins, H.W. 2003. Etudes sur la fréquence des inclusions dans l’ambre de la Baltique et de Bitterfeld (Tertiaire, Eocène) à partir de collections non sélectionnées, avec une attention particulière pour l’ordre des diptères. Studia Dipterologica, 10(2):381-392.
Kozlov, M.V. 1987. New moth-like Lepidoptera from the Baltic amber. Paleontological Journal, 4:59-67.
Kozlov, M.V. 1988. Paleontology of lepidopterans and problems of the phylogeny of the order Papilionida, p. 16-69. In Ponomarenko A.G. (ed.), The Mesozoic-Cenozoic Crisis in the Evolution of Insects. Academy of Sciences, Moscow.
Krzeminska, E., Krzeminski, W., Haenni, J.-P., and Dufour, C. 1991. Les Fantomes De L’Ambre. Muséed’histoire naturelle de Neuchâtel, Neuchâtel, Suisse.
Kusnezov, N. 1941. A Revision of Amber Lepidoptera. Paleontological Institute, USSR Academy of Sciences, Moscow & Leningrad.
Latreille, P.A. 1810. Considérations générales sur l’ordre naturel des animaux composant les classes des crustacés, des arachnides, et des insectes: avec un tableau méthodique de leurs genres, disposés en familles. Paris, Schoell.
Menken, S.B.J., Boomsma, J.J. and van Nieukerken, E.J. 2009. Large-scale evolutionary patterns of host plant associations in the Lepidoptera. Evolution, 64(4):1098-1119. https://doi.org/10.1111/j.1558-5646.2009.00889.x
Rebel, H. 1934. Bernstein-Lepidopteren (aus der Sammlung Bachofen-Echt). Palaeobiologica, 6:1-16.
Rebel, H. 1935. Bernstein-Lepidopteren. Entomologische Zeitschrift Iris, 49:162-186.
Regier, J.C., Mitter, C., Davis, D.R., Harrison, T.L., Sohn J.-C., Cummings, M.P., Zwick, A., et Mitter, K.T. 2014. Une phylogénie moléculaire et une classification révisée pour les plus anciennes lignées de papillons de nuit ditrysiens (Lepidoptera : Tineoidea), avec des implications pour les habitudes alimentaires ancestrales du méga-divers Ditrysia. Entomologie systématique, 40(2). https://doi.org/10.1111/syen.12110
Scoble, M.J. 1995. Les lépidoptères – forme, fonction et diversité. The Natural History Museum / Oxford University Press, Oxford.
Skalski, A.W. 1973. Études sur les lépidoptères à partir de résines fossiles. Part II. Epiborkhausenites obscurotrimaculatus gen. et sp. nov. (Oecophoridae) et un Tineid-moth découvert dans l’ambre baltique. Acta Palaeontologica Polonica, 18(1):153-160.
Skalski, A.W. 1974. Zwei neue Gattungen und Arten der Familie Tineidae aus dem Baltischen Bernstein. Studien an Lepidopteren aus fossilen Harzen V. Beiträge zur Entomologie, 1/4(24):97-104.
Skalski, A.W. 1977. Études sur les lépidoptères à partir de résines fossiles. Partie I. Remarques générales et descriptions de nouveaux genres et espèces des familles Tineidae et Oecophoridae provenant de l’ambre baltique. Prace Museum Ziemi, 26:3-24.
Sohn, J.-C., Labandeira, C., Davis, D., et Mitter, C. 2012. Un catalogue annoté des lépidoptères fossiles et subfossiles (Insecta : Holometabola) du monde. Zootaxa, 3286:1-132.
Sohn, J.-C. et Lamas, G. 2013. Corrections, ajouts et notes nomenclaturales au catalogue mondial des Lépidoptères fossiles et subfossiles récemment publié. Zootaxa, 3599:395-399.
Sontag, E. 2003. Inclusions animales dans un échantillon d’ambre balte non sélectionné. Acta Zoologica Cracoviensia, 46 (suppl.-Fossil Insects):431-440.
van Nieukerken, E.J., Kaila, L., Kitching, I.J., Kristensen, N.P., Lees, D.C., Minet, J., Mitter, C., Mutanen, M., Regier, J.C., Simonsen, T.J., Wahlberg, N., Yen, S.-H., Zahiri, R., Adamski, D., Baixeras, J., Bartsch, D., Bengtsson, B.Å., Brown, J.W., Bucheli, S.R., Davis, D.R., De Prins, J., De Prins, W., Epstein, M.E., Gentili-Poole, P., Gielis, C., Hätteschwiler, P., Hausmann, A., Holloway, J.D., Kallies, A., Karsholt, O., Kawahara, A.Y., Koster, S.J.C., Kozlov, M.V., Lafontaine, J.D., Lamas, G., Landry, J.-F., Lee, S., Nuss, M., Park, K.-T., Penz, C., Rota, J., Schintlmeister, A., Schmidt, B.C., Sohn, J.-C, Solis, M.A., Tarmann, G.M., Warren, A.D., Weller, S., Yakovlev, R.V., Zolotuhin, V.V., et Zwick, A. 2011. Ordre Lepidoptera Linnaeus, 1758. Dans Zhang, Z.-Q. (ed.), Animal biodiversity : An outline of higher-level classification and survey of taxonomic richness. Zootaxa, 3148:212-221.
von Linné, C. 1758. traduit par William Turton (1806). Volume 1. Un système général de la nature : À travers les trois grands royaumes des animaux, des végétaux et des minéraux, systématiquement divisés en leurs différentes classes, ordres, genres, espèces et variétés. Lackington, Allen, and Co, Londres.
Wagner, D.L. et Rosovsky, J. 1991. Les systèmes d’accouplement chez les lépidoptères primitifs, en mettant l’accent sur le comportement reproducteur de Korscheltellus gracilis (Hepialidae). Journal zoologique de la société linnéenne, 102:277-303. https://doi.org/10.1111/j.1096-3642.1991.tb00003.x
Weitschat, W. et Wichard, W. 2002. Atlas des plantes et des animaux dans l’ambre baltique. Verlag Friedrich Pfeil, München.
Weitschat, W. 2009. Jäger, Gejagte, Parasiten und blinde Passagiere – Momentaufnahmen aus dem Bernsteinwald. Denisia, 26(86):243-256.
Wichard, W., Gröhn, C., et Seredszus, F. 2009. Insectes aquatiques de l’ambre baltique. Verlag Kessel, Remagen-Oberwinter.