Evaluering av den visuella banan kan vara avgörande för att diagnostisera och hantera många tillstånd.
av Kristie Draskovic, OD, och John J. McSoley, OD
- Uppsättningsdatum:
- Utgångsdatum:
- Målbeskrivning:
- Fakultet/redaktion:
- Krediteringsförklaring:
- Samsponsringsförklaring:
- Offentliggörande:
- Fall 1. Hypofysmakroadenom
- Tabell 1. Optiska neuropatier som ofta upptäcks med testning av synfältet
- Fall 2 till exempel. Multipel skleros
- Fall 3. Paracentrisk glaukomdefekt
- Tabell 2. Kriterier för glaukomatös synfältsdefekt med hög specificitet och känslighet13,14
- Tabell 3. Förslag till bedömning av progression
Uppsättningsdatum:
mars 2016
Utgångsdatum:
mars 1, 2019
Målbeskrivning:
Undersökning av synfältet med hjälp av automatiserad perimetri kan hjälpa kliniker att utvärdera lesioner som påverkar synbanan, fastställa baslinjer och screena för vissa läkemedelsinducerade optiska neuropatier. Det kan också hjälpa till att övervaka progression eller återkomst av sjukdomar, vägleda behandlingsbeslut och hjälpa till att lokalisera lesioner. Den här artikeln kommer att hjälpa kliniker att bättre förstå och tolka synfält vid glaukomatösa och icke-glaukomatösa sjukdomsprocesser.
Fakultet/redaktion:
Kristie Draskovic, OD, och John J. McSoley, OD
Krediteringsförklaring:
Denna kurs är COPE-godkänd för 2 timmars CE-kredit. COPE ID är 48599-GL. Kontrollera din statliga licensnämnd för att se om detta godkännande räknas mot ditt CE-krav för relicensure.
Samsponsringsförklaring:
Denna fortbildningskurs är samsponsrad av Pennsylvania College of Optometry.
Offentliggörande:
Dr Draskovic och McSoley har inga ekonomiska relationer att redovisa.
Att undersöka synfältet är viktigt när man överväger potentiell synförlust till följd av tillstånd som påverkar synbanan. Automatiserad standardperimetri är ett användbart verktyg för att identifiera och följa många neurologiska tillstånd, liksom glaukom och misstänkta glaukomfall. Det finns för närvarande flera apparater tillgängliga, men i följande diskussion kommer användningen av Humphrey Field Analyzer (HFA, Zeiss) att tas upp som ett exempel.
Anatomi och fysiologi
På grund av synbanans anatomi kan kliniker upptäcka problemområden vid många tillstånd som orsakar synnedsättning (figur 1). Eftersom ljus som färdas från det temporala synfältet faller på den nasala näthinnan ses retinala lesioner i den exakt motsatta kvadranten av synfältet. Alla prechiasmala lesioner, inklusive de på näthinnan och synnerven, ger upphov till defekter som är isolerade till det drabbade ögat.1
Då nasala fibrer är ansvariga för det temporala synfältet kommer en lesion vid det optiska chiasmet att resultera i en synfältsdefekt som påverkar det temporala fältet på båda ögonen och ger upphov till den klassiska bitemporala hemianopsin, som respekterar den vertikala medellinjen.1 Lesioner i det optiska chiasmet kan vara resultatet av hypofysära adenom, suprasellära meningiom, kraniopharyngiom eller aneurysm. I vissa fall kan synfältsdefekter återgå efter behandling av orsaken.2
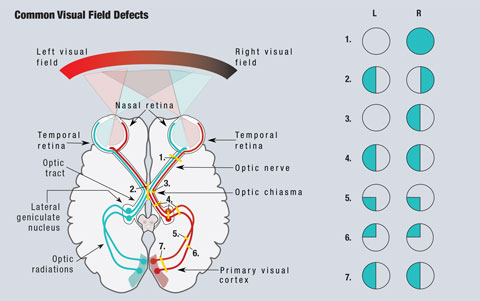
Klicka på bilden för att förstora den. Fig. 1. En förenklad schematisk bild av den visuella banan visas. Lesioner som avbryter synbanan leder till synfältsdefekter. (1) En fullständig skada på höger synnerv leder till fullständig förlust av det högra synfältet. (2) En lesion i mitten av det optiska chiasmet leder till en bitemporal hemianopsi. (3) En lesion av de okorsade fibrerna i den högra synnerven vid det optiska chiasmet leder till en nasal hemianopsi i det högra ögat. (4) En fullständig lesion av den högra optiska banan, den laterala genikulära kärnan eller de optiska radiationerna leder till en fullständig homonym hemianopsi på vänster sida. (5) En lesion av höger övre optiska radiationer resulterar i en vänster inferior quadranopsi. (6) En lesion vid de högra nedre optiska radiationerna orsakar en vänster överlägsen quadranopsi. (7) En lesion av både de övre och nedre högra optiska radiationerna orsakar en vänster homonym hemianopsi. Illustration av Miquel Perello Nieto.
Fibrer som ansvarar för synfältet till höger om mittlinjen finns på vänster sida av hjärnan och vice versa. Som ett resultat av denna korsning orsakar alla postchiasmala lesioner, inklusive lesioner av synnerven och optiska radiationer, en homonym hemianopsi.1 Dessa defekter finns på samma sida av synfältet i varje öga och respekterar den vertikala mittlinjen. När defekterna endast ses superior eller inferior kallas det för en quadranopsi. Vid ofullständiga hemianopsidefekter är främre lesioner vanligtvis mer inkongruenta, medan bakre lesioner kommer att vara mer kongruenta mellan de två ögonen.1
Glaukomatös synfältsförlust representerar skador på axonerna som färdas längs det retinala nervfiberlagret och följer vanligen ett bågformigt mönster till synnerven. Skador på dessa axoner ger upphov till lokaliserade synfältsdefekter, oftast bågformiga scotom, nasala steg och paracentrala scotom. Ett normalt synfält sträcker sig längst temporalt till 90 grader, 70 grader både över- och underifrån och 60 grader nasalt och från fixering. Den mest värdefulla informationen för neurologiska brister och hantering av glaukom erhålls inom 30 grader från fixering.2
Teststrategi
Automatiserad statisk perimetri – och tröskelperimetri i synnerhet – presenterar ett stimulus av fast storlek men med varierande intensitet. Känsligheten för de olika testplatserna registreras utifrån patientens svar på dessa stimuli. Ett stimulus i storlek III (som är 4 mm2 när det projiceras på en 30 cm stor skål) används vanligen i klinisk praxis.
Det finns olika tröskeltestmönster tillgängliga. Testmönstret 30-2 testar 76 platser inom 30 grader från fixering, medan ett 24-2 testmönster testar 54 platser som tar bort ringen av punkter vid 30 grader (utom de två punkter som sträcker sig över den horisontella meridianen nasalt). Dessa mest perifera punkter är mer utsatta för variabilitet, och 24-2 förkortar testtiden genom att ta bort dessa perifera punkter från testet. Avståndet mellan testpunkterna är sex grader.
Det 10-2 testmönstret är dessutom inriktat på 64 punkter inom 10 grader från fixeringen som är separerade med två grader. Detta alternativ är att föredra när centrala eller paracentrala defekter uppstår med 24-2 och 30-2 eller när fältet blir så trångt att de perifera punkterna inte är kliniskt användbara. Kliniker kan också välja att öka stimulusstorleken till V, vilket kan ge högre känslighetsvärden och ett större dynamiskt område genom vilket man kan följa patienterna för förändring. För närvarande finns det dock ingen algoritm för test av SITA-typ, och det finns inte heller någon tillgänglig jämförelse med en normativ databas eller progressionsanalys.
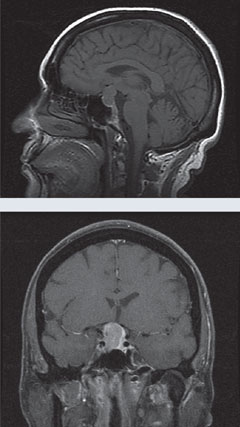
Fall 1. HypofysmakroadenomEn patient presenterades för konsultation i samband med atypiskt, progressivt normalspänningsglaukom. |
|
|

|
|
|
| Efter att patienten genomgick transsfenoidal kirurgi för att avlägsna sellarmassan visar synfältet, ovan, att synfältsdefekten i det högra ögat har förbättrats och att defekten i det vänstra ögat har upphört. Klicka på bilden för att förstora den. | |
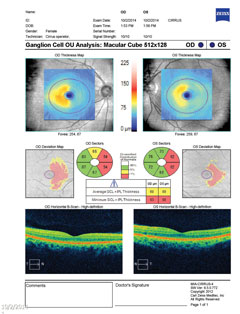
| Ovan avslöjar gangliecellskomplexet nasal gallring i båda ögonen, vilket korrelerar med den temporala synfältsförlusten. Klicka på bilden för att förstora. | |
Nyligen genomförda studier visar att 10-2 synfält kan vara användbart för att identifiera mer än avancerat glaukom.3,4 En studie avslöjade att en del glaukom-patienter hade betydande centrala klusterdefekter som sågs vid 10-2 testmönster trots normalt centralt 30-2 synfält.4 Studien tyder på att glaukomatös försämring av det centrala synfältet, på grund av dålig rumslig sampling, inte kunde fångas upp enbart av 30-2 testrutan och att det krävdes en tätare uppskattning av de centrala 10 graderna.4 Studien tyder också på att en ändring av det konventionella testmönstret för synfältet skulle kunna förbättra upptäckten av tidiga glaukomatösa defekter i de centrala 10 graderna.4
I den dagliga praktiken utför läkare ofta 10-2-fält när små centrala eller paracentrala scotomas uppträder vid 30-2- och 24-2-testning, eller när man misstänker att synskärpan är nedsatt eller hotar att bli nedsatt till följd av fältförlust. Ett 10-2 testmönster kan också vara ett användbart komplement när det finns en hög intertestvariabilitet av paracentrala punkter på ett 24-2 mönster. Den ökande uppmärksamheten på gangliecellsfunktionen i makulaområdet kan också öka uppmärksamheten på det område av synfältet som testas med 10-2-mönstret.
Trovärdighet
Indikationer på tillförlitligheten av synfältsresultatet inkluderar fixeringsförluster och både falskt positiva och falskt negativa svar.
Tabell 1. Optiska neuropatier som ofta upptäcks med testning av synfältet |
|
| Idiopatisk intrakraniell hypertension | För tidigt: förstorad blind fläck Sent: (kan förbättras med behandling) |
| 0ptisk neurit | – Diffus synfältsförlust (i nästan hälften av fallen) – Annat: Andra: Altitudinal defekt, centrala eller cecocentrala scotomas, bågformiga eller dubbla bågformiga defekter och hemianopiska defekter5,7 |
| Non-arteritisk främre ischemisk optisk neuropati | – Altitudinal defekter som respekterar den horisontella medellinjen är vanligast – Andra: Andra: Det är vanligast med altitudinal defekter som respekterar den horisontella medellinjen: Centrala scotom, bågformiga defekter och quadranopsior5,8 |
| Posterior ischemisk optisk neuropati | – Centralt fältdefekt5,9 |
| Hereditära optiska neuropatier – Lebers hereditära optiska neuropati – Dominant optisk atrofi |
– Cecocentral och central synfältsförlust5 |
| Optiska nervhuvudets drusensvulster | – Kan efterlikna ett glaukomatiskt mönster |
| Thyroid oftalmopati | – Stor variabilitet – Kan delvis eller helt försvinna efter behandling2 |
| Medicinskt inducerad toxisk optisk neuropati | – Etambutol (för behandling av tuberkulos) toxicitet kan orsaka centrala scotom och, mer sällan perifer konstriktion och altitudinella defekter5 – Vigabatrin (ett antiepileptiskt läkemedel), kan orsaka fältdefekter som börjar som bilaterala nasala defekter och senare utvecklas till koncentriska fältdefekter medan det centrala fältet förblir intakt12 |
Fixering kan övervakas genom att regelbundet presentera ett stimulus i den fysiologiska blindspotten (Heijl-Krakau-metoden) eller genom att övervaka positionen för den korneala ljusreflexen. På HFA indikerar uppåtriktad avböjning förändring i position eller fixering; nedåtriktad avböjning indikerar att den korneala ljusreflexen inte kan lokaliseras, t.ex. vid en förändring av huvudets eller ögonlockets position.
Falskt positiva resultat uppstår när en patient reagerar vid en tidpunkt då det inte finns något associerat stimulus eller när ett svar inte är fysiologiskt möjligt. Patienter med höga falska positiva värden beskrivs ofta som ”trigger happy”. Detta kan avslöja ett synfält som verkar känsligare eller mer normalt än förväntat eller kan leda till onormalt höga tröskelkänslighetsvärden.
Falskt negativa resultat uppstår när en patient inte reagerar på ett stimulus som är ljusare än ett som redan har setts eller när svaret inte stämmer överens med mönstret av svar i det området. Det falskt negativa värdet kan vara en indikation på tillförlitlighet eller en återspegling av sjukdomsprocessen. Onormala regioner i synfältet är förknippade med större variabilitet inom och mellan testerna. Därför ingår inte områden i synfältet med låg känslighet i beräkningen av det falskt negativa värdet.
Tröskelkänsligheten är rådata med värden registrerade i decibel. Siffrorna anger graden av dämpning från högsta möjliga stimulus. Värden
Den totala avvikelsen representerar avvikelsen från förväntade värden baserat på den åldersmatchade normala databasen. Mönsteravvikelsen korrigerar för fältets totala känslighet genom att ta bort generaliserade nedtryckningar (t.ex. från grå starr) för att identifiera eventuella områden med lokaliserade avvikelser. Både total- och mönsteravvikelse har tillhörande sannolikhetsvärden (p) som beräknas utifrån fördelningen inom en normalpopulation. Normalvärdesintervallet är bredare perifert än centralt. P-symbolerna anger frekvensen av att det testade värdet förekommer i en normal åldersmatchad population. Avvikelser visas på kartan om det testade tröskelvärdet är sämre än de nedersta 5 % av det normala för den åldern.2 Om p
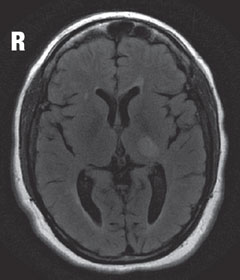
Fall 2 till exempel. Multipel sklerosEn patient med diagnosen multipel skleros (MS) presenterade sig med synförlust. |
|
|
 |
| Ovanför, i MRT, avslöjar T2 flair axialvyn en fokal hyperintensiv lesion strax posteriort till den vänstra laterala genikulära kärnan i thalamus, som är ansvarig för synfältsdefekten som ses. Läsionen som ses, liksom andra multipla hyperintensiva lesioner, är typiska kännetecken för demyelinativ sjukdom som MS. | |
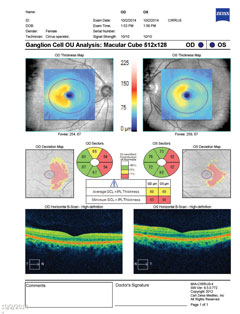
|
|
| Ovanför visar synfältet en ofullständig höger homonym hemianopi. Klicka på bilden för att förstora. Till vänster visar gangliecellsanalysen nasal gallring på höger öga och temporal gallring på vänster öga, vilket stämmer överens med fynden i synfältet. Klicka på bilden för att förstora. |
|
Mönsterstandardavvikelse (PSD) är en viktad standardavvikelse från det förväntade värdet baserat på åldersjämförda normalvärden och medelavvikelseindex (MD). PSD avslöjar avståndet mellan olika punkter inom fältet. PSD är känslig för både tidiga och fokala glaukomdefekter. Ett lågt PSD-värde kan ses med normala synfält, ett synfält som är jämnt nedtryckt eller ett helt blint fält. Ett tillhörande p-värde är sannolikheten för att värdet ska förekomma.
MD är ett viktat medelvärde av värdena i den numeriska plotten för den totala avvikelsen. MD kan påverkas av en diffus minskning av den totala känsligheten eller av en lokaliserad defekt. En MD på 0 indikerar ett normalt värde, medan ett negativt värde representerar avvikelse eller förlust från den normala databasen. Medelavvikelse väger centrala punkter tyngre.
Visusfältsindex (VFI) är en annan ålderskorrigerad bedömning, uttryckt i procent, där perimetriskt normal är 100 % och perimetriskt blind är 0 %. Vid beräkning av VFI viktas centrala punkter starkare än perifera punkter. Det ger en poäng för ett individuellt synfält och används vid analys av progression.2
Glaucoma hemifield test (GHT) jämför den relativa känsligheten av mönsteravvikelsevärdena för fem zoner i det övre och undre hemifältet. Var och en av dessa zoner jämförs med sin spegelzon i det motsatta hemifältet, och båda zonerna jämförs med den normativa databasen. GHT kan upptäcka glaukomatös synfältsförlust med hög sensitivitet och hög specificitet genom fem möjliga kategorier: utanför de normala gränserna, gränsfall, allmän minskning av sensitiviteten, onormalt hög sensitivitet och inom de normala gränserna.
Tolkning
Att fastställa ett tillförlitligt baseline synfält är avgörande för glaukombehandling och framtida övervakning av eventuell progression. Kliniker bör erhålla minst två reproducerbara baslinje synfält för att upptäcka mindre steg av förändring. För att känna igen progression, särskilt efter upptrappning av behandlingen vid tidpunkter för progression, måste klinikern fastställa en ny baslinje.
Fall 3. Paracentrisk glaukomdefekt
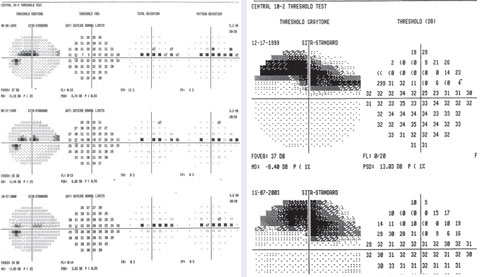
Ett exempel på variabla punkter i överlägset paracentralt skotom på 24-2 med en fokal djup defekt på 10-2.
Visusfält som gjorts före den aktuella medicinska eller kirurgiska behandlingen, eller under en längre period av att ha gått förlorad för att följas upp efter behandling, bör inte användas för att fastställa progression. Kliniker bör använda de nya baslinjen för synfält som utförs efter dessa behandlingsförändringar och alla synfält därefter för att bedöma progression.
En tillförlitlig och representativ baslinje är också viktig för program för analys av progression. Synfälten tenderar att ha högre variabilitet med mer excentrisk placering och känslighet i mitten av intervallet, och långsiktiga fluktuationer gör det svårare att bedöma progression. Känslighetspunkter på mellannivå tenderar att vara varierande, medan testvärden i övre och lägre känslighetsområden är mer stabila. Att etablera ett tillförlitligt, reproducerbart baslinjevisuellt fält kan bidra till att undanröja en del av dessa utmaningar.
Non-glaukomatösa optiska neuropatier
Visusfält kan hjälpa till att utvärdera lesioner som påverkar synbanan, fastställa baslinjer och fungera som screeningverktyg för vissa läkemedel som förknippas med optiska neuropatier. De kan också övervaka progression eller återkomst av sjukdomar samtidigt som de hjälper till att vägleda behandlingsbeslut och även hjälpa till att lokalisera lesioner.5 Den vanligaste synfältsmanifestationen av en icke-glaukomatös optisk neuropati är en central defekt. Ju större scotomet är, desto större är sannolikheten att synskärpan är nedsatt (tabell 1).
Retinalsjukdom
Visusfältsdefekter orsakade av näthinnesjukdom tenderar att ha väldefinierade, skarpa gränser som verkar djupare än de flesta glaukomdefekter med mindre variabilitet.2 Vanliga tillstånd som påverkar makulaområdet, t.ex. åldersrelaterad makuladegeneration och central serös chorioretinopati, kan ge upphov till centrala scotom som kan ses på 10-2 samt vissa 24-2 och 30-2 tester, beroende på skadans omfattning.
Retinitis pigmentosa ger upphov till perifera synfältsdefekter som kan leda till tunnelseende med endast en central ö vid avancerad sjukdom.
Arteriella ocklusioner visar vanligtvis absoluta områden med defekt medan venösa ocklusioner kan vara mer ytliga och diffusa.2 Dessa förekommer ofta tillsammans med glaukom, vilket gör tolkningen mer utmanande.
Chorioretinit, eller associerade ärr, kan maskera glaukomatösa defekter med en bågformad eller kilformad defekt. En näthinneavlossning ger upphov till en relativ defekt medan retinoschisis ger en absolut defekt. Dessa tillstånd är ofta mycket mer perifera än vad som skulle framträda vid konventionell central testning med 24-2 eller 30-2.
Glaukomdefekter
En defekt kan vara en generaliserad eller lokaliserad sänkning av känsligheten jämfört med den normaliserade databasen. Generella depressioner ses oftast vid grå starr, men kan också uppstå vid okorrigerat brytningsfel eller mios. Lokaliserade defekter kan beskrivas ytterligare genom storlek, djup och plats för att underlätta diagnosen. En relativ defekt uppstår när känsligheten är mindre än normalt, eller kan vara nedsatt i förhållande till andra områden i synfältet, men synen kvarstår. En absolut defekt är när stimulus presenteras vid maximal ljusstyrka och inte ses.
Glaukomatös synfältsförlust kan först uppträda i det nasala eller i det bågformiga området (Bjerrumområdet). Dessa defekter kan sträcka sig från den blinda fläcken, runt makularegionen och avslutas abrupt vid den horisontella meridianen nasalt. Tidiga glaukomatösa defekter är ofta lokaliserade relativa scotom (tabell 2).
En betydande test-retestvariabilitet är kännetecknande för synfältsområden som påverkas av glaukomatös synfältsförlust. Variabla känslighetsminskningar som uppträder i samma område, men inte alltid i samma testpunktslägen, föregår ofta konsekventa glaukomatösa synfältsdefekter.2 Variabilitet, som ses med falskt negativa resultat, kan indikera tillförlitlighet, men större mängder variabilitet ses ofta på grund av själva sjukdomen.
Tabell 2. Kriterier för glaukomatös synfältsdefekt med hög specificitet och känslighet13,14
- Kluster av tre eller fler icke-kantpunkter på mönsteravvikelsen med p
- GHT utanför de normala gränserna på två på varandra följande fält
- PSD
- Asymmetri av MD >1.50dB som kan upprepas och vid klinisk misstanke15,16
När synfälten är opålitliga bör de upprepas för att fastställa baslinjer, bekräfta en defekt eller bekräfta misstänkt progression. Vanligtvis upprepas inte synfälten samma dag på grund av patientens trötthet, vilket kan påverka tillförlitligheten. Det är sällan brådskande att upprepa synfältet omedelbart, eftersom glaukom i allmänhet är en långsamt progredierande optisk neuropati och behandlingsbeslut styrs av förändringshastigheten.2 Varje praktik bör standardisera en önskad teststrategi och ett önskat testmönster och upprepa samma test för att möjliggöra noggrannare jämförelser vid uppföljande testning.10
Progression
Evaluering av förändring gör det möjligt för behandlaren att avgöra om tillståndet är stabilt, progredierar eller förbättras. Progression i ett synfält kan bero på en diffus minskning av känsligheten, befintliga defekter kan bli djupare eller expandera eller nya defekter kan uppstå. Nedtryckta områden utvecklas oftast innan nya områden i synfältet påverkas. En initial ökning av variabiliteten i synfältet ses ibland innan en förändring eller progression blir konstant. Det är viktigt att skilja på om bevisen visar långsiktiga fluktuationer eller en försämringstrend. När kliniker väl fastställer att synfältet är sämre måste de avgöra om förändringen beror på glaukom eller en annan sjukdomsenhet. Statistiskt och kliniskt signifikanta förändringar i synfältet gör det möjligt för behandlaren att göra nödvändiga ändringar i patientens behandlings- och hanteringsplan.
Praktiker måste också utvärdera hur progressionshastigheten kan förändra patientens livskvalitet.2 Kliniker måste till exempel vara mer försiktiga när de behandlar yngre patienter med snabbare progression och monokulära patienter (tabell 3).
Och även om det är svårt att förutsäga vilka patienter som kommer att utvecklas långsamt respektive snabbt, bör patientens behandling ändras i enlighet med detta när väl en progressionshastighet utvärderas över tid. Den yngre patienten som visar tecken på snabb progression av synfältsdefekter kommer till exempel att behöva en mer aggressiv behandlingsplan än en äldre patient med långsam progression av ett tidigt synfältsdefekt. Det är rimligt att patienternas behandling och hantering anpassas utifrån deras specifika kliniska bild, inklusive deras fältförlust och progressionstakt. Forskning visar att om progressionshastigheten bestäms och ingen behandlingsförändring inleds, kan tidigare progressionshastigheter förutsäga framtida hastigheter.10,11 Samtidigt kan försämringstakten förändras genom eskalerande behandling. När ett ingrepp görs bör ett nytt utgångsläge fastställas.
Tabell 3. Förslag till bedömning av progression
- Tre punkter i ett onormalt område minskar med 10 dB*
- Två nya punkter, nära en defekt minskar med 10dB*
OR
- Två punkter i centrala 15 grader eller tre utanför 15 grader minskar med 10dB*
OR
- Statistiska jämförelser (p
*på två eller flera på varandra följande fält14,17
Evaluering av förändring över tid är kritisk vid behandling av glaukom. Med programvaran för guidad progressionsanalys (GPA) som finns på HFA identifieras två baslinjetester för synfältet. Efterföljande synfältstester jämförs sedan med den genomsnittliga baslinjen med hjälp av mönsteravvikelsevärdena. När uppföljningsvärdena sjunker i en grad som är större än variabiliteten hos en ålders- och defektmatchad population av stabila glaukompatienter identifieras punkten. Om förändringen kvarstår vid upprepade upprepade tester markeras punkterna som möjliga (två på varandra följande) eller sannolika (tre eller fler på varandra följande fält).
GPA använder både trend- och händelseanalys för att hjälpa behandlare att identifiera och kvantifiera utvecklingen av synfältet. Händelseanalys letar efter en statistiskt signifikant förändring av en punkt eller grupp av punkter, medan trendanalys kvantifierar förändringsriktningen över tid eller förändringshastigheten, inklusive framtida prognoser. Kliniker kan rikta sin uppmärksamhet mot den potentiella underskattningen av diffus förlust, subtila artefakter som kan förknippas med mönsteravvikelse och behovet av ett tillräckligt antal synfält av hög kvalitet (minst fem) för optimal analys. GPA påverkas dock mindre av katarakt än andra analysverktyg. Varje teststrategi använder sin egen normativa databas.2 Ett ytterligare mål är att identifiera en progressionsfrekvens och skilja ut de patienter som utvecklas snabbt och behöver alltmer aggressiv behandling.
Progression av icke-glaukomatösa optiska neuropatier
Då GPA har upprättats specifikt för glaukomhantering måste kliniker ta ett annat tillvägagångssätt när de utvärderar eventuell progression vid icke-glaukomatösa tillstånd. Regressionsanalys av VFI eller medelavvikelse, liksom serieöversiktsrapport, kan vara till hjälp vid utvärdering av andra tillstånd.2
Följning
Använd samma teststrategi och mönster för att möjliggöra enklare jämförelser och övervakning av progression. Att följa etablerade glaukompatienter med perimetri är viktigt för att avgöra om den nuvarande behandlingen är adekvat eller om behandlingsförändringar behövs baserat på synfältets stabilitet eller progression.
Frekvensen av uppföljning beror på sjukdomens omfattning och det kliniska förloppet. Patienter som uppvisar stabilitet kan rimligen öka sitt uppföljningsintervall.
Artefakter
Det finns flera artefakter som kan uppstå och som innebär ytterligare utmaningar vid tolkningen av synfält. Kliniker måste urskilja verkliga synfältsdefekter från patologi som korrelerar med den kliniska bilden jämfört med artefakter som kan uppstå. Vid tillfällen då det inte är klart om synfältsdefekten är äkta eller en artefakt bör synfältet upprepas i en lämplig tidslinje baserat på din misstankegrad och den kliniska bilden. Artefakter att hålla utkik efter är bland annat:
– Ögonlocks- och ögonbrynsptos. Detta kan orsaka en tät överlägsen defekt längs de överlägsna kantpunkterna. Patienter med visuellt betydande ptos kan ha nytta av att få sina ögonlock tejpade för testning.
– Randsariefakter. Placeringen av provlinshållaren kan leda till en randartefakt om den är för långt från patientens öga, vilket skapar ett helt eller delvis ringskotom.
– Felaktigt brytningsfel. Detta kan leda till en generaliserad sänkning av känsligheten som kan efterlikna den för en katarakt. Högt refraktionsfel kan skapa en förstorings- eller förminskningseffekt och kräver korrekta beräkningar av vertexavståndet. Att använda fel tecken för linsstyrka eller att inte använda det nya refraktionsfelet efter att en patient har genomgått en kataraktoperation är två vanliga fel.
– Patientens trötthet. Detta kan visa sig genom längre testtider, högt falskt negativt värde eller företrädesvis onormal perifer känslighet. Perifera punkter testas senare under testets gång och kan vara tydligt reducerade vid trötthet eller avtagande uppmärksamhet, vilket resulterar i ett mörkare, lobulärt ring- eller klöverbladsmönster på gråskalan.
En inlärningskurva finns för både patienter och de som administrerar testet. Medvetenhet om dessa vanligt förekommande artefakter gör det möjligt att förbättra tolkningen av synfältet och erkänna begränsningar av testresultatens tillförlitlighet och kvalitet.
Varför vi testar
En förståelse för den visuella banan kan ge en vårdgivare värdefull insikt för att lokalisera lesioner. Varje praktik bör standardisera en önskad teststrategi och ett önskat testmönster och upprepa samma test vid uppföljningsbesök för att möjliggöra mer exakta jämförelser under hela uppföljningstestningen.18
Glaukomhanteringen bör fokusera på att förhindra förlust av synfält i den grad att det påverkar patientens livskvalitet. Det är viktigt att utvärdera hela den kliniska bilden för att se till att variablerna korrelerar och sammanfaller. Tester bör upprepas om osäkerhet föreligger för att fastställa mer tillförlitliga baslinjemätningar och bekräfta eventuell progression.
Dr Draskovic och McSoley är anställda optiker vid Bascom Palmer Eye Institute.
1. Lens A, Langley T, Nemeth SC, Shea C. Visual Pathway. In: Ocular Anatomy and Physiology. Thorofare, NJ: SLACK; 1999:90-5.
2. Heijl A, Patella VM, Bengtsson B. The Field Analyzer Primer: Effective Perimetry. 4th ed. Carl Zeiss Meditec; 2012.
3. Park HY, Hwang BE, Shin HY, Park CK. Kliniska ledtrådar för att förutsäga förekomsten av parafovealt scotom på Humphrey 10-2 synfält med hjälp av ett Humphrey 24-2 synfält. Am J Ophthalmol. 2016;161:150-9.
4. Ehrlich AC, Raza AS, Ritch R, et al. Modifying the conventional visual field test pattern to improve the detection of early glaucomatous defects in the central 10°. Transl Vis Sci Technol. 2014 Oct;3(6):6.
5. Kedar S, Ghate D, Corbett JJ. Visual Fields in Neuro-Ophthalmology. Indian Journal of Ophthalmology. 2011;59(2):103-9.
6. Wall M, George D. Idiopatisk intrakraniell hypertension. En prospektiv studie av 50 patienter. Brain. 1991;114:155-80.
7. Keltner JL, Johnson CA, Spurr JO, Beck RW. Baseline visual field profile of optic neuritis. Erfarenheterna från optic neuritis treatment trial. Studiegruppen för optisk neurit. Arch Ophthalmol. 1993;111:231-4.
8. Hayreh SS, Zimmerman B. Synfältsavvikelser vid icke-arteritisk främre ischemisk optisk neuropati: deras mönster och prevalens vid den första undersökningen. Arch Ophthalmol. 2005;123:1554-62.
9. Hayreh SS. Posterior ischemisk optisk neuropati: kliniska egenskaper, patogenes och behandling. Eye (Lond). 2004;18:1188–206.
10. Bengtsson B. Prediction of glaucomatous visual field loss by extrapolation of linear trends. Arch Ophthalmol. 2009;127(12):1610-5.
11. Heijl A. Minskning av intraokulärt tryck och glaukomutveckling. Arch Ophthalmol. 2002;120(10):1268-79.
12. Willmore LJ, Abelson MB, Ben-Menachem E, et al. Vigabatrin: 2008 update. Epilepsia. 2009;50:163–73.
13. Katz J, Sommer A, Gaasterland DE, Anderson DR. En jämförelse av analytiska algoritmer för att upptäcka glaukomatös synfältsförlust. Arch Ophthalmol. 1991;109(12):1017-25.
14. Hodapp E, Parrish RK II, Anderson DR. Kliniska beslut vid glaukom. St. Louis: The CV Mosby Co;1993:52-61.
15. Feuer WJ, Anderson DR. Statisk tröskelasymmetri vid tidig glaukomatös synfältsförlust. Ophthalmology. 1989;96:1285-97.
16. Brenton RS, Phelps CD, Rojas P, Woolson RF. Interokulära skillnader i synfältet hos normala personer. Invest Ophthalmol Vis Sci. 1986;27:799-805.
17. Anderson DR, Chauhan B, Johnson C, et al. Kriterier för progression av glaukom vid klinisk behandling och i resultatstudier. Am J Ophthalmol. 2000;130(6):827-29.
18. Weinreb RN. Progression av glaukom: The 8th Consensus Report of the World Glaucoma Association. Amsterdam: Kugler Publications; 2011.
