L’évaluation de la voie visuelle peut faire partie intégrante du diagnostic et de la gestion de nombreuses conditions.
Par Kristie Draskovic, OD, et John J. McSoley, OD
- Date de publication:
- Date d’expiration:
- Déclaration d’objectif:
- Faculté/Conseil de rédaction:
- Déclaration de crédit:
- Déclaration de coparrainage:
- Déclaration de divulgation :
- Cas 1. Macroadénome hypophysaire
- Tableau 1. Neuropathies optiques fréquemment détectées par l’examen du champ visuel
- Cas 2. Sclérose en plaques
- Cas 3. Défaut de glaucome paracentral
- Tableau 2. Critères de défaut du champ visuel glaucomateux avec une spécificité et une sensibilité élevées13,14
- Tableau 3. Suggestions pour juger de la progression
Date de publication:
mars 2016
Date d’expiration:
1er mars 2019
Déclaration d’objectif:
L’examen des champs visuels à l’aide de la périmétrie automatisée peut aider les cliniciens à évaluer les lésions qui affectent la voie visuelle, à établir des lignes de base et à dépister certaines neuropathies optiques induites par des médicaments. Il peut également aider à surveiller la progression ou la récurrence des maladies, à guider les décisions de traitement et à aider à localiser les lésions. Cet article aidera les cliniciens à mieux comprendre et interpréter les champs visuels dans les processus pathologiques glaucomateux et non glaucomateux.
Faculté/Conseil de rédaction:
Kristie Draskovic, OD, et John J. McSoley, OD
Déclaration de crédit:
Ce cours est approuvé par le COPE pour 2 heures de crédit de formation continue. L’ID COPE est 48599-GL. Veuillez vérifier auprès du conseil de licence de votre État si cette approbation compte pour votre exigence de formation continue pour le renouvellement de votre permis d’exercer.
Déclaration de coparrainage:
Ce cours de formation continue est coparrainé par le Collège d’optométrie de Pennsylvanie.
Déclaration de divulgation :
Les docteurs Draskovic et McSoley n’ont aucune relation financière à divulguer.
L’examen du champ visuel est essentiel lorsqu’on envisage une perte de vision potentielle due à des conditions affectant la voie visuelle. La périmétrie automatisée standard est un outil utile pour identifier et suivre de nombreuses affections neurologiques, ainsi que le glaucome et les personnes suspectées de glaucome. Bien que plusieurs appareils soient actuellement disponibles, la discussion suivante considérera l’utilisation de l’analyseur de champ Humphrey (HFA, Zeiss) à titre d’exemple.
Anatomie et physiologie
Du fait de l’anatomie de la voie visuelle, les cliniciens peuvent détecter les zones préoccupantes dans de nombreuses conditions qui provoquent une déficience visuelle (figure 1). Comme la lumière provenant du champ visuel temporal tombe sur la rétine nasale, les lésions rétiniennes sont visibles dans le quadrant opposé du champ visuel. Toutes les lésions pré-chiasmatiques, y compris celles de la rétine et du nerf optique, donneront lieu à des défauts isolés de l’œil affecté1.
Puisque les fibres nasales sont responsables du champ visuel temporal, une lésion au niveau du chiasma optique entraînera un défaut du champ visuel qui affectera le champ temporal des deux yeux, et donnera lieu à la classique hémianopsie bitemporale, qui respecte la ligne médiane verticale.1 Les lésions du chiasma optique peuvent être le résultat d’adénomes hypophysaires, de méningiomes suprasellaires, de craniopharyngiomes ou d’anévrismes. Dans certains cas, les anomalies du champ visuel peuvent s’inverser après traitement de la cause.2
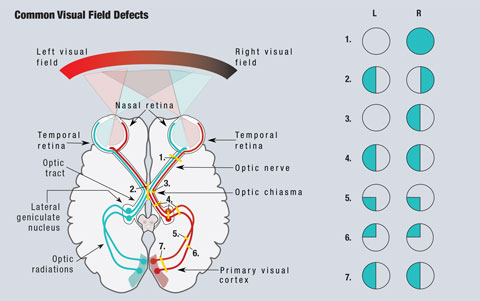
Cliquez sur l’image pour l’agrandir. Fig. 1. Un schéma simplifié de la voie visuelle est présenté. Les lésions qui interrompent la voie visuelle entraînent des anomalies du champ visuel. (1) Une lésion complète du nerf optique droit entraîne une perte complète du champ visuel droit. (2) Une lésion de la ligne médiane du chiasma optique entraîne une hémianopsie bitemporale. (3) Une lésion des fibres non croisées du nerf optique droit au niveau du chiasma optique entraîne une hémianopsie nasale de l’œil droit. (4) Une lésion complète du tractus optique droit, du noyau géniculé latéral ou des radiations optiques entraîne une hémianopsie homonyme gauche complète. (5) Une lésion des radiations optiques supérieures droites entraîne une quadranopsie inférieure gauche. (6) Une lésion des radiations optiques inférieures droites entraîne une quadranopsie supérieure gauche. (7) Une lésion des radiations optiques droites supérieures et inférieures entraîne une hémianopsie homonyme gauche. Illustration de Miquel Perello Nieto.
Les fibres responsables du champ visuel à droite de la ligne médiane se trouvent du côté gauche du cerveau, et vice versa. En raison de ce croisement, toutes les lésions post-chiasmatiques, y compris les lésions du tractus optique et des radiations optiques, provoquent une hémianopsie homonyme.1 Ces défauts se trouvent du même côté du champ visuel dans chaque œil et respectent la ligne médiane verticale. Lorsque les défauts ne sont vus que de façon supérieure ou inférieure, on parle de quadranopsie. Dans le cas des défauts d’hémianopsie incomplète, les lésions antérieures sont généralement plus incongrues, alors que les lésions postérieures seront plus congruentes entre les deux yeux.1
La perte de champ visuel glaucomateux représente une atteinte des axones voyageant le long de la couche des fibres nerveuses rétiniennes et suit généralement un schéma arqué jusqu’au nerf optique. Les lésions de ces axones donnent lieu à des anomalies localisées du champ visuel, le plus souvent des scotomes arqués, des marches nasales et des scotomes paracentraux. Un champ de vision normal s’étend à 90 degrés dans le sens temporel, à 70 degrés dans le sens supérieur et inférieur et à 60 degrés dans le sens nasal et à partir de la fixation. Les informations les plus précieuses pour les déficits neurologiques et la gestion du glaucome sont obtenues à moins de 30 degrés de la fixation.2
Stratégie de test
La périmétrie statique automatisée – et la périmétrie à seuil en particulier – présente un stimulus de taille fixe mais d’intensité variable. La sensibilité des différents emplacements de test est enregistrée en fonction des réponses du patient à ces stimuli. Un stimulus de taille III (qui représente 4 mm2 lorsqu’il est projeté sur un bol de 30 cm) est couramment utilisé dans la pratique clinique.
Il existe différentes mires de seuil disponibles. La mire 30-2 teste 76 emplacements à 30 degrés de la fixation, tandis qu’une mire 24-2 teste 54 emplacements en retirant l’anneau de points à 30 degrés (sauf les deux points qui chevauchent le méridien horizontal au niveau nasal). Ces points les plus périphériques sont plus sujets à la variabilité, et le 24-2 raccourcit la durée du test en éliminant ces points périphériques du test. L’espacement entre les emplacements des points de test est de six degrés.
En outre, la mire 10-2 cible 64 points à 10 degrés de la fixation séparés de deux degrés. Cette option est préférable lorsque des défauts centraux ou paracentraux apparaissent avec le 24-2 et le 30-2 ou lorsque le champ devient si étroit que les points périphériques ne sont pas cliniquement utiles. Les cliniciens peuvent également choisir d’augmenter la taille du stimulus à V, ce qui peut permettre d’obtenir des valeurs de sensibilité plus élevées et une plage dynamique plus large pour suivre les patients et détecter les changements. Cependant, il n’existe actuellement aucun algorithme de test de type SITA, ni de comparaison disponible avec une base de données normative ou une analyse de progression.
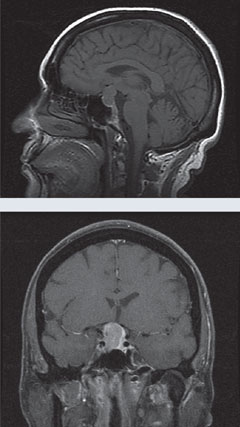
Cas 1. Macroadénome hypophysaireUn patient s’est présenté en consultation dans le cadre d’un glaucome à tension normale atypique et progressif. |
|
|

|
| Ci-dessus, le champ visuel 24-2 du patient démontre une perte de champ visuel bitemporale. Dans les IRM à gauche, les vues sagittale T1 sans gadolinium et coronale T1 avec gadolinium révèlent une grande masse sellaire avec un léger rehaussement et un effet compressif sur le chiasma. Cette constatation est compatible avec un macroadénome hypophysaire. Cliquez sur les images pour les agrandir. |
|

|
|
| Après que le patient ait subi une chirurgie transsphénoïdale pour enlever la masse sellaire, le champ visuel, ci-dessus, montre une amélioration du défaut du champ visuel dans l’œil droit et une résolution du défaut dans l’œil gauche. Cliquez sur l’image pour l’agrandir. | |
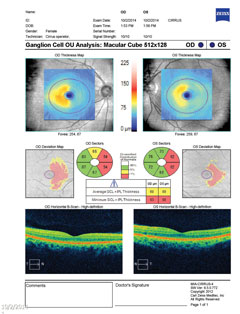
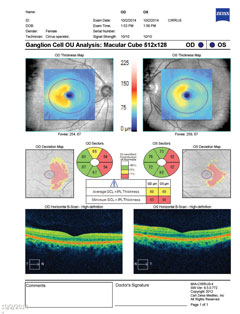
| Ci-dessus, le complexe de cellules ganglionnaires révèle un amincissement nasal dans les deux yeux, ce qui est en corrélation avec la perte du champ visuel temporal. Cliquez sur l’image pour l’agrandir. | |
Des études récentes montrent que les champs visuels 10-2 peuvent être utiles pour identifier un glaucome plus qu’avancé.3,4 Une étude a révélé que certains patients atteints de glaucome présentaient des défauts significatifs du faisceau central observés sur les modèles de test 10-2 malgré un champ visuel central 30-2 normal. L’étude suggère qu’en raison d’un mauvais échantillonnage spatial, la détérioration du champ central glaucomateux ne pouvait pas être détectée par la seule grille de test 30-2, et qu’une estimation plus dense des 10 degrés centraux était nécessaire.4 Cela suggère également que la modification de la mire conventionnelle du champ visuel pourrait améliorer la détection des défauts glaucomateux précoces dans les 10 degrés centraux.4
Dans la pratique quotidienne, les médecins effectuent souvent des champs 10-2 lorsque de petits scotomes centraux ou paracentraux apparaissent sur les tests 30-2 et 24-2, ou lorsque l’acuité est suspectée ou menace d’être déprimée en raison d’une perte de champ. De plus, une mire 10-2 peut être un complément utile lorsqu’il y a une grande variabilité inter-test des points paracentraux sur une mire 24-2. L’attention croissante accordée à la fonction des cellules ganglionnaires dans la région maculaire pourrait également accroître l’attention portée à la zone du champ visuel testée par la mire 10-2.
Fiabilité
Les indications de fiabilité de la performance du champ visuel comprennent les pertes de fixation et les réponses faussement positives et faussement négatives.
Tableau 1. Neuropathies optiques fréquemment détectées par l’examen du champ visuel |
|
| Hypertension intracrânienne idiopathique | Précoce : tache aveugle élargie Tardif : constriction généralisée5,6 (peut s’améliorer avec le traitement) |
| Névrite épileptique | – Perte diffuse du champ visuel (dans presque la moitié des cas) – Autre : défaut altitudinal, scotomes centraux ou cécocentraux, défauts arqués ou doublement arqués et défauts hémianopiques5,7 |
| Névropathie optique ischémique antérieure non artéritique | – Les défauts altitudinaux qui respectent la ligne médiane horizontale sont les plus fréquents – Autres : scotomes centraux, défauts arqués et quadranopsies5,8 |
| Névropathie optique ischémique postérieure | – Défaut de champ central5,9 |
| Névropathies optiques héréditaires – Neuropathie optique héréditaire de Leber – Atrophie optique dominante |
– Perte du champ visuel cécocentrique et central5 |
| Drushes de la tête du nerf optique | – Peut imiter un schéma glaucomateux |
| Ophtalmopathie thyroïdienne | – Grande variabilité – Peut se résorber partiellement ou totalement après traitement2 |
| Névropathie optique toxique induite par les médicaments | – La toxicité de l’éthambutol (pour le traitement de la tuberculose) peut provoquer des scotomes centraux et, moins fréquemment, une constriction périphérique et des défauts altitudinaux5 – Vigabatrin (un médicament anti-épileptique), peut provoquer des défauts de champ qui commencent par des défauts nasaux bilatéraux et évoluent ensuite vers des défauts de champ concentriques alors que le champ central reste intact12 |
La fixation peut être surveillée par la présentation périodique d’un stimulus à l’angle mort physiologique (méthode Heijl-Krakau) ou par la surveillance de la position du réflexe lumineux cornéen. Sur l’HFA, une déviation vers le haut indique un changement de position ou de fixation ; une déviation vers le bas indique que le réflexe lumineux cornéen ne peut être localisé, par exemple lors d’un changement de position de la tête ou des paupières.
Les faux positifs se produisent lorsqu’un patient répond à un moment où il n’y a pas de stimulus associé ou lorsqu’une réponse n’est physiologiquement pas possible. Les patients qui présentent un taux élevé de faux positifs sont souvent décrits comme des » trigger happy « . Cela peut révéler un champ visuel qui semble plus sensible ou plus normal que prévu ou peut conduire à des valeurs de seuil de sensibilité anormalement élevées.
Les faux négatifs se produisent lorsqu’un patient ne répond pas à un stimulus plus lumineux qu’un autre déjà vu ou lorsque la réponse n’est pas cohérente avec le schéma des réponses dans cette région. La valeur des faux négatifs peut être une indication de fiabilité ou un reflet du processus pathologique. Les régions anormales du champ visuel sont associées à une plus grande variabilité intra-test et inter-test. Par conséquent, les régions du champ visuel présentant une faible sensibilité ne sont pas incluses dans le calcul de la valeur de faux négatif.
Le seuil de sensibilité est une donnée brute avec des valeurs enregistrées en décibels. Les chiffres indiquent le degré d’atténuation par rapport au stimulus maximal possible. Les valeurs de
L’écart total représente l’écart par rapport aux valeurs attendues sur la base de données normales appariées selon l’âge. L’écart de forme corrige la sensibilité globale du champ en supprimant les dépressions généralisées (par exemple, dues à la cataracte) pour identifier les zones d’anomalies localisées. L’écart total et l’écart de forme sont associés à des valeurs de probabilité (p) calculées sur la base de la distribution dans une population normale. La gamme des valeurs normales est plus large à la périphérie qu’au centre. Les symboles P indiquent la fréquence d’apparition de la valeur testée dans une population normale appariée selon l’âge. Les déviations sont indiquées sur la carte si le seuil testé est pire que les 5% inférieurs de la normale pour cet âge.2 Par exemple, si p
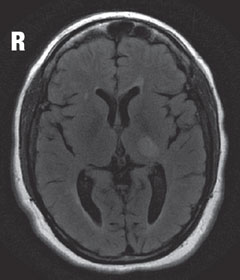
Cas 2. Sclérose en plaquesUn patient diagnostiqué avec une sclérose en plaques (SEP) a présenté une perte de vision. |
|
|
 |
| Au-dessus, dans l’IRM, la vue axiale T2 flair révèle une lésion hyperintense focale juste postérieure au noyau géniculé latéral gauche dans le thalamus, qui est responsable du défaut de champ visuel observé. La lésion observée, ainsi que d’autres lésions hyperintenses multiples, sont des caractéristiques typiques des maladies démyélinisantes telles que la SEP. | |
|
|
| Au-dessus, le champ visuel démontre une hémianopsie homonyme droite incomplète. Cliquez sur l’image pour l’agrandir. À gauche, l’analyse des cellules ganglionnaires révèle un amincissement nasal dans l’œil droit et un amincissement temporal dans l’œil gauche, ce qui est cohérent avec les résultats du champ visuel. Cliquez sur l’image pour l’agrandir. |
|
L’écart-type du motif (PSD) est un écart-type pondéré par rapport à la valeur attendue sur la base des valeurs normales appariées selon l’âge et de l’indice d’écart moyen (MD). Le PSD révèle la distance entre différents points du champ. Le PSD est sensible aux défauts précoces et focaux du glaucome. Une faible valeur PSD peut être observée avec des champs visuels normaux, un champ visuel uniformément déprimé ou un champ complètement aveugle. Une valeur p associée est la probabilité que la valeur se produise.
La MD est une moyenne pondérée des valeurs dans le graphe numérique de la déviation totale. La MD peut être influencée par une diminution diffuse de la sensibilité globale ou par un défaut localisé. Une MD de 0 indique une valeur normale, tandis qu’une valeur négative représente une déviation ou une perte par rapport à la base de données normale. L’écart moyen pèse plus lourdement sur les points centraux.
L’indice de champ visuel (IFV) est une autre évaluation corrigée en fonction de l’âge, exprimée en pourcentage, où une valeur périmétriquement normale est de 100 % et une valeur périmétriquement aveugle de 0 %. Lors du calcul du VFI, les points centraux sont pondérés plus fortement que les points périphériques. Il fournit un score pour un champ visuel individuel et est utilisé dans l’analyse de la progression.2
Le test de l’hémichamp du glaucome (GHT) compare la sensibilité relative des valeurs de déviation du motif de cinq zones dans les hémichamps supérieur et inférieur. Chacune de ces zones est comparée à sa zone miroir dans l’hémichamp opposé, et les deux zones sont comparées à la base de données normative. Le GHT peut détecter une perte de champ visuel glaucomateux avec une sensibilité élevée et une spécificité élevée à travers cinq catégories possibles : en dehors des limites normales, limite, réduction générale de la sensibilité, sensibilité anormalement élevée et dans les limites normales.
Interprétation
L’établissement d’un champ visuel de référence fiable est crucial pour la gestion du glaucome et la surveillance future d’une éventuelle progression. Les cliniciens devraient obtenir au moins deux champs visuels de base reproductibles pour détecter les plus petits incréments de changement. La reconnaissance de la progression, en particulier après l’escalade de la thérapie à des moments de progression, nécessitera que le clinicien établisse une nouvelle ligne de base.
Cas 3. Défaut de glaucome paracentral
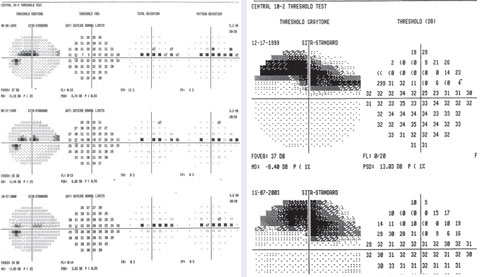
Un exemple de points variables dans un scotome paracentral supérieur sur 24-2 avec un défaut profond focal sur 10-2.
Les champs visuels réalisés avant le traitement médical ou chirurgical en cours, ou pendant une période prolongée de perte de suivi hors traitement, ne doivent pas être utilisés pour déterminer la progression. Les cliniciens doivent utiliser les nouveaux champs visuels de référence effectués après ces changements de traitement, et tout champ visuel ultérieur pour juger de la progression.
Une ligne de base fiable et représentative est également importante pour les programmes d’analyse de la progression. Les champs visuels ont tendance à avoir une plus grande variabilité avec une localisation plus excentrique et des sensibilités de niveau moyen, et la fluctuation à long terme rend le jugement de la progression plus difficile. Les points de sensibilité de niveau moyen ont tendance à être variables, alors que les valeurs de test dans les plages de sensibilité supérieure et inférieure sont plus stables. L’établissement d’un champ visuel de référence fiable et reproductible peut aider à éliminer certains de ces défis.
Névropathies optiques non glaucomateuses
Les champs visuels peuvent aider à évaluer les lésions qui affectent la voie visuelle, établir des lignes de base et servir d’outils de dépistage pour certains médicaments associés aux neuropathies optiques. Ils peuvent également surveiller la progression ou la récurrence des maladies tout en aidant à orienter les décisions thérapeutiques et même à localiser les lésions.5 La manifestation la plus courante du champ visuel d’une neuropathie optique non glaucomateuse est un défaut central. Plus le scotome est important, plus la probabilité que l’acuité visuelle soit réduite est grande (tableau 1).
Maladie rétinienne
Les défauts du champ visuel causés par une maladie rétinienne ont tendance à avoir des frontières bien définies et nettes qui semblent plus profondes que la plupart des défauts du glaucome avec moins de variabilité.2 Les conditions communes affectant la zone maculaire, telles que la dégénérescence maculaire liée à l’âge et la choriorétinopathie séreuse centrale, peuvent donner lieu à des scotomes centraux qui peuvent être vus sur les tests 10-2 ainsi que sur certains tests 24-2 et 30-2, selon l’étendue des dommages.
La rétinite pigmentaire donne lieu à des défauts du champ visuel périphérique, qui peuvent conduire à une vision en tunnel avec seulement un îlot central dans une maladie avancée.
Les occlusions artérielles montrent typiquement des zones absolues de défaut alors que les occlusions veineuses peuvent être plus superficielles et diffuses.2 Celles-ci coexistent souvent avec un glaucome, rendant l’interprétation plus difficile.
La coriorétinite, ou les cicatrices associées, peuvent masquer les défauts glaucomateux avec un défaut en forme d’arc ou de coin. Un décollement de rétine donnera lieu à un défaut relatif alors que le rétinoschisis aura un défaut absolu. Ces affections sont souvent beaucoup plus périphériques que ce qui apparaîtrait sur un test central conventionnel utilisant le 24-2 ou le 30-2.
Défauts de glaucome
Un défaut peut être une dépression généralisée ou localisée de la sensibilité par rapport à la base normalisée. Les dépressions généralisées sont le plus souvent observées en cas de cataracte, mais peuvent également provenir d’un défaut de réfraction non corrigé ou d’un myosis. Les défauts localisés peuvent être décrits plus précisément par leur taille, leur profondeur et leur emplacement pour faciliter le diagnostic. Un défaut relatif se produit lorsque la sensibilité est inférieure à la normale, ou peut être réduite par rapport à d’autres zones du champ, mais que la vision demeure. Un défaut absolu se produit lorsque le stimulus est présenté à la luminosité maximale et n’est pas vu.
La perte du champ visuel glaucomateux peut d’abord apparaître dans la région nasale ou dans la région arquée (zone de Bjerrum). Ces défauts peuvent s’étendre de la tache aveugle, autour de la région maculaire, se terminant brusquement au méridien horizontal nasal. Les défauts glaucomateux précoces sont souvent des scotomes relatifs localisés (tableau 2).
Une variabilité test-retest considérable est la caractéristique des zones de champ visuel affectées par une perte de champ visuel glaucomateuse. Des réductions variables de la sensibilité survenant dans la même zone, mais pas toujours aux mêmes emplacements des points de test, précèdent souvent des défauts de champ glaucomateux cohérents.2 La variabilité, telle qu’elle est observée avec les faux négatifs, peut indiquer la fiabilité, mais des quantités plus importantes de variabilité sont souvent observées en raison de la maladie elle-même.
Tableau 2. Critères de défaut du champ visuel glaucomateux avec une spécificité et une sensibilité élevées13,14
- Cluster de trois points non marginaux ou plus sur la déviation du motif avec p
- GHT en dehors des limites normales sur deux champs consécutifs
- PSD
- Asymétrie du MD >1.50dB qui est répétable et dans le cadre d’une suspicion clinique15,16
Lorsque les champs visuels ne sont pas fiables, ils doivent être répétés pour établir des lignes de base, confirmer un défaut ou confirmer une progression suspectée. Habituellement, les champs visuels ne sont pas répétés le même jour en raison de la fatigue du patient, ce qui peut affecter la fiabilité. Il est rarement urgent de faire répéter le champ visuel immédiatement, car le glaucome est généralement une neuropathie optique lentement progressive, et les décisions de traitement sont déterminées par le taux de changement.2 Chaque cabinet devrait standardiser une stratégie et un modèle de test préférés et répéter le même test pour permettre des comparaisons plus précises lors des tests de suivi.10
Progression
L’évaluation du changement permet au praticien de déterminer si l’état est stable, progresse ou s’améliore. La progression d’un champ visuel peut être due à une diminution diffuse de la sensibilité, les défauts existants peuvent se creuser ou s’étendre ou de nouveaux défauts peuvent apparaître. Les zones déprimées progressent le plus souvent avant que de nouvelles zones du champ visuel ne soient affectées. Une augmentation initiale de la variabilité du champ visuel est parfois observée avant qu’un changement ou une progression ne devienne constante. Il est important de différencier si les preuves montrent une fluctuation à long terme ou une tendance à l’aggravation. Une fois que les cliniciens ont établi que le champ visuel est plus mauvais, ils doivent décider si le changement est dû au glaucome ou à une autre entité pathologique. Les changements statistiquement et cliniquement significatifs sur le champ visuel permettent au praticien d’apporter les modifications nécessaires au plan de traitement et de gestion du patient.
Les praticiens doivent également évaluer comment le taux de progression peut altérer la qualité de vie du patient.2 Par exemple, les cliniciens doivent être plus prudents en traitant les patients plus jeunes avec une progression plus rapide et les patients monoculaires (tableau 3).
Bien qu’il soit difficile de prédire quels patients progresseront lentement par rapport à ceux qui progresseront rapidement, une fois que le taux de progression est évalué dans le temps, la prise en charge du patient doit être modifiée en conséquence. Le patient plus jeune qui montre des signes de progression rapide des défauts du champ visuel, par exemple, aura besoin d’un plan de gestion plus agressif qu’un patient âgé avec une progression lente d’un défaut précoce du champ. Il est raisonnable que le traitement et la prise en charge des patients soient personnalisés en fonction de leur tableau clinique spécifique, y compris la perte de champ et le taux de progression. Les recherches montrent que si le taux de progression est déterminé et qu’aucun changement de traitement n’est initié, les taux de progression passés peuvent être prédictifs des taux futurs.10,11 En même temps, les taux de déclin peuvent être modifiés par une intensification du traitement. Une fois qu’une intervention est faite, une nouvelle ligne de base doit être établie.
Tableau 3. Suggestions pour juger de la progression
- Trois points dans une région anormale diminuent de 10dB*
- Deux nouveaux points, près d’une anomalie diminuent de 10dB*
OU
- Deux points au centre de 15 degrés ou trois à l’extérieur de 15 degrés diminuent de 10dB*
OU
- Comparaisons statistiques (p
*Sur deux champs consécutifs ou plus14,17
L’évaluation de l’évolution dans le temps est essentielle dans la gestion du glaucome. Avec le logiciel d’analyse de la progression guidée (GPA) que l’on trouve sur l’HFA, deux tests de champ visuel de base sont identifiés. Les tests de champ visuel ultérieurs sont ensuite comparés à la moyenne de la ligne de base en utilisant les valeurs de déviation du modèle. Lorsque les valeurs de suivi diminuent dans une mesure supérieure à la variabilité d’une population de patients glaucomateux stables appariés par âge et par défaut, le point est identifié. Si le changement persiste lors de tests consécutifs répétés, les points sont marqués comme possible (deux champs consécutifs) ou probable (trois champs consécutifs ou plus).
L’APG utilise à la fois l’analyse des tendances et des événements pour aider les praticiens à identifier et à quantifier la progression du champ visuel. L’analyse des événements recherche un changement statistiquement significatif d’un point ou d’un groupe de points, tandis que l’analyse des tendances quantifie la direction du changement dans le temps, ou le taux de changement, y compris les projections futures. Les cliniciens peuvent attirer l’attention sur la sous-estimation potentielle de la perte diffuse, sur les artefacts subtils qui peuvent être associés à la déviation du motif et sur la nécessité de disposer d’un nombre suffisant de champs visuels de haute qualité (au moins cinq) pour une analyse optimale. Cependant, l’AMP est moins influencé par la cataracte que les autres outils d’analyse. Chaque stratégie de test utilise sa propre base de données normative.Un objectif supplémentaire est d’identifier un taux de progression et de séparer les patients qui progressent rapidement et nécessitent un traitement de plus en plus agressif.
Progression des neuropathies optiques non glaucomateuses
Parce que la GPA a été établie spécifiquement pour la gestion du glaucome, les cliniciens doivent adopter une approche différente lorsqu’ils évaluent une éventuelle progression dans des conditions non glaucomateuses. L’analyse de régression du VFI ou de l’écart moyen, ainsi que le rapport de synthèse de la série, peuvent être utiles lors de l’évaluation d’autres conditions.2
Suivi
Utiliser la même stratégie de test et le même modèle pour permettre une comparaison plus facile et le suivi de la progression. Le suivi des patients glaucomateux établis par périmétrie est essentiel pour déterminer si la prise en charge actuelle est adéquate ou si des changements de traitement sont nécessaires en fonction de la stabilité ou de la progression du champ visuel.
La fréquence du suivi dépendra de l’étendue de la maladie et de l’évolution clinique. Les patients qui démontrent une stabilité pourraient raisonnablement augmenter leur intervalle de suivi.
Artifacts
Plusieurs artefacts peuvent survenir, imposant des défis supplémentaires à l’interprétation des champs visuels. Les cliniciens doivent discerner les véritables défauts du champ visuel provenant de la pathologie qui sont en corrélation avec le tableau clinique par rapport aux artefacts qui peuvent survenir. Lorsqu’il n’est pas clair si le défaut du champ visuel est réel ou s’il s’agit d’un artefact, le champ visuel doit être répété dans un délai approprié en fonction de votre niveau de suspicion et du tableau clinique. Les artefacts à rechercher sont les suivants :
– Posis des paupières et des sourcils. Cela peut provoquer un défaut supérieur dense le long des points de bord supérieur. Les patients présentant une ptose visuellement significative peuvent bénéficier d’un scotchage des paupières pour le test.
– Artéfacts de bord. Le positionnement du porte-lentille d’essai peut entraîner un artefact de bord s’il est trop éloigné de l’œil du patient, créant un scotome annulaire complet ou partiel.
– Erreur de réfraction incorrecte. Cela peut conduire à une dépression généralisée de la sensibilité qui peut imiter celle d’une cataracte. Une erreur de réfraction élevée peut créer un effet d’agrandissement ou de minification et nécessite un calcul approprié de la distance du vertex. Utiliser le mauvais signe de puissance de lentille ou ne pas utiliser la nouvelle erreur de réfraction après qu’un patient ait subi une chirurgie de la cataracte sont deux erreurs courantes.
– La fatigue du patient. Celle-ci peut se manifester par des temps de test plus longs, une valeur de faux négatif élevée ou une sensibilité périphérique anormale préférentielle. Les points périphériques sont testés plus tard au cours du test et peuvent être nettement réduits en cas de fatigue ou de baisse d’attention, ce qui se traduit par un anneau lobulaire plus sombre ou un motif en trèfle sur l’échelle de gris.
Une courbe d’apprentissage existe tant pour les patients que pour ceux qui administrent les tests. La prise de conscience de ces artefacts couramment rencontrés permet d’améliorer l’interprétation du champ visuel et de reconnaître les limites de la fiabilité et de la qualité des résultats des tests.
Pourquoi nous testons
La compréhension de la voie visuelle peut donner au prestataire des indications précieuses pour localiser les lésions. Chaque pratique devrait normaliser une stratégie et un modèle de test préférés et répéter le même test lors des visites de suivi afin de permettre des comparaisons plus précises tout au long des tests de suivi.18
La gestion du glaucome devrait être axée sur la prévention de la perte des champs visuels au point d’affecter la qualité de vie du patient. Il est important d’évaluer l’ensemble du tableau clinique pour s’assurer que les variables sont corrélées et coïncident. Les tests doivent être répétés en cas d’incertitude pour établir des mesures de base plus fiables et confirmer une éventuelle progression.
Les docteurs Draskovic et McSoley sont des optométristes salariés du Bascom Palmer Eye Institute.
1. Lens A, Langley T, Nemeth SC, Shea C. Voie visuelle. In : Anatomie et physiologie oculaires. Thorofare, NJ : SLACK ; 1999:90-5.
2. Heijl A, Patella VM, Bengtsson B. The Field Analyzer Primer : Effective Perimetry. 4th ed. Carl Zeiss Meditec ; 2012.
3. Park HY, Hwang BE, Shin HY, Park CK. Indices cliniques pour prédire la présence d’un scotome parafovéal sur le champ visuel Humphrey 10-2 en utilisant un champ visuel Humphrey 24-2. Am J Ophthalmol. 2016;161:150-9.
4. Ehrlich AC, Raza AS, Ritch R, et al. Modifier le modèle de test de champ visuel conventionnel pour améliorer la détection des défauts glaucomateux précoces dans le 10° central. Transl Vis Sci Technol. 2014 Oct;3(6):6.
5. Kedar S, Ghate D, Corbett JJ. Les champs visuels en neuro-ophtalmologie. Indian Journal of Ophthalmology. 2011;59(2):103-9.
6. Wall M, George D. Hypertension intracrânienne idiopathique. Une étude prospective de 50 patients. Brain. 1991;114:155-80.
7. Keltner JL, Johnson CA, Spurr JO, Beck RW. Profil du champ visuel de base de la névrite optique. L’expérience de l’essai de traitement de la névrite optique. Groupe d’étude sur la névrite optique. Arch Ophthalmol. 1993;111:231-4.
8. Hayreh SS, Zimmerman B. Visual field abnormalities in nonarteritic anterior ischemic optic neuropathy : their pattern and prevalence at initial examination. Arch Ophthalmol. 2005;123:1554-62.
9. Hayreh SS. Neuropathie optique ischémique postérieure : caractéristiques cliniques, pathogenèse et prise en charge. Eye (Lond). 2004;18:1188–206.
10. Bengtsson B. Prédiction de la perte du champ visuel glaucomateux par extrapolation des tendances linéaires. Arch Ophthalmol. 2009;127(12):1610-5.
11. Heijl A. Réduction de la pression intraoculaire et progression du glaucome. Arch Ophthalmol. 2002;120(10):1268-79.
12. Willmore LJ, Abelson MB, Ben-Menachem E, et al. Vigabatrin : 2008 update. Epilepsia. 2009;50:163–73.
13. Katz J, Sommer A, Gaasterland DE, Anderson DR. Une comparaison des algorithmes analytiques pour la détection de la perte de champ visuel glaucomateux. Arch Ophthalmol. 1991;109(12):1017-25.
14. Hodapp E, Parrish RK II, Anderson DR. Décisions cliniques en matière de glaucome. St. Louis : The CV Mosby Co;1993:52-61.
15. Feuer WJ, Anderson DR. Asymétrie du seuil statique dans la perte précoce du champ visuel glaucomateux. Ophtalmologie. 1989;96:1285-97.
16. Brenton RS, Phelps CD, Rojas P, Woolson RF. Différences interoculaires du champ visuel chez les sujets normaux. Invest Ophthalmol Vis Sci. 1986;27:799-805.
17. Anderson DR, Chauhan B, Johnson C, et al. Critères de progression du glaucome dans la gestion clinique et dans les études de résultats. Am J Ophthalmol. 2000;130(6):827-29.
18. Weinreb RN. Progression du glaucome : Le 8e rapport de consensus de l’Association mondiale du glaucome. Amsterdam : Kugler Publications ; 2011.