Die Bewertung der Sehbahn kann für die Diagnose und Behandlung zahlreicher Erkrankungen von entscheidender Bedeutung sein.
Von Kristie Draskovic, OD, und John J. McSoley, OD
- Veröffentlichungsdatum:
- Ablaufdatum:
- Zielsetzung:
- Dozenten/Redaktion:
- Anerkennung:
- Erklärung zum gemeinsamen Sponsoring:
- Bekanntgabe von Informationen:
- Fall 1. Hypophysenmakroadenom
- Tabelle 1. Optische Neuropathien, die häufig bei Gesichtsfeldtests festgestellt werden
- Fall 2. Multiple Sklerose
- Fall 3. Parazentraler Glaukomdefekt
- Tabelle 2. Kriterien für glaukomatöse Gesichtsfelddefekte mit hoher Spezifität und Sensitivität13,14
- Tabelle 3. Vorschläge zur Beurteilung der Progression
Veröffentlichungsdatum:
März 2016
Ablaufdatum:
März 1, 2019
Zielsetzung:
Die Untersuchung der Gesichtsfelder mit Hilfe der automatisierten Perimetrie kann Ärzten dabei helfen, Läsionen, die die Sehbahn beeinträchtigen, zu bewerten, Grundlinien festzulegen und bestimmte medikamenteninduzierte Optikusneuropathien zu erkennen. Sie kann auch helfen, das Fortschreiten oder Wiederauftreten von Krankheiten zu überwachen, Behandlungsentscheidungen zu treffen und Läsionen zu lokalisieren. Dieser Artikel wird Klinikern helfen, Gesichtsfelder bei glaukomatösen und nicht-glaukomatösen Krankheitsprozessen besser zu verstehen und zu interpretieren.
Dozenten/Redaktion:
Kristie Draskovic, OD, und John J. McSoley, OD
Anerkennung:
Dieser Kurs ist von COPE für 2 Stunden CE-Kredit anerkannt. Die COPE-ID lautet 48599-GL. Bitte erkundigen Sie sich bei der Zulassungsbehörde Ihres Bundesstaates, ob diese Zulassung auf Ihre CE-Anforderungen für die Wiederzulassung angerechnet werden kann.
Erklärung zum gemeinsamen Sponsoring:
Dieser Weiterbildungskurs wird vom Pennsylvania College of Optometry mitgesponsert.
Bekanntgabe von Informationen:
Dr. Draskovic und Dr. McSoley haben keine finanziellen Beziehungen, die sie bekannt geben müssen.
Die Untersuchung des Gesichtsfeldes ist von entscheidender Bedeutung, wenn es darum geht, einen möglichen Sehverlust aufgrund von Erkrankungen der Sehbahn zu beurteilen. Die automatische Standard-Perimetrie ist ein nützliches Instrument zur Erkennung und Verfolgung vieler neurologischer Erkrankungen sowie von Glaukom und Glaukomverdacht. Derzeit sind mehrere Geräte erhältlich, doch im Folgenden wird die Verwendung des Humphrey Field Analyzer (HFA, Zeiss) als Beispiel erörtert.
Anatomie und Physiologie
Aufgrund der Anatomie der Sehbahn kann der Arzt bei vielen Erkrankungen, die zu Sehstörungen führen, Problembereiche erkennen (Abbildung 1). Da Licht aus dem temporalen Gesichtsfeld auf die nasale Netzhaut fällt, werden Netzhautläsionen im genau entgegengesetzten Quadranten des Gesichtsfelds gesehen. Alle prächiasmalen Läsionen, einschließlich derjenigen der Netzhaut und des Sehnervs, führen zu Defekten, die auf das betroffene Auge beschränkt sind.1
Da die nasalen Fasern für das temporale Gesichtsfeld verantwortlich sind, führt eine Läsion am Chiasma opticum zu einem Gesichtsfelddefekt, der das temporale Feld beider Augen betrifft und die klassische bitemporale Hemianopsie hervorruft, die die vertikale Mittellinie respektiert.1 Läsionen des Chiasma opticum können die Folge von Hypophysenadenomen, suprasellären Meningeomen, Kraniopharyngiomen oder Aneurysmen sein. In einigen Fällen können sich die Gesichtsfeldausfälle nach Behandlung der Ursache zurückbilden.2
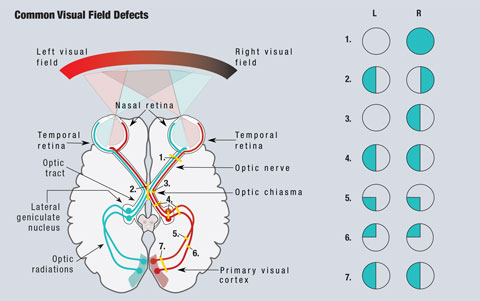
Zum Vergrößern Bild anklicken. Abb. 1. Sie zeigt ein vereinfachtes Schema der Sehbahn. Läsionen, die die Sehbahn unterbrechen, führen zu Gesichtsfeldausfällen. (1) Eine vollständige Läsion des rechten Sehnervs führt zu einem vollständigen Verlust des rechten Gesichtsfeldes. (2) Eine Läsion in der Mittellinie des Chiasma opticum führt zu einer bitemporalen Hemianopsie. (3) Eine Läsion der ungekreuzten Fasern des rechten Sehnervs am Chiasma opticum führt zu einer nasalen Hemianopsie des rechten Auges. (4) Eine vollständige Läsion des rechten Sehnervengangs, des Nucleus geniculatus lateralis oder der optischen Radiationen führt zu einer vollständigen homonymen Hemianopsie links. (5) Eine Läsion der rechten oberen Sehnervenstrahlen führt zu einer inferioren Quadranopsie links. (6) Eine Läsion an den rechten unteren Sehnervenstrahlen führt zu einer linken superioren Quadranopsie. (7) Eine Läsion sowohl der oberen als auch der unteren rechten Sehnervenstrahlen führt zu einer linken homonymen Hemianopsie. Illustration von Miquel Perello Nieto.
Fasern, die für das Gesichtsfeld rechts der Mittellinie verantwortlich sind, befinden sich auf der linken Seite des Gehirns und umgekehrt. Infolge dieser Überkreuzung verursachen alle postchiasmalen Läsionen, einschließlich Läsionen des Sehnervenkopfes und der Sehnervenstrahlen, eine homonyme Hemianopsie.1 Diese Defekte befinden sich auf der gleichen Seite des Gesichtsfeldes in jedem Auge und respektieren die vertikale Mittellinie. Wenn die Defekte nur superior oder inferior zu sehen sind, spricht man von einer Quadranopsie. Bei unvollständigen Hemianopsiedefekten sind die anterioren Läsionen in der Regel inkongruent, während die posterioren Läsionen zwischen den beiden Augen eher kongruent sind.1
Glaukomatöse Gesichtsfeldausfälle stellen eine Schädigung der Axone dar, die entlang der retinalen Nervenfaserschicht verlaufen, und folgen in der Regel einem bogenförmigen Muster zum Sehnerven. Die Schädigung dieser Axone führt zu lokalisierten Gesichtsfeldausfällen, am häufigsten zu bogenförmigen Skotomen, nasalen Stufen und parazentralen Skotomen. Ein normales Gesichtsfeld erstreckt sich temporal auf 90 Grad, superior und inferior auf 70 Grad und nasal und von der Fixation aus auf 60 Grad. Die wertvollsten Informationen für neurologische Defizite und das Glaukom-Management werden innerhalb von 30 Grad von der Fixation gewonnen.2
Teststrategie
Die automatisierte statische Perimetrie – und speziell die Schwellenwert-Perimetrie – bietet einen Reiz von fester Größe, aber variabler Intensität. Die Empfindlichkeit der verschiedenen Teststellen wird auf der Grundlage der Reaktionen des Patienten auf diese Reize aufgezeichnet. In der klinischen Praxis wird üblicherweise ein Reiz der Größe III (4 mm2 bei Projektion auf eine 30-cm-Schale) verwendet.
Es sind verschiedene Schwellentestmuster verfügbar. Das 30-2-Testmuster prüft 76 Punkte innerhalb von 30 Grad von der Fixation, während ein 24-2-Testmuster 54 Punkte prüft, die für den Ring von Punkten bei 30 Grad entfernt sind (mit Ausnahme der beiden Punkte, die den horizontalen Meridian nasal überspannen). Diese peripheren Punkte sind anfälliger für Schwankungen, und 24-2 verkürzt die Testzeit, indem diese peripheren Punkte aus dem Test entfernt werden. Der Abstand zwischen den Testpunkten beträgt sechs Grad.
Das Testmuster 10-2 zielt zusätzlich auf 64 Punkte ab, die innerhalb von 10 Grad von der Fixation entfernt sind und einen Abstand von zwei Grad aufweisen. Diese Option ist vorzuziehen, wenn zentrale oder parazentrale Defekte mit dem 24-2 und 30-2 auftreten oder wenn das Feld so eingeengt ist, dass die peripheren Punkte klinisch nicht sinnvoll sind. Kliniker können auch die Stimulusgröße auf V erhöhen, was höhere Empfindlichkeitswerte und einen größeren dynamischen Bereich ermöglicht, in dem Patienten auf Veränderungen hin beobachtet werden können. Derzeit gibt es jedoch weder einen Testalgorithmus vom Typ SITA noch einen Vergleich mit einer normativen Datenbank oder eine Verlaufsanalyse.
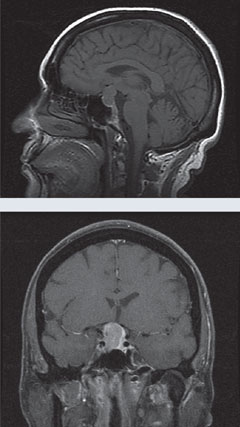
Fall 1. HypophysenmakroadenomEin Patient stellte sich mit einem atypischen, progredienten Normaldruckglaukom vor. |
|
|

|
| Oben zeigt das 24-2-Gesichtsfeld des Patienten einen bitemporalen Gesichtsfeldausfall. In den MRT-Aufnahmen links zeigen die T1-Sagittal-Aufnahmen ohne Gadolinium und die T1-Koronal-Aufnahmen mit Gadolinium eine große sellare Masse mit leichter Anreicherung und kompressiver Wirkung auf das Chiasma. Dieser Befund ist mit einem Hypophysenmakroadenom vereinbar. Klicken Sie auf die Bilder, um sie zu vergrößern. |
|

|
|
| Nachdem der Patient sich einer transsphenoidalen Operation unterzogen hatte, um die sellare Masse zu entfernen, zeigt das Gesichtsfeld (oben) eine Verbesserung des Gesichtsfelddefekts auf dem rechten Auge und eine Auflösung des Defekts auf dem linken Auge. Zum Vergrößern auf das Bild klicken. | |
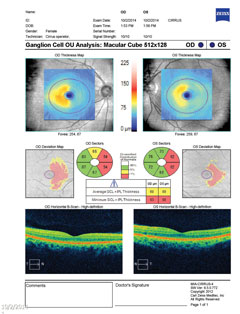
| Oben zeigt der Ganglienzellenkomplex eine nasale Ausdünnung in beiden Augen, die mit dem temporalen Gesichtsfeldausfall korreliert. Klicken Sie auf das Bild, um es zu vergrößern. | |
Rezente Studien zeigen, dass 10-2-Gesichtsfelder nützlich sein können, um mehr als ein fortgeschrittenes Glaukom zu erkennen.3,4 Eine Studie zeigte, dass einige Glaukompatienten signifikante zentrale Clusterdefekte bei 10-2-Testmustern hatten, obwohl das zentrale 30-2-Gesichtsfeld normal war.4 Die Studie legt nahe, dass eine glaukomatöse zentrale Gesichtsfeldverschlechterung aufgrund der schlechten räumlichen Abtastung nicht allein mit dem 30-2-Testraster erfasst werden konnte und eine dichtere Schätzung der zentralen 10 Grad erforderlich war.4 Dies deutet auch darauf hin, dass eine Änderung des konventionellen Gesichtsfeldtestmusters die Erkennung früher glaukomatöser Defekte in den zentralen 10 Grad verbessern könnte.4
In der täglichen Praxis führen Ärzte häufig 10-2-Felder durch, wenn bei 30-2- und 24-2-Tests kleine zentrale oder parazentrale Skotome auftreten oder wenn die Sehschärfe aufgrund von Feldverlusten beeinträchtigt zu sein scheint oder zu werden droht. Außerdem kann ein 10-2-Testbild eine nützliche Ergänzung sein, wenn eine hohe Variabilität der parazentralen Punkte bei einem 24-2-Testbild vorliegt. Die zunehmende Aufmerksamkeit für die Funktion der Ganglienzellen im Makulabereich könnte auch die Aufmerksamkeit für den Bereich des Gesichtsfeldes erhöhen, der mit dem 10-2-Testmuster getestet wird.
Zuverlässigkeit
Zu den Anzeichen für die Zuverlässigkeit der Gesichtsfeldleistung gehören Fixationsverluste und sowohl falsch positive als auch falsch negative Antworten.
Tabelle 1. Optische Neuropathien, die häufig bei Gesichtsfeldtests festgestellt werden |
|
| Idiopathische intrakranielle Hypertonie | Früh: vergrößerter blinder Fleck Spät: generalisierte Verengung5,6 (kann sich mit Behandlung bessern) |
| 0ptische Neuritis | – Diffuser Gesichtsfeldausfall (in fast der Hälfte der Fälle) – Andere: Höhendefekte, zentrale oder dezentralisierte Skotome, bogenförmige oder doppelt bogenförmige Defekte und hemianopische Defekte5,7 |
| Nicht-arterielle anteriore ischämische Optikusneuropathie | – Höhendefekte, die die horizontale Mittellinie respektieren, sind am häufigsten – Andere: Zentrale Skotome, bogenförmige Defekte und Quadranopsien5,8 |
| Posteriore ischämische Optikusneuropathie | – Zentraler Felddefekt5,9 |
| Hereditäre Optikusneuropathien – Lebersche hereditäre Optikusneuropathie – Dominante Optikusatrophie |
– Zekozentraler und zentraler Gesichtsfeldausfall5 |
| Optikuskopfdrusen | – Kann ein glaukomatöses Muster nachahmen |
| Thyreoidale Ophthalmopathie | – Große Variabilität – Kann sich nach der Behandlung teilweise oder vollständig zurückbilden2 |
| Medikamenteninduzierte toxische Optikusneuropathie | – Die Toxizität von Ethambutol (zur Tuberkulosebehandlung) kann zentrale Skotome und, und, seltener, periphere Verengungen und Höhendefekte verursachen5 – Vigabatrin (ein Antiepileptikum), kann Felddefekte verursachen, die als bilaterale nasale Defekte beginnen und später zu konzentrischen Felddefekten fortschreiten, während das zentrale Feld intakt bleibt12 |
Die Fixation kann durch periodische Darbietung eines Reizes im physiologischen Blindfleck (Heijl-Krakau-Methode) oder durch Überwachung der Position des kornealen Lichtreflexes überwacht werden. Bei der HFA zeigt eine Auslenkung nach oben eine Positionsänderung oder Fixation an; eine Auslenkung nach unten zeigt an, dass der Hornhautlichtreflex nicht lokalisiert werden kann, z. B. bei einer Änderung der Kopf- oder Lidposition.
Falsch-positive Ergebnisse treten auf, wenn ein Patient zu einem Zeitpunkt reagiert, zu dem es keinen zugehörigen Stimulus gibt oder wenn eine Reaktion physiologisch nicht möglich ist. Patienten mit einer hohen Anzahl falsch positiver Reaktionen werden oft als „trigger happy“ bezeichnet. Dies kann ein Gesichtsfeld offenbaren, das empfindlicher oder normaler als erwartet erscheint, oder es kann zu abnorm hohen Schwellenwerten für die Empfindlichkeit führen.
Falsch-negative Werte treten auf, wenn ein Patient nicht auf einen Reiz reagiert, der heller ist als ein bereits gesehener Reiz, oder wenn die Reaktion nicht mit dem Muster der Reaktionen in dieser Region übereinstimmt. Der falsch-negative Wert kann ein Hinweis auf die Zuverlässigkeit oder ein Spiegelbild des Krankheitsprozesses sein. Abnormale Regionen des Gesichtsfelds sind mit einer größeren Variabilität innerhalb und zwischen den Tests verbunden. Daher werden Bereiche des Gesichtsfeldes mit geringer Empfindlichkeit nicht in die Berechnung des falsch-negativen Wertes einbezogen.
Bei der Schwellenempfindlichkeit handelt es sich um Rohdaten, deren Werte in Dezibel angegeben sind. Die Zahlen geben den Grad der Abschwächung von der maximal möglichen Reizung an. Werte von
Die Gesamtabweichung stellt die Abweichung von den erwarteten Werten auf der Grundlage der altersentsprechenden Normaldatenbank dar. Die Musterabweichung korrigiert die Gesamtempfindlichkeit des Feldes, indem generalisierte Depressionen (z. B. durch Katarakte) entfernt werden, um Bereiche mit lokalen Anomalien zu identifizieren. Sowohl die Gesamtabweichung als auch die Musterabweichung haben zugehörige Wahrscheinlichkeitswerte (p), die auf der Grundlage der Verteilung innerhalb einer normalen Bevölkerung berechnet werden. Der Bereich der Normalwerte ist peripher breiter als zentral. Die p-Symbole geben die Häufigkeit an, mit der der getestete Wert in einer altersgleichen Normalbevölkerung auftritt. Abweichungen werden auf der Karte angezeigt, wenn der getestete Schwellenwert schlechter ist als die unteren 5 % des Normalwerts für dieses Alter.2 Wenn zum Beispiel p
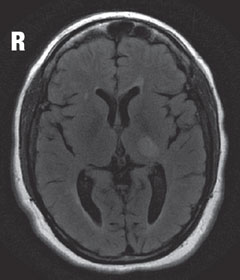
Fall 2. Multiple SkleroseEin Patient, bei dem Multiple Sklerose (MS) diagnostiziert wurde, stellte sich mit Sehverlust vor. |
|
|
 |
| Oben im MRT zeigt sich in der axialen T2-Flare-Ansicht eine fokale hyperintense Läsion knapp hinter dem linken Nucleus geniculatus lateralis im Thalamus, die für den Gesichtsfelddefekt verantwortlich ist. Diese Läsion sowie andere multiple hyperintense Läsionen sind typische Merkmale einer demyelinativen Erkrankung wie MS. | |
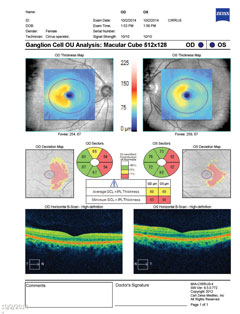
|
|
| Oben zeigt das Gesichtsfeld eine unvollständige rechte homonyme Hemianopie. Klicken Sie auf das Bild, um es zu vergrößern. Links zeigt die Ganglienzellenanalyse eine nasale Ausdünnung im rechten Auge und eine temporale Ausdünnung im linken Auge, was mit dem Gesichtsfeldbefund übereinstimmt. Klicken Sie auf das Bild, um es zu vergrößern. |
|
Die Standardabweichung (PSD) ist eine gewichtete Standardabweichung von dem Wert, der auf der Grundlage altersentsprechender Normalwerte und des Index der mittleren Abweichung (MD) erwartet wird. Die PSD gibt Aufschluss über den Abstand zwischen verschiedenen Punkten innerhalb des Feldes. Die PSD ist sowohl für frühe als auch für fokale Glaukomdefekte empfindlich. Ein niedriger PSD-Wert kann bei einem normalen Gesichtsfeld, einem gleichmäßig eingeschränkten Gesichtsfeld oder einem vollständig blinden Feld auftreten. Ein zugehöriger p-Wert gibt die Wahrscheinlichkeit des Auftretens des Wertes an.
Die MD ist ein gewichteter Mittelwert der Werte in der numerischen Darstellung der Gesamtabweichung. Die MD kann durch eine diffuse Abnahme der Gesamtempfindlichkeit oder durch einen lokalisierten Defekt beeinflusst werden. Eine MD von 0 bedeutet einen normalen Wert, während ein negativer Wert eine Abweichung oder einen Verlust von der normalen Datenbasis darstellt. Bei der mittleren Abweichung werden zentrale Punkte stärker gewichtet.
Der Gesichtsfeldindex (VFI) ist eine weitere alterskorrigierte Bewertung, die als Prozentsatz ausgedrückt wird, wobei perimetrisch normal 100 % und perimetrisch blind 0 % bedeutet. Bei der Berechnung des VFI werden zentrale Punkte stärker gewichtet als periphere Punkte. Er liefert einen Score für ein individuelles Gesichtsfeld und wird in der Progressionsanalyse verwendet.2
Der Glaukom-Halbfeldtest (GHT) vergleicht die relative Sensitivität der Musterabweichungswerte von fünf Zonen im oberen und unteren Halbfeld. Jede dieser Zonen wird mit ihrer Spiegelzone im gegenüberliegenden Halbfeld verglichen, und beide Zonen werden mit der normativen Datenbank verglichen. Der GHT kann glaukomatöse Gesichtsfeldausfälle mit hoher Sensitivität und hoher Spezifität anhand von fünf möglichen Kategorien erkennen: außerhalb der normalen Grenzen, grenzwertig, allgemeine Verringerung der Sensitivität, abnorm hohe Sensitivität und innerhalb der normalen Grenzen.
Interpretation
Die Ermittlung eines zuverlässigen Ausgangsgesichtsfeldes ist für die Glaukombehandlung und die künftige Überwachung einer möglichen Progression von entscheidender Bedeutung. Kliniker sollten mindestens zwei reproduzierbare Ausgangsgesichtsfelder erhalten, um kleinere Veränderungen zu erkennen. Um eine Progression zu erkennen, insbesondere nach einer Eskalation der Therapie zu Zeiten der Progression, muss der Arzt einen neuen Ausgangswert ermitteln.
Fall 3. Parazentraler Glaukomdefekt
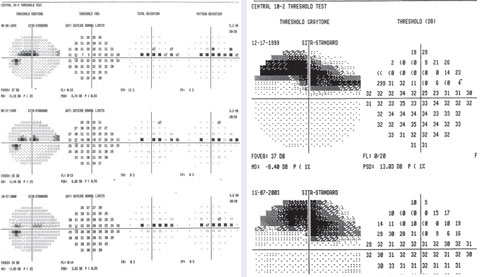
Ein Beispiel für variable Punkte im superioren parazentralen Skotom auf 24-2 mit einem fokalen tiefen Defekt auf 10-2.
Gesichtsfelder, die vor der aktuellen medikamentösen oder chirurgischen Behandlung oder während eines längeren Zeitraums, in dem die Behandlung nicht fortgesetzt wurde, erstellt wurden, sollten nicht zur Bestimmung der Progression verwendet werden. Kliniker sollten die neuen Ausgangsgesichtsfelder, die nach diesen Behandlungsänderungen durchgeführt wurden, und jedes weitere Gesichtsfeld zur Beurteilung der Progression verwenden.
Eine zuverlässige und repräsentative Ausgangsbasis ist auch für Programme zur Analyse des Fortschreitens wichtig. Die Gesichtsfelder weisen tendenziell eine höhere Variabilität mit exzentrischerer Lage und mittleren Empfindlichkeiten auf, und langfristige Schwankungen erschweren die Beurteilung der Progression. Sensibilitätspunkte im mittleren Bereich sind tendenziell variabel, während die Testwerte im oberen und unteren Sensibilitätsbereich stabiler sind. Die Ermittlung eines zuverlässigen, reproduzierbaren Ausgangsgesichtsfeldes kann dazu beitragen, einige dieser Probleme zu beseitigen.
Nichtglaukomatöse Optikusneuropathien
Gesichtsfelder können helfen, Läsionen zu beurteilen, die die Sehbahn beeinträchtigen, Grundlinien festzulegen und als Screening-Instrumente für bestimmte Medikamente zu dienen, die mit Optikusneuropathien in Verbindung stehen. Sie können auch das Fortschreiten oder Wiederauftreten von Krankheiten überwachen und dabei helfen, Behandlungsentscheidungen zu treffen, und sogar bei der Lokalisierung von Läsionen helfen.5 Die häufigste Gesichtsfeldmanifestation einer nicht-glaukomatösen Optikusneuropathie ist ein zentraler Defekt. Je größer das Skotom ist, desto größer ist die Wahrscheinlichkeit, dass die Sehschärfe reduziert ist (Tabelle 1).
Netzhauterkrankungen
Sehfelddefekte, die durch Netzhauterkrankungen verursacht werden, haben in der Regel gut definierte, scharfe Grenzen, die tiefer erscheinen als die meisten Glaukomdefekte und weniger variabel sind.2 Häufige Erkrankungen, die den Makulabereich betreffen, wie z. B. die altersbedingte Makuladegeneration und die zentrale seröse Chorioretinopathie, können zu zentralen Skotomen führen, die je nach Ausmaß der Schädigung bei der 10-2- sowie einigen 24-2- und 30-2-Untersuchung zu sehen sind.
Retinitis pigmentosa führt zu peripheren Gesichtsfeldausfällen, die bei fortgeschrittener Erkrankung zu einem Tunnelblick mit nur einer zentralen Insel führen können.
Arterielle Verschlüsse zeigen typischerweise absolute Defektbereiche, wohingegen venöse Verschlüsse flacher und diffuser sein können.2 Diese treten oft zusammen mit einem Glaukom auf, was die Interpretation erschwert.
Chorioretinitis oder damit verbundene Narben können glaukomatöse Defekte mit einem bogen- oder keilförmigen Defekt maskieren. Eine Netzhautablösung führt zu einem relativen Defekt, während die Retinoschisis einen absoluten Defekt aufweist. Diese Zustände sind oft viel peripherer als das, was bei einer konventionellen zentralen Prüfung mit 24-2 oder 30-2 erscheinen würde.
Glaukomdefekte
Ein Defekt kann eine allgemeine oder örtlich begrenzte Verminderung der Empfindlichkeit im Vergleich zur normalisierten Datenbank sein. Allgemeine Defekte werden am häufigsten bei Katarakten beobachtet, können aber auch durch unkorrigierte Brechungsfehler oder Miosis entstehen. Lokalisierte Defekte können nach Größe, Tiefe und Ort weiter beschrieben werden, um die Diagnose zu erleichtern. Ein relativer Defekt liegt vor, wenn die Empfindlichkeit geringer als normal ist oder im Vergleich zu anderen Bereichen des Sehfelds reduziert ist, das Sehvermögen jedoch erhalten bleibt. Ein absoluter Defekt liegt vor, wenn der Stimulus bei maximaler Helligkeit präsentiert und nicht gesehen wird.
Glaukomatöse Gesichtsfeldausfälle können zuerst in der nasalen oder in der bogenförmigen Region (Bjerrum-Bereich) auftreten. Diese Defekte können sich vom blinden Fleck um die Makularegion herum erstrecken und abrupt am horizontalen Meridian nasal enden. Frühe glaukomatöse Defekte sind oft lokalisierte relative Skotome (Tabelle 2).
Eine beträchtliche Test-Retest-Variabilität ist das Kennzeichen der von glaukomatösen Gesichtsfeldausfällen betroffenen Gesichtsfeldbereiche. Unterschiedliche Empfindlichkeitsverringerungen, die im selben Bereich, aber nicht immer an denselben Testpunkten auftreten, gehen häufig konsistenten glaukomatösen Gesichtsfelddefekten voraus.2 Variabilität, wie sie bei falsch-negativen Ergebnissen auftritt, kann ein Hinweis auf Zuverlässigkeit sein, aber größere Mengen an Variabilität werden oft aufgrund der Krankheit selbst beobachtet.
Tabelle 2. Kriterien für glaukomatöse Gesichtsfelddefekte mit hoher Spezifität und Sensitivität13,14
- Cluster von drei oder mehr Nicht-Kantenpunkten auf der Musterabweichung mit p
- GHT außerhalb normaler Grenzen auf zwei aufeinanderfolgenden Feldern
- PSD
- Asymmetrie der MD >1.50dB, die wiederholbar ist und bei klinischem Verdacht15,16
Wenn die Gesichtsfelder unzuverlässig sind, sollten sie wiederholt werden, um eine Basislinie festzulegen, einen Defekt zu bestätigen oder eine vermutete Progression zu bestätigen. In der Regel werden die Gesichtsfelder wegen der Müdigkeit des Patienten, die die Zuverlässigkeit beeinträchtigen kann, nicht am selben Tag wiederholt. Eine sofortige Wiederholung des Gesichtsfeldes ist selten dringend erforderlich, da es sich beim Glaukom im Allgemeinen um eine langsam fortschreitende Optikusneuropathie handelt und die Behandlungsentscheidungen von der Veränderungsrate abhängen.2 Jede Praxis sollte eine bevorzugte Teststrategie und ein Testmuster standardisieren und denselben Test wiederholen, um genauere Vergleiche bei Folgeuntersuchungen zu ermöglichen.10
Progression
Durch die Bewertung von Veränderungen kann der Arzt feststellen, ob der Zustand stabil ist, fortschreitet oder sich verbessert. Das Fortschreiten eines Gesichtsfeldes kann auf eine diffuse Abnahme der Empfindlichkeit zurückzuführen sein, bestehende Defekte können sich vertiefen oder ausweiten oder es können neue Defekte entstehen. Depressive Bereiche schreiten meist voran, bevor neue Bereiche des Gesichtsfelds betroffen sind. Manchmal wird eine anfängliche Zunahme der Gesichtsfeldvariabilität beobachtet, bevor eine Veränderung oder ein Fortschreiten konstant wird. Es ist wichtig zu unterscheiden, ob es sich um eine langfristige Fluktuation oder einen sich verschlechternden Trend handelt. Sobald der Arzt feststellt, dass sich das Gesichtsfeld verschlechtert hat, muss er entscheiden, ob die Veränderung auf ein Glaukom oder eine andere Erkrankung zurückzuführen ist. Statistisch und klinisch signifikante Veränderungen des Gesichtsfeldes ermöglichen es dem Arzt, die notwendigen Änderungen am Behandlungs- und Managementplan des Patienten vorzunehmen.
Der Arzt muss auch abwägen, wie sich die Progressionsrate auf die Lebensqualität des Patienten auswirkt.2 So muss der Arzt beispielsweise bei jüngeren Patienten mit schnellerer Progression und bei monokularen Patienten vorsichtiger sein (Tabelle 3).
Es ist zwar schwierig vorherzusagen, welche Patienten langsam und welche schnell fortschreiten werden, aber sobald eine Progressionsrate im Laufe der Zeit festgestellt wird, sollte die Behandlung des Patienten entsprechend angepasst werden. Ein jüngerer Patient, der Anzeichen für ein schnelles Fortschreiten der Gesichtsfeldausfälle zeigt, benötigt beispielsweise einen aggressiveren Behandlungsplan als ein älterer Patient mit einem langsamen Fortschreiten eines frühen Gesichtsfeldausfalls. Es ist sinnvoll, dass die Behandlung und das Management der Patienten auf der Grundlage ihres spezifischen klinischen Bildes, einschließlich des Gesichtsfeldausfalls und der Progressionsrate, personalisiert werden. Die Forschung hat gezeigt, dass, wenn die Progressionsrate bestimmt und keine Behandlungsänderung eingeleitet wird, frühere Progressionsraten Vorhersagen über künftige Raten treffen können.10,11 Gleichzeitig können die Rückgangsraten durch eine Eskalation der Therapie verändert werden. Sobald ein Eingriff vorgenommen wird, sollte ein neuer Ausgangswert ermittelt werden.
Tabelle 3. Vorschläge zur Beurteilung der Progression
- Drei Punkte in einem anormalen Bereich verringern sich um 10dB*
- Zwei neue Punkte, in der Nähe eines Defekts um 10dB verringert*
OR
- Zwei Punkte in zentralen 15 Grad oder drei außerhalb von 15 Grad um 10dB verringert*
OR
- Statistische Vergleiche (p
*auf zwei oder mehr aufeinanderfolgenden Feldern14,17
Die Bewertung von Veränderungen im Laufe der Zeit ist für die Glaukombehandlung von entscheidender Bedeutung. Mit der GPA-Software (Guided Progression Analysis), die auf dem HFA zu finden ist, werden zwei Ausgangsgesichtsfeldtests ermittelt. Nachfolgende Gesichtsfeldtests werden dann anhand der Musterabweichungswerte mit der gemittelten Basislinie verglichen. Wenn sich die Folgewerte in einem Maße verschlechtern, das größer ist als die Variabilität einer alters- und defektangepassten Population stabiler Glaukompatienten, wird der Punkt identifiziert. Bleibt die Veränderung bei aufeinanderfolgenden Wiederholungstests bestehen, werden die Punkte als möglicherweise (zwei aufeinanderfolgende) oder wahrscheinlich (drei oder mehr aufeinanderfolgende Felder) markiert.
Die GPA verwendet sowohl die Trend- als auch die Ereignisanalyse, um den Arzt bei der Identifizierung und Quantifizierung der Progression des Gesichtsfeldes zu unterstützen. Bei der Ereignisanalyse wird nach einer statistisch signifikanten Veränderung eines Punktes oder einer Gruppe von Punkten gesucht, während die Trendanalyse die Richtung der Veränderung im Laufe der Zeit oder die Veränderungsrate, einschließlich zukünftiger Prognosen, quantifiziert. Kliniker können ihre Aufmerksamkeit auf die mögliche Unterschätzung diffuser Verluste, subtile Artefakte, die mit Musterabweichungen verbunden sein können, und die Notwendigkeit einer ausreichenden Anzahl qualitativ hochwertiger Gesichtsfelder (mindestens fünf) für eine optimale Analyse richten. Der GPA wird jedoch weniger durch den Grauen Star beeinflusst als andere Analyseverfahren. Jede Teststrategie verwendet ihre eigene normative Datenbank.2 Ein zusätzliches Ziel ist es, eine Progressionsrate zu ermitteln und die Patienten herauszufiltern, die schnell fortschreiten und eine zunehmend aggressive Therapie benötigen.
Progression bei nicht-glaukomatösen Sehnervenerkrankungen
Da die GPA speziell für die Behandlung des Glaukoms entwickelt wurde, müssen Kliniker bei der Bewertung einer möglichen Progression bei nicht-glaukomatösen Erkrankungen einen anderen Ansatz wählen. Eine Regressionsanalyse der VFI oder der mittleren Abweichung sowie ein Übersichtsbericht über Serien können bei der Beurteilung anderer Erkrankungen hilfreich sein.2
Nachuntersuchung
Die gleiche Teststrategie und das gleiche Testmuster ermöglichen einen leichteren Vergleich und eine bessere Überwachung der Progression. Die Nachbeobachtung etablierter Glaukompatienten mit Perimetrie ist wichtig, um festzustellen, ob die derzeitige Behandlung angemessen ist oder ob eine Änderung der Behandlung aufgrund der Stabilität oder des Fortschreitens des Gesichtsfeldes erforderlich ist.
Die Häufigkeit der Nachuntersuchungen hängt vom Ausmaß der Erkrankung und dem klinischen Verlauf ab. Bei Patienten, die sich als stabil erweisen, kann das Nachsorgeintervall sinnvollerweise verlängert werden.
Artefakte
Es gibt mehrere Artefakte, die auftreten können und die Interpretation der Gesichtsfelder erschweren. Der Arzt muss zwischen echten Gesichtsfelddefekten aufgrund von Pathologien, die mit dem klinischen Bild korrelieren, und Artefakten, die auftreten können, unterscheiden. Wenn nicht klar ist, ob es sich um einen echten Gesichtsfelddefekt oder ein Artefakt handelt, sollte das Gesichtsfeld in einer angemessenen Zeitspanne wiederholt werden, die sich nach dem Grad des Verdachts und dem klinischen Bild richtet. Zu den Artefakten, auf die man achten sollte, gehören:
– Augenlid- und Brauenpontose. Dies kann zu einem dichten superioren Defekt entlang der superioren Randpunkte führen. Bei Patienten mit visuell signifikanter Ptosis kann es von Vorteil sein, wenn die Augenlider zur Prüfung abgeklebt werden.
– Randartefakte. Die Positionierung des Probelinsenhalters kann zu einem Randskotom führen, wenn er zu weit vom Auge des Patienten entfernt ist, wodurch ein vollständiges oder teilweises Ringskotom entsteht.
– Falscher Brechungsfehler. Dies kann zu einer allgemeinen Verminderung der Empfindlichkeit führen, die die eines Katarakts imitieren kann. Ein hoher Brechungsfehler kann zu einem Vergrößerungs- oder Verkleinerungseffekt führen und erfordert eine korrekte Berechnung des Scheitelabstands. Zwei häufige Fehler sind die Verwendung des falschen Linsenstärkezeichens oder die Nichtberücksichtigung des neuen Brechungsfehlers nach einer Kataraktoperation.
– Ermüdung des Patienten. Dies kann sich in längeren Testzeiten, hohen falsch-negativen Werten oder bevorzugt abnormaler peripherer Empfindlichkeit äußern. Periphere Punkte werden im späteren Verlauf des Tests getestet und können bei Ermüdung oder nachlassender Aufmerksamkeit deutlich reduziert sein, was zu einem dunkleren, lobulären Ring- oder Kleeblattmuster auf der Grauskala führt.
Eine Lernkurve existiert sowohl für Patienten als auch für die Testdurchführenden. Das Wissen um diese häufig auftretenden Artefakte ermöglicht eine bessere Interpretation des Gesichtsfeldes und die Erkennung von Einschränkungen der Zuverlässigkeit und Qualität der Testergebnisse.
Warum wir testen
Das Verständnis der Sehbahn kann dem Anbieter wertvolle Einblicke in die Lokalisierung von Läsionen geben. Jede Praxis sollte eine bevorzugte Teststrategie und ein Testmuster standardisieren und denselben Test bei Nachuntersuchungen wiederholen, um genauere Vergleiche während der gesamten Nachuntersuchung zu ermöglichen.18
Die Behandlung eines Glaukoms sollte sich darauf konzentrieren, den Verlust von Gesichtsfeldern in dem Maße zu verhindern, in dem er die Lebensqualität des Patienten beeinträchtigt. Es ist wichtig, das gesamte klinische Bild zu bewerten, um sicherzustellen, dass die Variablen miteinander korrelieren und übereinstimmen. Wenn Unsicherheiten bestehen, sollten die Tests wiederholt werden, um zuverlässigere Ausgangsmessungen zu erhalten und eine mögliche Progression zu bestätigen.
Dr. Draskovic und Dr. McSoley sind Optometristen am Bascom Palmer Eye Institute.
1. Lens A, Langley T, Nemeth SC, Shea C. Visual Pathway. In: Ocular Anatomy and Physiology. Thorofare, NJ: SLACK; 1999:90-5.
2. Heijl A, Patella VM, Bengtsson B. The Field Analyzer Primer: Effective Perimetry. 4th ed. Carl Zeiss Meditec; 2012.
3. Park HY, Hwang BE, Shin HY, Park CK. Klinische Anhaltspunkte zur Vorhersage des Vorhandenseins eines parafovealen Skotoms im Humphrey 10-2 Gesichtsfeld unter Verwendung eines Humphrey 24-2 Gesichtsfeldes. Am J Ophthalmol. 2016;161:150-9.
4. Ehrlich AC, Raza AS, Ritch R, et al. Modifying the conventional visual field test pattern to improve the detection of early glaucomatous defects in the central 10°. Transl Vis Sci Technol. 2014 Oct;3(6):6.
5. Kedar S, Ghate D, Corbett JJ. Visual Fields in Neuro-Ophthalmology. Indian Journal of Ophthalmology. 2011;59(2):103-9.
6. Wall M, George D. Idiopathic intracranial hypertension. A prospective study of 50 patients. Brain. 1991;114:155-80.
7. Keltner JL, Johnson CA, Spurr JO, Beck RW. Baseline visual field profile of optic neuritis. The experience of the optic neuritis treatment trial. Studiengruppe für Optikusneuritis. Arch Ophthalmol. 1993;111:231-4.
8. Hayreh SS, Zimmerman B. Visual field abnormalities in nonarteritic anterior ischemic optic neuropathy: their pattern and prevalence at initial examination. Arch Ophthalmol. 2005;123:1554-62.
9. Hayreh SS. Posteriore ischämische Optikusneuropathie: klinische Merkmale, Pathogenese und Behandlung. Eye (Lond). 2004;18:1188–206.
10. Bengtsson B. Vorhersage des glaukomatösen Gesichtsfeldausfalls durch Extrapolation linearer Trends. Arch Ophthalmol. 2009;127(12):1610-5.
11. Heijl A. Senkung des Augeninnendrucks und Glaukomprogression. Arch Ophthalmol. 2002;120(10):1268-79.
12. Willmore LJ, Abelson MB, Ben-Menachem E, et al. Vigabatrin: 2008 update. Epilepsia. 2009;50:163–73.
13. Katz J, Sommer A, Gaasterland DE, Anderson DR. Ein Vergleich von Analysealgorithmen zur Erkennung glaukomatöser Gesichtsfeldausfälle. Arch Ophthalmol. 1991;109(12):1017-25.
14. Hodapp E, Parrish RK II, Anderson DR. Clinical decisions in glaucoma. St. Louis: The CV Mosby Co;1993:52-61.
15. Feuer WJ, Anderson DR. Statische Schwellenasymmetrie bei frühen glaukomatösen Gesichtsfeldausfällen. Ophthalmology. 1989;96:1285-97.
16. Brenton RS, Phelps CD, Rojas P, Woolson RF. Interokulare Unterschiede des Gesichtsfeldes bei Normalpersonen. Invest Ophthalmol Vis Sci. 1986;27:799-805.
17. Anderson DR, Chauhan B, Johnson C, et al. Criteria for progression of glaucoma in clinical management and in outcome studies. Am J Ophthalmol. 2000;130(6):827-29.
18. Weinreb RN. Progression of Glaucoma: The 8th Consensus Report of the World Glaucoma Association. Amsterdam: Kugler Publications; 2011.