Låt oss se på hela bilden nu. Det finns en skala för syror och baser precis som för allt annat. Här är ett par definitioner som du bör känna till:
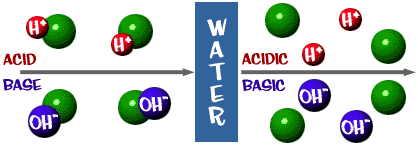
Syra: En lösning som har ett överskott av H+-joner. Det kommer från det latinska ordet acidus som betyder ”skarp” eller ”sur”.
Bas: En lösning som har ett överskott av OH-joner. Ett annat ord för bas är alkali.
Vattenhaltigt: En lösning som huvudsakligen består av vatten. Tänk på ordet akvarium. AQUA betyder vatten.
Stark syra: En syra som har ett mycket lågt pH (0-4).
Stark bas: En bas som har ett mycket högt pH (10-14).
Svaga syror: En syra som endast delvis joniserar i en vattenlösning. Detta innebär att inte alla molekyler bryts sönder. Svaga syror har vanligtvis ett pH nära 7 (3-6).
Svaga baser: En bas som bara delvis joniseras i en vattenlösning. Detta innebär att inte alla molekyler bryts sönder. Svaga baser har vanligtvis ett pH nära 7 (8-10).
Neutral: En lösning som har ett pH på 7. Den är varken sur eller basisk.
Vi berättade om den där killen Arrhenius och hans idéer om koncentrationer av väte- och hydroxidjoner. Du ska också lära dig om Brønsted-Lowrys idéer. Dessa två kemister från Danmark och England såg på syror som donatorer och baser som acceptörer. Vad var det som de donerade och accepterade? Vätejoner. Det påminner mycket om den första definitionen vi gav, där en syra bryts upp och släpper/avger en vätejon. Denna nyare definition är lite mer detaljerad. Forskarna använde den nya definitionen för att beskriva fler baser, till exempel ammoniak (NH3). Eftersom baser är protonacceptorer, när ammoniak sågs acceptera ett H+ och skapa en ammoniumjon (NH4+), kunde den betecknas som en bas. Man behövde inte längre oroa sig för hydroxidjoner. Om den fick H+ från en vattenmolekyl var det vattnet (H2O) som var protongivaren. Betyder det att vattnet var syran i den här situationen? Ja.
En kemist vid namn Lewis erbjöd ett tredje sätt att se på syror och baser. Istället för att titta på vätejoner tittade han på elektronpar (minns du våra bilder med punktstrukturer i Atomer och grundämnen?). Enligt Lewis synsätt tar syror emot elektronpar och baser avger elektronpar. Vi vet att båda dessa beskrivningar av syror och baser använder helt motsatta termer, men tanken är densamma. Vätejoner vill fortfarande acceptera två elektroner för att bilda en bindning. Baser vill ge bort dem. Sammantaget kunde Lewis definition klassificera ännu fler föreningar som syror eller baser.
Vad händer egentligen?
Vad händer egentligen i dessa lösningar? Det blir lite knepigt här. Låt oss titta på upplösningen av molekyler i vattenhaltiga (vattenbaserade) lösningar en gång till för säkerhets skull. Syror är föreningar som dissocierar (bryts) till vätejoner (H+) och en annan förening när de placeras i en vattenlösning. Minns du exemplet med ättiksyra? Baser är föreningar som bryts upp till hydroxidjoner (OH-) och en annan förening när de placeras i en vattenlösning. Vi kommer att tala om bakpulver om några stycken.
Låt oss ändra formuleringen lite. Om du har en jonisk/elektrovalent förening och lägger den i vatten kommer den att brytas sönder i två joner. Om en av dessa joner är H+ är lösningen sur. Den starka syran väteklorid (HCl) är ett exempel. Om en av jonerna är OH- är lösningen basisk. Ett exempel på en stark bas är natriumhydroxid (NaOH). Det finns andra joner som bildar sura och basiska lösningar, men vi kommer inte att tala om dem här.
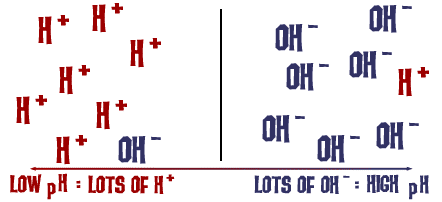
Den pH-skala vi pratade om är faktiskt ett mått på antalet H+-joner i en lösning. Om det finns många H+-joner är pH mycket lågt. Om det finns många OH-joner i förhållande till antalet H+-joner är pH högt.
Tänk över den här idén en stund: Varför skulle en vätska med höga halter av NaOH vara mycket basisk men samtidigt farlig? Na-OH-bindningen bryts i lösningen och du har natriumjoner (positiva) och hydroxidjoner (negativa). Natriumjonerna utgör egentligen ingen fara i lösningen, men det finns ett enormt antal hydroxidjoner i lösningen jämfört med de vätejoner som kan flyta runt som H3O+ (en hydroniumjon) Alla dessa överflödiga OH-joner gör att pH-värdet blir superhögt, och lösningen reagerar lätt med många föreningar. Samma sak händer i en mindre farlig skala när du tillsätter bakpulver till vatten. Under dissociationen frigörs OH-joner och kolsyra i lösningen. Antalet OH-joner är större än antalet H3O+-joner (H+ och H2O) och pH stiger. Det är bara inte en lika stark skillnad som i natriumhydroxid.
Det är i princip allt. (Ha ha! Fattar du?)
Mer information i del ett.
Relaterad video…
Encyclopædia Britannica: Baser
Wikipedia: Syror
Wikipedia: Syror
Wikipedia: Encyclopedia.com: Syror: Syror
Syror
Encyclopedia.com: Syror
Encyclopedia.com: Baser
Encyclopedia.com Baser