US Pharm. 2014;39(3):HS2-HS8.
ABSTRAKT: Toxicita paracetamolu je jednou z nejčastějších příčin úmyslných i neúmyslných otrav ve Spojených státech. Stala se nejčastější příčinou akutního selhání jater a druhou nejčastější příčinou selhání jater vyžadujícího transplantaci. Paracetamol je často doporučován lékaři a vysoce využíván pacienty v přípravcích na lékařský předpis i volně prodejných přípravcích při různých stavech. Úřad FDA dlouhodobě aktualizuje svá doporučení týkající se užívání paracetamolu, aby pomohl zvýšit bezpečnost pacientů. V tomto článku je uveden přehled etiologie, příznaků a symptomů toxicity paracetamolu a role lékárníka v prevenci zneužívání paracetamolu.
Paracetamol je často doporučován lékaři a vysoce využíván pacienty v přípravcích na předpis i volně prodejných přípravcích na různé stavy, což z něj nepochybně činí jeden z nejčastějších léků, se kterými se lékárníci setkávají.1-3 Ve Spojených státech 40 % dospělé populace uvedlo, že paracetamol bez předpisu užívá měsíčně, a 23 % dospělé populace uvedlo, že paracetamol bez předpisu nebo na předpis užívá týdně.1,2
Paracetamol (paracetamol nebo APAP) má analgetické a antipyretické vlastnosti podobné jako aspirin, ale minimální protizánětlivé vlastnosti.4 Je indikován při mírné až středně silné bolesti nebo horečce a v doporučených dávkách není spojen se žaludečními obtížemi nebo krvácením. Při vhodném užívání má velmi dobře zavedený profil bezpečnosti a účinnosti.5 Častým důsledkem nadměrné konzumace je však hepatotoxicita, která může vyústit v řadu problémů, včetně poruch jaterních funkcí, akutního jaterního selhání, a dokonce i smrti.6
Toxicita paracetamolu je jednou z nejčastějších příčin úmyslných i neúmyslných otrav v USA, přičemž v posledním desetiletí dochází k trvalému nárůstu výskytu toxicity související s paracetamolem.7,8 To je pravděpodobně způsobeno širokou dostupností paracetamolu jako samostatné složky i v kombinaci s jinými volně prodejnými léky a léky na předpis v různých koncentracích a složeních. Předávkování paracetamolem je příčinou přibližně 56 000 návštěv pohotovosti, 26 000 hospitalizací a více než 450 úmrtí ročně.9 Jaterní toxicita způsobená paracetamolem se stala nejčastější příčinou akutního selhání jater a druhou nejčastější příčinou selhání jater vyžadujícího transplantaci.10,11 Proto je nezbytné, aby lékárníci rozpoznali známky a příznaky předávkování a toxicity a poradili svým pacientům ohledně správného dávkování a užívání.
Farmakokinetika
Po požití se paracetamol rychle vstřebává z gastrointestinálního traktu (GIT) a rychle se distribuuje do celého těla. Vrcholové plazmatické koncentrace je dosaženo během 30 až 60 minut4; jídlo může dobu dosažení vrcholové koncentrace zpozdit, ale rozsah absorpce není ovlivněn.12 Při předávkování je vrcholové plazmatické koncentrace obvykle dosaženo do 4 hodin.13 Poločas paracetamolu je po terapeutických dávkách přibližně 2 až 3 hodiny, u pacientů s poškozením jater se však může prodloužit na více než 4 hodiny.4,12,14
Paracetamol je rozsáhle metabolizován v játrech třemi hlavními jaterními cestami: glukuronidací, sulfatací a oxidací CYP450 2E1.12 Přibližně 90 % paracetamolu je konjugováno na sulfátované a glukuronidované metabolity, které jsou eliminovány ledvinami14. Ze zbývajícího paracetamolu se přibližně 2 % vylučují močí v nezměněné podobě a zbytek podléhá oxidaci zprostředkované CYP450 za vzniku reaktivního metabolitu, N-acetyl-p-benzochinon iminu (NAPQI).15-18 Za normálních okolností tento toxický metabolit reaguje se sulfhydrylovými skupinami v glutathionu a před vyloučením močí se přemění na neškodné metabolity.4
Toxicita
Léky mohou mít toxické účinky z různých důvodů. Toxicita některých léků souvisí s tvorbou nežádoucího metabolitu; toxicita paracetamolu tedy souvisí s tvorbou NAPQI. Při velkých akutních dávkách nebo při chronickém užívání se hlavní metabolické cesty – glukuronidový a sulfátový konjugační systém – nasytí a více paracetamolu je metabolizováno systémem CYP450. To vede ke zvýšené produkci NAPQI. Když je glutathion vyčerpán přibližně ze 70 %, NAPQI se začne hromadit v hepatocytech, což vede k poškození jater.15,16,18 Proto náhrada glutathionu sloučeninami napodobujícími glutathion, jako je N-acetylcystein, slouží jako užitečné antidotum toxicity paracetamolu.
Toxicita paracetamolu může být důsledkem akutního předávkování nebo chronického nadužívání. Akutní předávkování je definováno jako konzumace toxického množství léku během 8 hodin, zatímco chronické předávkování vzniká v důsledku opakovaných dávek na úrovni doporučeného limitu nebo nad ním.12 K neúmyslnému předávkování může dojít také v důsledku požití více přípravků obsahujících paracetamol. Doporučená dávka paracetamolu u dospělých je 650 až 1 000 mg každých 4 až 6 hodin, přičemž nesmí překročit 4 000 mg za 24 hodin; u dětí je doporučená dávka 10 až 15 mg/kg každých 4 až 6 hodin, přičemž nesmí překročit 50 až 70 mg/kg za 24 hodin.12 Jednotlivé dávky vyšší než 150 mg/kg nebo 7,5 g u dospělých jsou považovány za potenciálně toxické, ačkoli minimální dávka spojená s poškozením jater se může pohybovat od 4 do 10 g.6,12,14,19 U dětí byly s hepatotoxicitou spojeny jednorázové dávky 120 mg/kg až 150 mg/kg, avšak dávky <200 mg/kg pravděpodobně nevedou k toxicitě.14,20
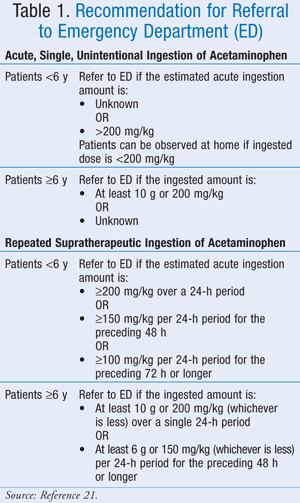
Ačkoli přesná maximální dávka nebyla přesně definována, Americká asociace toxikologických center (AAPCC) doporučila, že bez ohledu na množství požitého léku by měl být pacient předveden k lékařskému vyšetření, pokud se u něj projeví známky nebo příznaky odpovídající toxicitě.21 AAPCC poskytla pokyny pro odeslání do nemocnice jak v případě akutního, jednorázového, neúmyslného požití paracetamolu, tak v případě opakovaného nadměrného požití paracetamolu (TABULKA 1).21
Klinický obraz
Nezávisle na tom, zda k otravě paracetamolem dojde v důsledku jednorázového předávkování nebo po opakovaném supraterapeutickém požití, lze průběh otravy paracetamolem popsat ve čtyřech postupných fázích: preklinické toxické účinky (první fáze), jaterní poškození (druhá fáze), jaterní selhání (třetí fáze) a zotavení (čtvrtá fáze).6,22 U pacientů léčených v preklinické fázi může dojít k přechodnému poškození jater, ale plně se zotaví.22 Pacienti, kteří nejsou léčeni, dokud již není jaterní poškození zjevné, mají různou prognózu; nicméně ti, u nichž dojde k jaternímu selhání, mají úmrtnost 20 až 40 %.22
První fáze nastává několik hodin po požití toxické dávky a trvá 12 až 24 hodin. Je důležité si uvědomit prodlevu ve výskytu příznaků, protože poskytovatelé zdravotní péče by měli pochopit důsledky toxicity, která bude následovat po tomto klidovém období. Příznaky během prvních 24 hodin nejsou diagnostické ani specifické a zahrnují nevolnost, zvracení, diaforézu, anorexii a letargii, jejichž závažnost bude přímo úměrná velikosti požité dávky.8
V druhé fázi, která nastává do 24 až 48 hodin po požití, může dojít k falešnému pocitu zotavení, protože se zlepší nebo vymizí příznaky z oblasti gastrointestinálního traktu.6,8 Nicméně s pokračujícím výskytem hepatotoxicity se může objevit bolest břicha nebo citlivost v pravém horním kvadrantu. Kromě toho začnou laboratorní hodnoty vykazovat známky hepatotoxicity; jaterní enzymy, laktát, fosfát, protrombinový čas a mezinárodní normalizovaný poměr (INR) se dramaticky zvýší.6,8,12 Většina pacientů nepokročí za tuto fázi, zejména pokud je podáno antidotum acetylcystein.8,12
Několik pacientů pokročí do třetí fáze, která se obvykle objeví 3 až 5 dní po požití. Tato fáze je charakterizována opětovným výskytem nebo zhoršením nevolnosti a zvracení doprovázených malátností, žloutenkou a centrálními nervovými příznaky včetně zmatenosti, somnolence a kómatu.6 Může dojít k závažné a případně fatální jaterní nekróze. Ačkoli je to méně časté, v důsledku tubulární nekrózy vyvolané paracetamolem se může projevit renální insuficience, která se projevuje oligurií.6,8,12 Hladiny jaterních enzymů dosáhnou svého maxima a mohou dosahovat až 10 000 IU/l. Projeví se také žloutenka, hypoglykémie, krvácivé a koagulační abnormality a jaterní encefalopatie.8,12 V důsledku komplikací spojených s jaterním selháním, včetně selhání více orgánů, edému mozku a sepse, může dojít k úmrtí.15
Čtvrtá fáze zahrnuje přežití a zotavení, obvykle s návratem plné funkce jater a bez dlouhodobých následků.6 Přibližně 70 % pacientů, kteří vstoupí do čtvrté fáze, se zcela zotaví, zatímco u 1 až 2 % pacientů dojde k fatálnímu jaternímu selhání.6 Těžká neléčená toxicita paracetamolu vyústí v úmrtí do 4 až 18 dnů po požití.6
Pacienti se zvýšeným rizikem
Protože mechanismus toxicity paracetamolu probíhá prostřednictvím tvorby NAPQI, jakékoli faktory, které ovlivňují dostupnost metabolických enzymů, proto ovlivňují toxicitu. Užívání alkoholu, podvýživa a indukce enzymů CYP450 léky, včetně dlouhodobé léčby karbamazepinem, primidonem, rifampinem, efavirenzem a třezalkou tečkovanou, mohou mít vliv na to, jak jedinec reaguje na paracetamol.23 Pacienti ovlivnění některým z výše uvedených faktorů by měli být identifikováni, aby jim lékárníci mohli důkladně poradit, jak bezpečně užívat paracetamol.
Akutně ethanol slouží jako substrát i inhibitor CYP2E1, což omezuje množství vytvořeného NAPQI. Naopak při chronickém užívání alkoholu je ethanol induktorem CYP2E1, což vede k potenciálnímu zvýšení tvorby NAPQI, pokud dojde k předávkování paracetamolem. Dalším důsledkem chronického užívání alkoholu je vyčerpání zásob glutathionu, což snižuje poslední obranu proti tvorbě NAPQI.17 Neexistují žádné důkazy, které by naznačovaly, že užívání paracetamolu v terapeutických dávkách je u alkoholika toxické; proto lze paracetamol v terapeutickém množství bezpečně užívat jak akutně, tak chronicky.23-25
Ačkoli je to kontroverzní, hladovění (dlouhodobé hladovění) a podvýživa jsou dalšími rizikovými faktory toxicity paracetamolu.16,18,23 Podobně jako chronické užívání alkoholu způsobuje podvýživa vyčerpání zásob glutathionu. Existují však také důkazy, že funkce CYP2E1 je u této populace pacientů výrazně snížena. Tyto účinky by se tak vzájemně vyvažovaly a potenciálně by nevedly k žádné změně toxicity.26 Přesto je rozumné takové pacienty identifikovat a upozornit je na jejich zvýšený rizikový potenciál.
Management
Při prezentaci by měl být pacient důkladně vyšetřen. Měla by být získána podrobná nedávná léková anamnéza. Sérové hladiny paracetamolu by měly být v ideálním případě odebrány nejméně 4 hodiny po požití. Farmaceuti mohou hrát důležitou roli tím, že shromáždí relevantní informace, jako je množství užitého léku, požitá léková forma, doba, která uplynula od poslední požité dávky, a zda byly požité nějaké další léky. Všechny tyto faktory jsou důležité při analýze sérových koncentrací paracetamolu.
Pokud se pacient dostaví do hodiny po požití, lze zvážit dekontaminaci žaludku; jedinou doporučenou metodou dekontaminace trávicího traktu je aktivní uhlí. Podání aktivního uhlí lze zvážit zejména u pacientů, kteří požili přípravky paracetamolu s opožděným uvolňováním nebo kteří požili jiné léky, které by zpomalily vstřebávání paracetamolu.12 Vzhledem k rychlé absorpční a distribuční fázi paracetamolu však jinak tato metoda s odstupem času hraje jen malou roli.27-29 Aktivní uhlí by mělo být podáno pouze v případě, že je pacient psychicky při vědomí a má neporušené dýchací cesty. Rovněž je třeba se mu vyhnout u osob se zvýšeným rizikem aspirace, nekontrolovaného zvracení nebo při současném požití žíraviny nebo prokonvulziv.30
Acetylcystein: Základem léčby toxicity paracetamolu je acetylcystein. Tento přípravek doplňuje jaterní zásoby glutathionu a zvyšuje sulfátovou konjugaci, čímž zabraňuje akumulaci NAPQI.31 Acetylcystein může být prospěšný u pacientů s jaterním selháním vyvolaným acetaminofenem, protože zlepšuje hemodynamiku a využití kyslíku, snižuje edém mozku a zlepšuje mitochondriální produkci energie.14,22
Acetylcystein může zabránit jaternímu selhání při předávkování paracetamolem, pokud je podán dostatečně brzy (do 8-10 hodin po akutním předávkování), ale může mít význam ještě do 48 hodin po požití.6,11,14,31 Ke stanovení pravděpodobnosti závažného poškození jater lze využít standardní nomogram toxicity paracetamolu, Rumack-Matthewův nomogram. Je však neúčinný při hodnocení možné toxicity v důsledku vícenásobného požití v průběhu času, když není známa doba požití nebo když dojde ke změně metabolismu.11 S ohledem na tuto skutečnost by měl být acetylcystein podán v každém případě akutního jaterního selhání nebo při jakémkoli průkazu jaterní toxicity, kdy je podezření na předávkování paracetamolem.11
Acetylcystein je k dispozici perorálně i intravenózně; volba závisí na klinickém scénáři.21 Perorální podání může být prospěšné u pacientů s preklinickými toxickými účinky nebo jaterním poškozením, i když přítomnost změněného duševního stavu a zvracení může jeho použití omezovat.22 Dávkovací schéma pro perorální acetylcystein je zaváděcí dávka 140 mg/kg, po které následuje 17 dávek po 70 mg/kg každé 4 hodiny po dobu celkem 72 hodin.11 Pacienti s jaterním selháním by měli dostávat intravenózní léčbu.22 Doporučuje se kontinuální intravenózní infuze v zaváděcí dávce 150 mg/kg intravenózně ve 200 ml D5W podávané po dobu 60 minut, následovaná udržovací dávkou 50 mg/kg po dobu 4 hodin, po níž následuje druhá udržovací dávka 100 mg/kg v 1 000 ml D5W podávaná po dobu 16 hodin.11 Pokud má pacient méně než 40 kg, je třeba upravit množství tekutin podle pokynů, aby se předešlo přetížení tekutinami, hyponatremii a křečím. Pokud se pacientovi daří dobře, ale přesto se po doporučeném dávkování plně nezotavil, lze v léčbě acetylcysteinem pokračovat buď s použitím poslední perorální dávky, nebo s použitím poslední infuzní dávky. V podávání acetylcysteinu by se mělo pokračovat i po překročení délky protokolu, dokud nejsou koncentrace acetaminofenu nedetekovatelné, dokud se AST v séru nenormalizuje nebo výrazně nezlepší a dokud neodezní jakékoli známky jaterního selhání.13
Vzhledem k nepříjemné chuti a zápachu se při perorálním podávání acetylcysteinu často objevuje zvracení.31,32 Nežádoucí účinky spojené s intravenózním podáváním acetylcysteinu zahrnují anafylaktoidní reakce, včetně vyrážky, pruritu, angioedému, bronchospasmu, tachykardie a hypertenze.31,32 Při intravenózním podávání acetylcysteinu si navíc lékárníci musí být vědomi možnosti vzniku chyb v medikaci. Komplikovaný režim, délka léčby a nutnost podávání dávek více zdravotnickými pracovníky na různých místech léčby značně zvyšují riziko chyb.33 Jedna retrospektivní studie zjistila 33% výskyt chyb v medikaci při intravenózní aplikaci acetylcysteinu.33 Nejčastějším typem chyby zjištěným v této studii bylo zpoždění léčby, které může potenciálně snížit účinnost acetylcysteinu. Další častou zjištěnou chybou bylo zbytečné podání acetylcysteinu, což vedlo ke zbytečným nákladům. Je důležité, aby poskytovatelé zdravotní péče konzultovali případy předávkování paracetamolem s toxikologickými centry. Ta mohou poskytnout nejaktuálnější informace o dávkování a protokoly k zajištění správného podání acetylcysteinu.
Označení FDA
V naději na zvýšení bezpečnosti a snížení toxicity FDA dlouhodobě aktualizuje svá doporučení týkající se užívání paracetamolu. Koncem 90. let 20. století výzkum prokázal, že paracetamol je hlavní příčinou akutního selhání jater v USA, přičemž většina případů vznikla v důsledku náhodného předávkování.34 V roce 1998 vydal FDA varovné označení na přípravcích s paracetamolem, které vyzývalo pacienty, kteří konzumují více než tři alkoholické nápoje denně, aby se před použitím tohoto léku poradili s lékařem. Jak roky plynuly a souvislost mezi paracetamolem a jaterní toxicitou se stávala ještě zřejmější, svolal FDA zasedání, aby na základě těchto zjištění jednal. V roce 2002 poradní výbor FDA doporučil, aby bylo na všech přípravcích obsahujících paracetamol uvedeno varování před toxicitou pro játra. V roce 2009 bylo vyvinuto nové značení, které má pacientům pomoci snadno určit, které výrobky obsahují paracetamol, a snížit tak možnost náhodného předávkování. Později bylo na všechny přípravky s paracetamolem na předpis umístěno varování na černém rámečku zdůrazňující potenciální riziko závažného poškození jater a bylo zavedeno varování před vzácnou, ale závažnou anafylaxí a dalšími reakcemi z přecitlivělosti.34
V srpnu 2013 upozornila FDA spotřebitele na vzácné, ale závažné a potenciálně smrtelné kožní reakce, jako je Stevens-Johnsonův syndrom (SJS), toxická epidermální nekrolýza (TEN) a akutní generalizovaná exantematózní pustulóza (AGEP), spojené s užíváním paracetamolu.35 Pacienti by měli být poučeni o příznacích a symptomech kožních reakcí, jako je olupování, tvorba puchýřů, zarudnutí a odlupování kůže, přičemž by měli přerušit další užívání léku a okamžitě vyhledat lékařskou pomoc.
Úřad FDA rovněž oznámil, že od ledna 2014 musí být množství paracetamolu obsaženého v kombinovaných přípravcích na lékařský předpis omezeno na 325 mg v jedné tabletě nebo tobolce.36,37 V květnu 2011 výrobci paracetamolových přípravků, jejichž výdej není vázán na lékařský předpis, dobrovolně oznámili, že jedinou dostupnou koncentrací bude dětská síla tekutého paracetamolu (160 mg/5 ml); koncentrované kapky pro kojence se již vyrábět nebudou.38
Přestože bylo dosaženo pokroku, některé věci se ještě musí vyřešit. Poradní výbor FDA se vyslovil pro mnoho změn, o kterých se předpokládá, že zvýší bezpečnost a sníží toxicitu, přesto FDA dosud nepřijal žádná opatření. Například zatímco maximální denní dávka paracetamolu byla dříve stanovena na 4 g/den, Poradní výbor FDA navrhuje její snížení ve snaze snížit předávkování.37 Je důležité poznamenat, že někteří výrobci již aktualizovali své značení tak, aby tato doporučení zohledňovalo, ačkoli to zatím není povinné. Rovněž je vyvíjeno úsilí o zlepšení značení výrobků, zlepšení vzdělávání pacientů, vytvoření univerzálního pediatrického přípravku, vyloučení kombinovaných přípravků s paracetamolem a snížení síly volně prodejných přípravků s paracetamolem na 325 mg v jedné tabletě s maximální jednorázovou dávkou 650 mg.37 Ačkoli v žádné z těchto otázek nebylo dosaženo konečné shody, poskytovatelé zdravotní péče by měli své pacienty poučit o důležitosti dodržování pokynů na obalu.
Úloha lékárníka
Lékárníci mají možnost účinně podporovat bezpečné užívání paracetamolu. Mnoho pacientů si není vědomo maximální denní dávky paracetamolu a možnosti jeho toxicity.39 Pacienti navíc nemusí chápat, že paracetamol je obsažen ve více než 600 různých přípravcích.39 Všem pacientům, kteří obdrží recept na přípravek obsahující paracetamol, je třeba poradit, aby byli informováni o účinné látce. Lékárníci se musí aktivně podílet na vzdělávání pacientů, kteří si kupují volně prodejné přípravky s obsahem paracetamolu. Lékárníci mají zásadní význam pro prevenci zneužívání paracetamolu tím, že zaručují bezpečné užívání léku prostřednictvím vzdělávání pacientů a kontroly jejich lékové historie.
Lékárníci by navíc měli pacientům doporučit, aby v případě podezření na předávkování paracetamolem kontaktovali národní linku pomoci při otravách. Bezplatné číslo je 1-800-222-1222.40 Zavoláním na toto číslo budou pacienti spojeni s nejbližším regionálním toxikologickým centrem, jehož specialisté jsou k dispozici 24 hodin denně, 7 dní v týdnu. Tito specialisté budou schopni pomoci posoudit a zvládnout případné předávkování paracetamolem. Tyto aktivity budou minimalizovat riziko nevhodného dávkování, duplikace léčby a nevhodného užívání léků.
1. V případě, že se jedná o předávkování, je možné, že se bude jednat o předávkování. Kaufman DW, Kelly JP, Rosenberg L, et al. Recent patterns of medication use in the ambulatory adult population of the United States: the Slone survey (Nedávné vzorce užívání léků v ambulantní dospělé populaci Spojených států: průzkum Slone). JAMA. 2002;287:337-344.
2. Paulose-Ram R, Hirsch R, Dillon C, et al. Prescription and nonprescription analgesic use among the US adult population: results from the third National Health and Nutrition Examination Survey (NHANES III). Pharmacoepidemiol Drug Saf. 2003;12:315-326.
3. Paulose-Ram R, Hirsch R, Dillon C, et al. Frequent monthly use of selected nonprescription and prescription non-narcotic analgesics among U.S. adults. Pharmacoepidemiol Drug Saf. 2005;14:257-266.
4. Burke A, Smyth EM, Fitzgerald GA. Analgetika-antipyretika; farmakoterapie dny. In: Léčivé přípravky pro děti a dospívající: Zprávy o léčbě dny: Brunton LL, Laso JS, Parker K, eds. Goodman and Gilman’s the Pharmacological Basis of Therapeutics. 11. vydání. New York, NY: McGraw-Hill; 2006:671-716.
5. Watkins PB, Kaplowitz N, Slattery JT, et al. Amino-transferase elevations in healthy adults receiving 4 grams of acetaminophen daily: a randomized controlled trial. JAMA. 2006;296:87-93.
6. Chun LJ, Tong MJ, Busuttil RW, et al. Acetaminophen hepatotoxicity and acute liver failure. J Clin Gastroenterol. 2009;43:342-349.
7. Bronstein AC, Spyker DA, Cantilena LR, et al. 2011 annual report of the American Association of Poison Control Centers‘ National Poison Data System (NPDS): 29th annual report. Clin Toxicol. 2012;50:911-1164.
8. Schilling A, Corey R, Leonard M, et al. Acetaminophen: old drug, new warnings. Cleve Clin J Med. 2010;77:19-27.
9. Nourjah P, Ahmad SR, Karwoski C, et al. Estimates of acetaminophen (paracetamol)-associated overdoses in the United States. Pharmacoepidemiol Drug Saf. 2006;15:398-405.
10. Larson AM, Polson J, Fontana RJ, et al. Acetaminophen-induced acute liver failure: results of a United States multicenter, prospective study. Hepatologie. 2005;42:1364-1372.
11. Lee WM, Larson AM, Stravitz T. AASLD position paper: the management of acute liver failure: update 2011. Baltimore, MD: American Association for the Study of Liver Diseases; září 2011. www.aasld.org/practiceguidelines/Documents/AcuteLiverFailureUpdate2011.pdf. Dostupné 15. prosince 2013.
12. Odborné informace o přípravku Tylenol (paracetamol). Fort Washington, PA: McNeil Consumer Healthcare; 2010.
13. Hendrickson RG: Hendrickson RG. Paracetamol. In: Nelson LS, Lewin NA, Howland M, eds. Goldfrank’s Toxicologic Emergencies. 9. vydání. New York, NY: McGraw-Hill; 2011:483-99.
14. Hodgman MJ, Garrard AR. A review of acetaminophen poisoning. Crit Care Clin. 2012;499-516.
15. Larson AM. Acetaminofenová hepatotoxicita. Clin Liver Dis. 2007;11:525-548.
16. Rumack BH. Acetaminofenová hepatotoxicita: prvních 35 let. J Toxicol Clin Toxicol. 2002;40:3-20.
17. Nelson SD. Molekulární mechanismy hepatotoxicity způsobené paracetamolem. Semin Liver Dis. 1990;10:267-278.
18. Lee WH. Hepatotoxicita vyvolaná léky. N Engl J Med. 1995;333:1118-1127.
19. Fontana RJ. Akutní selhání jater včetně předávkování paracetamolem. Med Clin North Am. 2008;92:761-794.
20. Výbor pro drogy Americké pediatrické akademie. Toxicita paracetamolu u dětí. Pediatrics. 2001;108:1020-1024.
21. Dart RC, Erdman AR, Olson KR, et al. Acetaminophen poisoning: an evidence-based consensus guideline for out-of-hospital management. Clin Toxicol. 2006;44:1-18.
22. Heard KJ. Acetylcystein při otravě acetaminofenem. N Engl J Med. 2008;359:285-292.
23. Ferner RE, Dear JW, Bateman DN. Management otravy paracetamolem. BMJ. 2011;342:d2218.
24. Kuffner EK, Dart RC, Bogdan GM, et al. Effect of maximum daily doses of acetaminophen on the liver of alcoholic patients: a randomized, double-blind, placebo-controlled trial. Arch Intern Med. 2001;161:2247-2252.
25. Kuffner EK, Green JL, Bogdan GM, et al. The effect of acetaminophen (four grams a day for three consecutive days) on hepatic tests in alcoholic patients-a multicenter randomized study. BMC Med. 2007;5:13.
26. Rumack BH. Mylné představy o paracetamolu. Hepatologie. 2004;40:10-15.
27. Christophersen AB, Levin D, Hoegberg LC, et al. Activated charcoal alone or after gastric lavage: a simulated large paracetamol intoxication. Br J Clin Pharmacol. 2002;53;312-317.
28. Sato RL, Wong JJ, Sumida SM, et al. Efficacy of super-activated charcoal administration late (3 hours) after acetaminophen overdose. Am J Emerg Med. 2003;21:189-191.
29. Spiller HA, Winter ML, Klein-Schwartz W, et al. Účinnost aktivního uhlí podaného více než čtyři hodiny po předávkování paracetamolem. J Emerg Med. 2006;30:1-5.
30. Chyka PA, Seger D, Krenzelok EP, et al. Position paper: single-dose activated charcoal. Clin Toxicol. 2005;43:61-87.
31. Kozer E, Koren G. Management předávkování paracetamolem: současné kontroverze. Bezpečnost léčiv. 2001;24:503-512.
32. Sandilands EA, Bateman DN. Nežádoucí reakce spojené s acetylcysteinem. Clin Toxicol. 2009;47:81-88.
33. Hayes BD, Klein-Schwartz W, Doyon S. Frequency of medication errors with intravenous acetylcysteine for acetaminophen overdose. Ann Pharmacother. 2008;42:766-770.
34. 29.-30. června 2009: Společné zasedání Poradního výboru pro bezpečnost léčiv a řízení rizik s Poradním výborem pro anestetika a životosprávu a Poradním výborem pro léčivé přípravky bez lékařského předpisu: Informační materiál FDA. Aktualizováno 30. července 2013. www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/DrugSafetyandRiskManagementAdvisoryCommittee/UCM164897.pdf. Dostupné 15. prosince 2013.
35. Sdělení FDA o bezpečnosti léčiv: FDA varuje před vzácnými, ale závažnými kožními reakcemi u léku proti bolesti/horečce paracetamolu. Srpen 1, 2013. www.fda.gov/Drugs/DrugSafety/ucm363041.htm. Přístupné 16. prosince 2013.
36. Sdělení FDA o bezpečnosti léčiv: Prescription acetaminophen products to be limited to 325 mg per dosage unit; boxed warning will highlight potential for severe liver failure. 13. ledna 2011. www.fda.gov/Drugs/DrugSafety/ucm239821.htm. Přístup 16. prosince 2013.
37. Krenzelok EP. Komentář: Zasedání poradního výboru FDA pro acetaminofen. Jaká je budoucnost paracetamolu ve Spojených státech? Pohled člena výboru. Clin Toxicol. 2009;47:784-789.
38. Pappas M, Bryan K. OTC průmysl oznamuje dobrovolný přechod na jednu koncentraci jednosložkových dětských tekutých léků s paracetamolem. Consumer Health Care Products. May 11, 2011. www.chpa.org/05_04_11_PedAcet.aspx. Dostupné 15. prosince 2013.
39. Hornsby LB, Whitley HP, Hester EK, et al. Průzkum znalostí pacientů týkajících se rozpoznávání, dávkování a toxicity paracetamolu. J Am Pharm Assoc. 2010;50:485-489.
40. American Association of Poison Control Centers. www.aapcc.org. Přístup 25. února 2014.
.