- Polillas que se aparean (Tineidae, Ditrysia, Lepidoptera) conservadas como inclusión de comportamiento congelado en el ámbar báltico (Eoceno)
- ABSTRACT
- INTRODUCCIÓN
- MATERIALES Y MÉTODOS
- Paleontología Sistemática
- DISCUSIÓN
- ¿Co-ocurrencia aleatoria o apareamiento conservado?
- Tafonomía
- Dimorfismo sexual
- Hábitat
- CONCLUSIÓN
- ACONOCIMIENTOS
Polillas que se aparean (Tineidae, Ditrysia, Lepidoptera) conservadas como inclusión de comportamiento congelado en el ámbar báltico (Eoceno)
Thilo C. Fischer y Marie K. Hörnig
Número de artículo: 22.1.7
https://doi.org/10.26879/829
Copyright Paleontological Society, February 2019
Biografías de los autores
Abstracts en lengua inglesa y multilingüe
Versión PDF
Presentación: 22 de octubre de 2017. Acceptance: 23 Januiary 2019
{flike id=2421}
ABSTRACT
La investigación de las inclusiones de ámbar proporciona una visión única de la biología de los animales que vivieron hace millones de años, debido a su excepcional preservación en condiciones casi naturales. Esto no sólo es cierto para los aspectos morfológicos, los aspectos del comportamiento también se puede deducir de estos fósiles.
Aquí, Microlepidoptera se reportan desde el ámbar báltico del Eoceno muy probablemente como una primera ocurrencia de Lepidoptera fósil encontrado en cópula. Las polillas pertenecen a Tineidae (las polillas tineidas incluyen las polillas de la ropa) y se describen como una nueva especie y un nuevo género, Forcepsites michalskii. El órgano de sujeción del macho es bastante inusual para las polillas del ámbar báltico, con una parte ventral y otra dorsal, cada una de las cuales termina en dos protuberancias paralelas parecidas a espinas, y aparentemente no está formado por las valvas. La coexistencia de macho y hembra, probablemente en cópula, permitió estudiar directamente su dimorfismo sexual, y hay pruebas de que el hábitat de esta especie es el lugar de producción de resina en el bosque de ámbar báltico. A partir del dimorfismo sexual de las antenas y de la morfología de los ojos se interpreta que la hembra era el sexo llamante para el apareamiento en esta especie.
Thilo C. Fischer. Förderverein der Bayerischen Staatssammlung für Paläontologie und Historische Geologie München Richard-Wagner-Straße 10, D-80333 München, Germany.
Marie K. Hörnig. Universidad de Greifswald, Instituto y Museo Zoológico, Citología y Biología Evolutiva, Soldmannstr. 23, D-17489 Greifswald, Alemania.
Palabras clave: Polillas de la ropa; hábitat en la cópula; Microlepidópteros; nuevas especies y géneros; dimorfismo sexual
Citación final: Fischer, Thilo C, y Hörnig, Marie K. 2019. Polillas de apareamiento (Tineidae, Ditrysia, Lepidoptera) conservadas como inclusión de comportamiento congelado en el ámbar báltico (Eoceno). Palaeontologia Electronica 22.1.7A 1-11. https://doi.org/10.26879/829
palaeo-electronica.org/content/2019/2421-mating-moths
Copyright: Febrero 2019 Sociedad Paleontológica.
Este es un artículo de acceso abierto distribuido bajo los términos de Reconocimiento-NoComercial-CompartirIgual 4.0 Internacional (CC BY-NC-SA 4.0), que permite a los usuarios copiar y redistribuir el material en cualquier medio o formato, siempre que no se utilice con fines comerciales y se acredite al autor y la fuente original, con indicaciones si se realizan cambios.
creativecommons.org/licenses/by-nc-sa/4.0/
http://zoobank.org/BCF64D89-6879-4805-8021-7CE926CE4B12
INTRODUCCIÓN
Los insectos que se aparean se encuentran raramente en el ámbar como casos del llamado «comportamiento congelado» (Arillo, 2007, y referencias en él). Tales han sido reportados del ámbar báltico del Eoceno, por ejemplo de los grupos Diptera, Coleoptera, Hemiptera, Hymenoptera y muy raramente Trichoptera (Weitschat y Wichard, 2002; Weitschat, 2009; Boucot y Poinar Jr., 2010; Gröhn, 2016).
En el ámbar báltico, los Lepidópteros son generalmente raros y ocurren en alrededor de uno en 250 inclusiones (para la comparación: Los dípteros representan alrededor del 64% de todos los insectos en el ámbar báltico, los lepidópteros representan alrededor del 0,4%; Hoffeins y Hoffeins 2003; Gröhn 2016). Al igual que en otros insectos, los imagos conservados en cópula son mucho más raros y aún no se han descrito Lepidoptera in cópula, ni siquiera en otros ámbares o de localidades de insectos no ámbar (Sohn et al., 2012; Sohn y Lamas, 2013). Una ocurrencia en cópula permite la afiliación de buena fe de ambas formas sexuales entre sí y ambas juntas a una especie distinta, y por lo tanto la descripción exacta del dimorfismo sexual de una especie. Alternativamente, el dimorfismo sexual de los insectos fósiles sólo puede estudiarse por medios estadísticos cuando los hallazgos de una especie son abundantes, como en muchos Nematocera (por ejemplo, Borkent, 1995).
Los Tineidae son representantes basales muy divergentes del grupo de lepidópteros Ditrysia (Regier et al., 2014), sus larvas se alimentan de una amplia gama de sustratos (detritus, hongos, líquenes o queratina) (Scoble, 1995), siendo por tanto generalistas (85,7%) (Menken et al., 2009). Como inclusiones de ámbar báltico, los Tineidae representan aproximadamente una cuarta parte de todos los hallazgos de lepidópteros (Skalski, 1977). Aquí se describe una rara y nueva especie de Tineidae con sus formas sexuales a partir de una supuesta ocurrencia in copula.
MATERIALES Y MÉTODOS
El espécimen de ámbar fue encontrado por Artur Michalski (Wroclaw, Polonia) y adquirido por él. Se conservó mediante un tratamiento con barniz acrílico y pertenece a la colección del autor (TF) con el número de colección 7131. Se almacenó a temperatura constante en bolsas de plástico con clip dentro de cajas metálicas, excluyendo el oxígeno y la luz. Será depositada en la Bayerische Paläontologische Staatssammlung München con el número SNSB-BSPG 2017 I 113.
El ejemplar fue fotografiado con una Canon EOS 70d equipada con un objetivo Canon MP-E 65 mm y un Canon Twin Flash MT-24. Para evitar los reflejos, se montaron y ajustaron filtros de polarización delante de los flashes y del objetivo de la cámara (luz polarizada cruzada). Para reducir la convexidad y concavidad de la superficie del ámbar, se aplicó una gota de glicerina y se cubrió con un cubreobjetos. Las pilas de imágenes grabadas se fusionaron con Combine ZP y se procesaron posteriormente con Adobe Photoshop CS 3. La inclusión no pudo ser estudiada por microcomputadora-tomografía, debido a la presencia de inclusiones metálicas, aparentemente piríticas, que causan fuertes artefactos.
Paleontología Sistemática
Sistemática (según van Nieukerken et al, 2011)
Orden LEPIDOPTERA Linnaeus, 1758
Clade DITRYSIA Börner, 1925
Superfamilia TINEOIDEA Latreille, 1810
Familia TINEIDAE Latreille, 1810
Género Forcepsites nov. gen.
zoobank.org/DDB6884D-845A-4A87-981E-A2953ADD8964
Etymology. «Forceps», fórceps en latín, en referencia al órgano de sujeción del macho.
Especie Forcepsites michalskii nov. spec.
zoobank.org/5494D58E-7773-473C-AFB2-140DDD049226
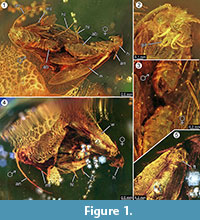 Holotypus. Espécimen ex coll. Fischer no. 7131, Figura 1.2
Holotypus. Espécimen ex coll. Fischer no. 7131, Figura 1.2
Locus typicus. Mina de ámbar de Yantarni, GUS
Stratum typicum. «Blaue Erde» (Eoceno superior – Oligoceno inferior)
Etimología. El nombre de la especie michalskii se elige en reconocimiento a Artur Michalski por proporcionar este espécimen.
Repositorio. Bayerische Staatssammlung für Paläontologie und Geologie, Múnich, Alemania; número de acceso SNSB-BSPG 2017 I 113.
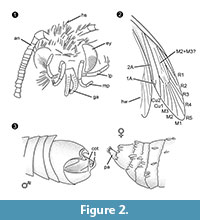
Diagnóstico del género. Género monotípico cuyo carácter definitorio es el órgano de sujeción del macho (Figura 2.3) con una parte ventral y otra dorsal, cada una de ellas terminada en dos protuberancias paralelas parecidas a espinas.
 Diagnosis de la especie. Se determinaron los respectivos caracteres cualitativos y cuantitativos de los imagos femeninos y masculinos (Figura 1), que se resumen en la Tabla 1.
Diagnosis de la especie. Se determinaron los respectivos caracteres cualitativos y cuantitativos de los imagos femeninos y masculinos (Figura 1), que se resumen en la Tabla 1.
Diagnóstico diferencial. La combinación de caracteres probóscide pequeña con galeas separadas, palpos maxilares largos y plegados con cinco segmentos, palpos labiales apuntando hacia arriba y ligeramente doblados con cerdas laterales, cabeza con muchas escamas erectas parecidas a pelos sugieren fuertemente una afiliación a Tineidae, pero ninguno de ellos es apomórfico, ni se conoce actualmente tal apomorfía para Tineidae adultos (Regier et al., 2014). Las venas R4 y R5 no están fusionadas/acolchadas, lo que sería indicativo para Gelechioidea (Gelechiidae y Oecophoridae) (Scoble, 1995), el otro grupo principal de Lepidoptera encontrado en el ámbar báltico. La especie no se parece a ningún representante descrito de Tineidae o de otras familias del ámbar báltico (Rebel, 1934, 1935; Kuznezov, 1941; Skalski, 1973; Kozlov, 1987, 1988; Sohn et al., 2012; Sohn y Lamas, 2013), especialmente con respecto a su aparato genital masculino. Más similar parece Tineosemopsis decurtatus Skalski 1974 (hembra conocida) pero difiere en la ausencia de pelos erectos en el vértice y en sus ojos más pequeños. Tillyardinea eocaenica Kusnezov 1941 (hembra), que tiene escamas erectas en el vértice y una venación similar, difiere en sus frones y palpos labiales. Simulotinea intermedia Skalski 1977 tiene un hábito similar pero también difiere en la presencia de una vena bifurcada, que divide la célula grande en el ala anterior (M2+3).
Tafonomía. El macho y la hembra de Forcepsites michalskii están fosilizados cerca y con la parte posterior del abdomen dirigida el uno al otro. Las dos inclusiones se encuentran en una pieza cilíndrica de ámbar báltico no autoclavado con un diámetro de 15 mm y una altura de 11 mm que está dividida en aproximadamente la mitad de su altura por un borde irregular entre dos capas de flujo de resina. Este borde muestra una capa de pirita como parte de su plano. Un flujo de resina contiene las dos polillas que exponen sus respectivos lados dorsales a este borde. Se conservan largas escamas procedentes del borde del ala de la hembra. El imago femenino ha perdido dos patas y su tórax está dañado. El otro caudal contiene series no lineales de burbujas. Ambos individuos parecen recién salidos, a juzgar por la vestimenta completa de escamas en las alas y por el hecho de que las alas no están desgarradas. No se han podido identificar órganos de olor en las alas, el abdomen o las patas. Las únicas sininclusiones que se conservan de los microlepidópteros son tricomas, típicos del ámbar báltico.
DISCUSIÓN
¿Co-ocurrencia aleatoria o apareamiento conservado?
Las polillas adjuntas son representantes masculinos y femeninos de la misma especie y están dispuestos cerca con los abdómenes orientados el uno hacia el otro. Sin embargo, los genitales de las polillas no están en contacto directo, sino en una posición cercana. La orientación dorsal/ventral de los machos y las hembras difiere ligeramente, lo que se debe a una ligera rotación dentro del eje del cuerpo (especialmente del macho). La orientación de la parte posterior del abdomen de ambas polillas es hacia la otra.
Se conocen varios casos en los que la situación de encierro en la resina aún líquida puede inducir una respuesta de estrés, como la oviposición (Weitschat, 2009). La inducción de la conducta de apareamiento por el flujo de resina no es generalmente plausible, pero la situación de encierro demuestra que fueron posibles ligeros movimientos dentro de la resina fresca.
También está la cuestión de si este hallazgo podría representar también una co-ocurrencia aleatoria. La probabilidad de tal co-ocurrencia aleatoria puede ser estimada aproximadamente. Entre las inclusiones de insectos, las polillas aparecen con una frecuencia de aproximadamente una de cada 250 inclusiones en el ámbar báltico (Krzeminskaet al., 1991 (0,6%); Hoffeins y Hoffeins, 2003 (0,4%); Sontag, 2003 (0,27%), y observación propia). Dado un ámbar individual con una polilla incluida, la probabilidad de co-ocurrencia aleatoria de otra polilla es simplemente de 1:250 (las polillas no se presentan en enjambres). La co-ocurrencia del mismo taxón, o de uno abundante que podría confundirse, se estima en 1:10 en el mejor de los casos (Skalski, 1977), y otra de aproximadamente 1:2 por tener sexos diferentes. Teniendo en cuenta las posibilidades adicionales de una disposición cercana, tanto de la alineación de los ejes corporales, como de una orientación corporal adecuada, la probabilidad de una co-ocurrencia aleatoria que podría ser interpretada erróneamente como un evento de apareamiento es mucho menor que la frecuencia observada como una de cada 920 inclusiones de lepidópteros en la colección del autor estudiado.
En conclusión, la interpretación más probable para este hallazgo es que las polillas estaban en cópula, y los genitales habían estado en contacto pero los individuos estaban ligeramente distraídos el uno del otro debido al flujo de resina (ver discusión más abajo).
Tafonomía
La relevancia del análisis cuidadoso de los flujos de resina para la tafonomía de las inclusiones de ámbar ha sido demostrada por Coty et al. (2014) con su estudio de una interacción entre hormigas y termitas preservada en el ámbar de Chiapas mexicano.
La ocurrencia de un evento in copula está fuertemente apoyada por el hallazgo de largas escamas derivadas del borde del ala de la hembra, que se desviaron por alguna distancia en dirección al macho. Esto podría indicar un fuerte flujo de resina laminar en este lugar que se movió a lo largo de su eje común, y podría haberlos separado por la corta distancia observada ahora. Durante el apareamiento de las polillas, el macho puede perder el contacto con el lugar de apareamiento y puede estar fijado a la hembra sólo por el órgano de sujeción, y sólo la hembra hace contacto con la superficie. Este comportamiento y el arrastre por el flujo repentino de resina podrían ser la razón por la que la hembra ha perdido sus dos patas traseras. En la parte dorsal de las polillas, que había quedado expuesta en la superficie convexa de este primer flujo laminar de resina, el ala de la hembra y su tórax subyacente están parcialmente dañados (Figura 1.5). Se supone que estas zonas destruidas representan huellas de alimentación causadas por otros insectos, muy probablemente hormigas, como se observa a menudo en los especímenes de ámbar. Por lo tanto, después del primer flujo de resina como evento de incrustación, los lados dorsales habrán estado expuestos durante algún tiempo, lo suficiente como para permitir a los depredadores caminar sobre esta superficie sólida. El segundo flujo de resina, que cubrió esta cara más tarde, podría haber sido un flujo rápido y turbulento de resina, como indican una serie de pequeñas burbujas dispuestas en curvas irregulares encontradas en su interior. Este sería un proceso tafonómico típico para un llamado «Schlaube» de ámbar báltico (Gröhn, 2016).
Dimorfismo sexual
El dimorfismo sexual es difícil de observar en las especies fósiles, de las que normalmente solo se conocen unos pocos ejemplares. Los caracteres no influenciados por el sexo tienen que ser diagnósticos para permitir la determinación segura de las especies como base para la posterior diferenciación entre los sexos y la elucidación del dimorfismo sexual. Considerando las especies existentes con gran dimorfismo sexual, por ejemplo, con hembras braquipétalas como en muchos Psychidae (Scoble, 1995), una inferencia de que ambos sexos pertenecen a una especie sería difícilmente posible. Por lo tanto, sólo se pueden reconocer de forma fiable los casos de dimorfismo sexual débil en las especies fósiles por medios estadísticos y sin encontrarlos en la cópula. Esto subraya la importancia del comportamiento de apareamiento identificado en las especies fósiles para la descripción de tales casos de dimorfismo sexual fuerte. Tales hallazgos conservados de apareamiento fósil también pueden aprobar la correlación de formas sexualmente dimórficas previamente conocidas para pertenecer a una especie, incluso sin la posibilidad de mucho apoyo estadístico. Existe alguna posibilidad de que un evento de apareamiento conservado pueda representar un apareamiento interespecífico o intergenérico, como se conoce en polillas y mariposas (Ganyard y Brady, 1972; Deering y Scriber, 2002). Sin embargo, estos fenómenos son mucho menos abundantes que el apareamiento intraespecífico y es poco probable que se encuentren como una rara inclusión fósil.
Un dimorfismo sexual no alométrico observado en Forcepsites michalskii es la separación de las galeas en la probóscide del macho. Esto puede aludir a un estado no funcional, ya que los machos de esta especie no se alimentan, como se observa en muchos Psychidae existentes (machos) con probóscide vestigial o ausente (Scoble, 1995). Los dimorfismos sexuales alométricos encontrados aquí son: (1) La hembra es mayor que el macho, tanto en tamaño corporal como en longitud de las alas. Sin embargo, las relaciones respectivas son casi iguales. (2) En la hembra el abdomen es relativa y absolutamente más ancho en comparación con el macho. (3) Las antenas del macho son mucho más grandes y gruesas que las de la hembra. En varias especies existentes las antenas son sexualmente dimórficas (Scoble, 1995), las antenas masculinas bien desarrolladas sirven para la quimiosensación de las feromonas femeninas. (4) Los palpos maxilares del macho son dos veces más gruesos que en la hembra y tienen una estructura acanalada. (5) Los ojos del macho también son más grandes, pero el número de omatidios es aproximadamente el mismo. Los ojos más grandes sólo reciben más luz y podrían ser más sensibles; sin embargo, la resolución sería la misma.
El reconocimiento de largo alcance de las polillas hembras que llaman tiene lugar a través de los quimiorreceptores del macho, mientras que el reconocimiento de corto alcance se basa en cambio en la identificación visual (Groot, 2014). En Forcepsites michalskii, también parece que la hembra era el sexo que llamaba -según sugiere el aparato antenal y los ojos más grandes del macho.
Hábitat
En base a la discusión presentada anteriormente, está claro que los individuos capturados en la cópula sólo pueden ocurrir en el lugar donde esta especie vivió y se apareó. Los individuos sueltos pueden ser arrastrados por el viento o visitar lugares sin hábitat, como los insectos acuáticos que raramente se encuentran en el ámbar del Báltico (Wichardet al., 2009); en cambio, los individuos que se aparean difícilmente podrían hacerlo sin separarse. No parece haber pruebas en la literatura sobre el apareamiento de polillas en vuelo. En cambio, en la mayoría de los lepidópteros y en los microlepidópteros (polillas) predominantemente nocturnos, las hembras «llaman» a los machos mediante feromonas, determinando así los lugares de apareamiento (Groot, 2014). Pueden volar antes del apareamiento, pero en la mayoría de los casos parecen ser sésiles y abanicarse para la distribución de feromonas. Sin embargo, los sexos que llaman o buscan también pueden ser inversos en algunos taxones, pero en el caso de los Tineidae se informa que la hembra es el sexo que llama (Wagner y Rosovsky, 1991; Scoble, 1995). En cualquier caso, el sitio de flujo de resina, es decir, el biotopo con los árboles productores de ámbar, muy probablemente fue también el hábitat de la polilla de la ropa descrita aquí.
CONCLUSIÓN
Se describe una polilla tineoidea con un notable aparato genital masculino como la nueva especie y género Forcepsites michalskii del ámbar báltico del Eoceno. La hembra y el macho se conservan juntos en posición cercana y con el abdomen orientado el uno hacia el otro, lo que sugiere que estas polillas quedaron atrapadas en la resina fresca durante el apareamiento. Un fuerte flujo de resina laminar, indicado por varias partes del cuerpo de la hembra desviadas, podría haberlas separado a la corta distancia que se observa ahora. Este espécimen podría, por tanto, representar el primer ejemplo de lepidóptero fósil capturado en cópula.
Se supone que Forcepsites michalskii era una especie que vivía en el bosque, ya que los individuos capturados en cópula sólo pueden documentarse del lugar donde esta especie vivía y se apareaba.
Las hembras y los machos de F. michalskii muestran dimorfismos sexuales en el tamaño del cuerpo, la longitud de las alas, la proporción del abdomen, el tamaño de los ojos compuestos y la morfología de los palpos maxilares, así como de las antenas. Basándose en las antenas claramente más grandes y gruesas del macho, así como en sus ojos más grandes, se sugiere que la hembra podría ser el sexo llamante en esta especie, como también se ha informado para las especies de Tineidae existentes.
ACONOCIMIENTOS
A. Michalski (Wroclaw, Polonia) por haber proporcionado este excepcional espécimen y haber llamado nuestra atención sobre él. M. Schwarz del Oberösterreichisches Landesmuseum (Linz, Austria) apoyó amablemente el examen de su colección de lepidópteros. MKH fue amablemente financiado por una beca de la Studienstiftung des deutschen Volkes y agradece a S. Harzsch (Greifswald, Alemania) su apoyo. Agradecemos los valiosos comentarios científicos de M. Heikkilä y C. Haug (Múnich, Alemania) sobre el manuscrito, así como los comentarios de J. Krieger (Greifswald, Alemania) y el apoyo de C. MacGraphery (Freising, Alemania) e Y. Goldman (Collinsville, CT, EE.UU.) para revisar el texto en inglés como hablantes nativos. Además, agradecemos a dos revisores anónimos sus útiles comentarios.
Arillo, A. 2007. Paleoetología: comportamientos fosilizados en el ámbar. Geologica Acta, 5(2):159-166. https://doi.org/10.1344/105.000000301
Börner, C. 1925. Lepidoptera, Schmetterlinge, p. 358-387. En Brohmer, P. (ed.). Fauna von Deutschland. Ein Bestimmungsbuch unserer heimischen Tierwelt. Quelle und Meyer, Leipzig.
Borkent, A. 1995. Biting Midges in the Cretaceous Amber of North America (Diptera: Ceratopogonidae). Backhuys Publishers, Leiden, Países Bajos.
Boucot, A.J. y Poinar Jr, G.O. 2010. Fossil Behavior Compendium. CRC Press, Boca Ratón, p. 147-151.
Coty, D., Aria, C., Garrouste, R., Wils, P., Legendre, F. y Nel, A. 2014. La primera sininclusión de hormigas-termitas en ámbar con análisis de tafonomía por TAC. PLOS one, 9(8):e104410. https://doi.org/10.1371/journal.pone.0104410
Deering, M.D. y Scriber, J.M. 2002. Los bioensayos de campo muestran una asimetría en la preferencia de apareamiento heteroespecífica entre las especies de mariposas Papilio norteamericanas que se hibridan (Lepidoptera: Papilionidae). Journal of Ethology 20:25-33. https://doi.org/10.1007/s10164-002-0050-2
Fletcher, T.B. 1940. Nuevos nombres genéricos para microlepidópteros. Entomologist’s Record, 52:17-19.
Ganyard, M.C. y Brady, Jr.U.E. 1972. Atracción interespecífica en Lepidoptera en el campo. Annals of the Entomological Society of America, 65 (6): 1279-1282. https://doi.org/10.1093/aesa/65.6.1279
Gröhn, C. 2016. Inclusiones en el ámbar báltico. Wachholtz Verlag – Murmann Publishers, Kiel, Hamburgo.
Groot, A.T. 2014. Ritmos circadianos de las actividades sexuales en las polillas: Una revisión. Fronteras de la Ecología y la Evolución 2:43. https://doi.org/10.3389/fevo.2014.00043
Hoffeins, C. y Hoffeins, H.W. 2003. Estudios sobre la abundancia de inclusiones en el ámbar del Báltico y de Bitterfeld (Terciario, Eoceno) de colecciones no seleccionadas con especial referencia al orden Diptera. Studia Dipterologica, 10(2):381-392.
Kozlov, M.V. 1987. Nuevos lepidópteros del ámbar báltico. Paleontological Journal, 4:59-67.
Kozlov, M.V. 1988. Paleontología de los lepidópteros y problemas de filogenia del orden Papilionida, p. 16-69. En Ponomarenko A.G. (ed.), The Mesozoic-Cenozoic Crisis in the Evolution of Insects. Academia de Ciencias, Moscú.
Krzeminska, E., Krzeminski, W., Haenni, J.-P., y Dufour, C. 1991. Les Fantomes De L’Ambre. Muséed’histoire naturelle de Neuchâtel, Neuchâtel, Suiza.
Kusnezov, N. 1941. Una revisión de los lepidópteros del ámbar. Instituto Paleontológico, Academia de Ciencias de la URSS, Moscú & Leningrado.
Latreille, P.A. 1810. Consideraciones generales sobre el orden natural de los animales que componen las clases de crustáceos, arácnidos e insectos: con una tabla metódica de sus géneros, ordenados en familias. París, Schoell.
Menken, S.B.J., Boomsma, J.J. y van Nieukerken, E.J. 2009. Patrones evolutivos a gran escala de las asociaciones de plantas hospedadoras en los lepidópteros. Evolution, 64(4):1098-1119. https://doi.org/10.1111/j.1558-5646.2009.00889.x
Rebel, H. 1934. Bernstein-Lepidopteren (aus der Sammlung Bachofen-Echt). Palaeobiologica, 6:1-16.
Rebel, H. 1935. Bernstein-Lepidopteren. Entomologische Zeitschrift Iris, 49:162-186.
Regier, J.C., Mitter, C., Davis, D.R., Harrison, T.L., Sohn J.-C., Cummings, M.P., Zwick, A., y Mitter, K.T. 2014. A molecular phylogeny and revised classification for the oldest ditrysian moth lineages (Lepidoptera: Tineoidea), with implications for ancestral feeding habits of the mega-diverse Ditrysia. Entomología Sistemática, 40(2). https://doi.org/10.1111/syen.12110
Scoble, M.J. 1995. The Lepidoptera – Form, Function and Diversity. The Natural History Museum / Oxford University Press, Oxford.
Skalski, A.W. 1973. Estudios sobre los lepidópteros a partir de resinas fósiles. Parte II. Epiborkhausenites obscurotrimaculatus gen. et sp. nov. (Oecophoridae) y una polilla Tineid descubierta en el ámbar báltico. Acta Palaeontologica Polonica, 18(1):153-160.
Skalski, A.W. 1974. Zwei neue Gattungen und Arten der Familie Tineidae aus dem Baltischen Bernstein. Studien an Lepidopteren aus fossilen Harzen V. Beiträge zur Entomologie, 1/4(24):97-104.
Skalski, A.W. 1977. Estudios sobre los lepidópteros de las resinas fósiles. Part I. General remarks and descriptions of new genera and species of the families Tineidae and Oecophoridae from Baltic amber. Prace Museum Ziemi, 26:3-24.
Sohn, J.-C., Labandeira, C., Davis, D., y Mitter, C. 2012. Un catálogo anotado de Lepidoptera (Insecta: Holometabola) fósiles y subfósiles del mundo. Zootaxa, 3286:1-132.
Sohn, J.-C. y Lamas, G. 2013. Correcciones, adiciones y notas de nomenclatura al catálogo mundial de Lepidoptera fósiles y subfósiles recientemente publicado. Zootaxa, 3599:395-399.
Sontag, E. 2003. Inclusiones animales en una muestra de ámbar báltico no seleccionada. Acta Zoologica Cracoviensia, 46 (suppl.-Fossil Insects):431-440.
van Nieukerken, E.J., Kaila, L., Kitching, I.J., Kristensen, N.P., Lees, D.C., Minet, J., Mitter, C., Mutanen, M., Regier, J.C., Simonsen, T.J., Wahlberg, N., Yen, S.-H., Zahiri, R., Adamski, D., Baixeras, J., Bartsch, D., Bengtsson, B.Å., Brown, J.W., Bucheli, S.R., Davis, D.R., De Prins, J., De Prins, W., Epstein, M.E., Gentili-Poole, P., Gielis, C., Hätteschwiler, P., Hausmann, A., Holloway, J.D., Kallies, A., Karsholt, O., Kawahara, A.Y., Koster, S.J.C., Kozlov, M.V., Lafontaine, J.D., Lamas, G., Landry, J.-F., Lee, S., Nuss, M., Park, K.-T., Penz, C., Rota, J., Schintlmeister, A., Schmidt, B.C., Sohn, J.-C, Solis, M.A., Tarmann, G.M., Warren, A.D., Weller, S., Yakovlev, R.V., Zolotuhin, V.V., y Zwick, A. 2011. Orden Lepidoptera Linnaeus, 1758. En Zhang, Z.-Q. (ed.), Animal biodiversity: Un esbozo de clasificación de nivel superior y estudio de la riqueza taxonómica. Zootaxa, 3148:212-221.
von Linné, C. 1758. traducido por William Turton (1806). Volumen 1. Un sistema general de la naturaleza: A través de los tres grandes reinos de animales, vegetales y minerales, divididos sistemáticamente en sus diversas clases, órdenes, géneros, especies y variedades. Lackington, Allen, and Co, London.
Wagner, D.L. y Rosovsky, J. 1991. Mating systems in primitive Lepidoptera, with emphasis on the reproductive behavior of Korscheltellus gracilis (Hepialidae). Zoological Journal of the Linnean Society, 102:277-303. https://doi.org/10.1111/j.1096-3642.1991.tb00003.x
Weitschat, W. y Wichard, W. 2002. Atlas de plantas y animales en ámbar báltico. Verlag Friedrich Pfeil, München.
Weitschat, W. 2009. Jäger, Gejagte, Parasiten und blinde Passagiere – Momenta de los Bernsteinwald. Denisia, 26(86):243-256.
Wichard, W., Gröhn, C., y Seredszus, F. 2009. Aquatic Insects in Baltic Amber. Verlag Kessel, Remagen-Oberwinter.