Joitakin keskeisiä kupari(I)kemiaa
Kupari(I)ionien disproportionoituminen liuoksessa
Kupari(I)kemiaa rajoittaa reaktio, joka tapahtuu yksinkertaisten kupari(I)ionien liittyessä liuokseen. Tämä on hyvä esimerkki disproportionoinnista eli reaktiosta, jossa jokin hapettuu ja pelkistyy.
Kupari(I)-ionit liuoksessa disproportionoituvat muodostaen kupari(II)-ioneja ja kuparisakan.
Reaktio on:
![]()
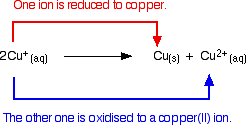
Jokainen yritys tuottaa yksinkertaista kupari(I)-yhdistettä liuoksessa johtaa tähän tapahtumaan.
Jos esimerkiksi kupari(I)-oksidi reagoi kuuman laimean rikkihapon kanssa, voi olettaa, että tuloksena syntyy kupari(I)-sulfaattiliuos ja vettä. Tosiasiassa saat kuparin ruskean saostuman ja kupari(II)sulfaatin sinisen liuoksen disproportionaatioreaktion vuoksi.
![]()
![]()
Kupari(I)n hapetusasteen vakauttaminen
Liukenemattomat kupari(I)-yhdisteet
Olemme jo nähneet, että kupari(I)jodidia syntyy luonnonvalkoisena saostumana, jos kupari(II)-ioneja sisältävään liuokseen lisätään kaliumjodidiliuosta. Kupari(I)jodidi on käytännössä liukenematon veteen, joten disproportionointireaktiota ei tapahdu.
Kupari(I)kloridia voidaan tuottaa vastaavasti valkoisena saostumana (reaktio kuvattu jäljempänä). Mikäli tämä erotetaan liuoksesta ja kuivataan mahdollisimman nopeasti, se pysyy valkoisena. Kosketuksessa veden kanssa se kuitenkin muuttuu hitaasti siniseksi, kun kupari(II)-ioneja muodostuu.
Disproportionointireaktio tapahtuu vain yksinkertaisten kupari(I)-ionien kanssa liuoksessa.
Kupari(I)-kompleksit
Kupari(I)-kompleksien muodostaminen (muu kuin sellainen, jossa on vesi ligandina) vakauttaa myös kupari(I)-oksidaatiotilan.
Esimerkiksi sekä + että – ovat kupari(I)komplekseja, jotka eivät disproportionoidu.
Klooria sisältävä kompleksi muodostuu, jos kupari(I)oksidia liuotetaan väkevään suolahappoon.
Voidaan ajatella, että tämä tapahtuu kahdessa vaiheessa. Ensin muodostuu kupari(I)kloridia:
![]()
![]()
Mutta HCl:stä peräisin olevien ylimääräisten kloridi-ionien läsnäollessa tämä reagoi muodostaen stabiilin, liukoisen kupari(I)kompleksin.
![]()
![]()
Valkean kupari(I)kloridisaostuman (edellä mainittu) saa lisäämällä tähän liuokseen vettä. Tämä kääntää edellisen reaktion päinvastaiseksi poistamalla ylimääräisen kloridi-ionin.
Kysymyksiä ymmärtämisesi testaamiseksi
Jos tämä on ensimmäinen kysymyksenasettelu, jonka teet, lue johdantosivu ennen aloittamista. Sinun täytyy käyttää selaimesi BACK BUTTON -näppäintä palataksesi tänne sen jälkeen.
Kysymyksiä kuparista
vastauksia
Mihin haluaisit siirtyä nyt?
Valikkoon Siirtymämetalli . .
Epäorgaanisen kemian valikkoon . .
Päävalikkoon . . .