- Falene che si accoppiano (Tineidae, Ditrysia, Lepidoptera) conservate come inclusione di comportamento congelato in Ambra Baltica (Eocene)
- ABSTRACT
- INTRODUZIONE
- MATERIALI E METODI
- PALAEONTOLOGIA SISTEMATICA
- DISCUSSIONE
- Coincidenza casuale o accoppiamento conservato?
- Tafonomia
- Dimorfismo sessuale
- Habitat
- CONCLUSIONE
- Riconoscimenti
Falene che si accoppiano (Tineidae, Ditrysia, Lepidoptera) conservate come inclusione di comportamento congelato in Ambra Baltica (Eocene)
Thilo C. Fischer e Marie K. Hörnig
Numero articolo: 22.1.7
https://doi.org/10.26879/829
Copyright Paleontological Society, febbraio 2019
Biografie degli autori
Astratti in lingua e multilingue
Versione PDF
Presentazione: 22 Octobere 2017. Acceptance: 23 Januiary 2019
{flike id=2421}
ABSTRACT
L’indagine delle inclusioni d’ambra fornisce uno sguardo unico sulla biologia degli animali vissuti milioni di anni fa, grazie alla loro eccezionale conservazione in condizioni quasi simili alla vita. Questo non è solo vero per gli aspetti morfologici, aspetti del comportamento possono anche essere dedotti da questi fossili.
Qui, Microlepidoptera sono riportati da ambra baltica eocenica molto probabilmente come una prima occorrenza di Lepidoptera fossili trovati in copula. Le falene appartengono a Tineidae (le falene tineidi includono le falene dei vestiti) e sono descritte come una nuova specie e un nuovo genere, Forcepsites michalskii. L’organo di chiusura del maschio è abbastanza insolito per le falene dell’ambra baltica, con una parte ventrale e una dorsale, ognuna delle quali termina con due protuberanze parallele, simili a spine, e apparentemente non è formato dalle valvae. La co-occorrenza di maschio e femmina, molto probabilmente in copula, ha permesso di studiare direttamente il loro dimorfismo sessuale, e ci sono prove che l’habitat di questa specie è il sito di produzione di resina nella foresta d’ambra baltica. Dal dimorfismo sessuale delle antenne e dalla morfologia degli occhi si interpreta che la femmina era il sesso chiamante per l’accoppiamento in questa specie.
Thilo C. Fischer. Förderverein der Bayerischen Staatssammlung für Paläontologie und Historische Geologie München Richard-Wagner-Straße 10, D-80333 München, Germania.
Marie K. Hörnig. Università di Greifswald, Istituto e Museo Zoologico, Citologia e Biologia Evolutiva, Soldmannstr. 23, D-17489 Greifswald, Germania.
Parole chiave: Falene dei vestiti; habitat in copula; Microlepidoptera; nuove specie e genere; dimorfismo sessuale
Citazione finale: Fischer, Thilo C, e Hörnig, Marie K. 2019. Falene che si accoppiano (Tineidae, Ditrysia, Lepidoptera) conservate come inclusione di comportamento congelato in Ambra Baltica (Eocene). Palaeontologia Electronica 22.1.7A 1-11. https://doi.org/10.26879/829
palaeo-electronica.org/content/2019/2421-mating-moths
Copyright: Febbraio 2019 Società Paleontologica.
Questo è un articolo ad accesso aperto distribuito secondo i termini di Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0), che consente agli utenti di copiare e ridistribuire il materiale in qualsiasi mezzo o formato, a condizione che non venga utilizzato per scopi commerciali e che vengano accreditati l’autore originale e la fonte, con indicazioni in caso di modifiche.
creativecommons.org/licenses/by-nc-sa/4.0/
http://zoobank.org/BCF64D89-6879-4805-8021-7CE926CE4B12
INTRODUZIONE
Gli insetti che si accoppiano sono raramente trovati nell’ambra come casi del cosiddetto ‘comportamento congelato’ (Arillo, 2007, e riferimenti ivi). Tali sono stati riportati dall’ambra baltica dell’Eocene, per esempio dai gruppi Ditteri, Coleotteri, Emitteri, Imenotteri e abbastanza raramente Tricotteri (Weitschat e Wichard, 2002; Weitschat, 2009; Boucot e Poinar Jr., 2010; Gröhn, 2016).
Nell’ambra baltica, i Lepidotteri sono generalmente rari e si presentano a circa una su 250 inclusioni (per confronto: I ditteri rappresentano circa il 64% di tutti gli insetti nell’ambra baltica, i Lepidotteri rappresentano circa lo 0,4%; Hoffeins e Hoffeins 2003; Gröhn 2016). Come in altri insetti, le immagini conservate in copula sono molto più rare e i Lepidotteri in copula non sono ancora stati descritti, nemmeno in altre ambre o da località non ambrate (Sohn et al., 2012; Sohn e Lamas, 2013). Un’occorrenza in copula permette l’affiliazione in buona fede di entrambe le forme sessuali l’una all’altra e di entrambe insieme a una specie distinta, e quindi la descrizione esatta del dimorfismo sessuale di una specie. In alternativa, il dimorfismo sessuale degli insetti fossili può essere studiato con mezzi statistici solo quando i reperti di una specie sono abbondanti come in molti Nematocera (per esempio, Borkent, 1995).
I Tineidae sono rappresentanti basali altamente divergenti del gruppo di lepidotteri Ditrysia (Regier et al., 2014), le loro larve si nutrono di una vasta gamma di substrati (detriti, funghi, licheni, o cheratina) (Scoble, 1995), quindi essendo generalista (85,7%) (Menken et al., 2009). Come inclusioni di ambra baltica, i Tineidae rappresentano circa un quarto di tutti i ritrovamenti di lepidotteri (Skalski, 1977). Qui, una rara e nuova specie di Tineidae è descritta con le sue forme sessuali da un’occorrenza putativa in copula.
MATERIALI E METODI
Il campione d’ambra è stato trovato e acquistato da Artur Michalski (Wroclaw, Polonia). È stato conservato mediante trattamento con vernice acrilica e proviene dalla collezione dell’autore (TF) con il numero di collezione 7131. La conservazione è avvenuta a temperatura costante in sacchetti di plastica a clip all’interno di scatole di metallo, escludendo l’ossigeno e la luce. Sarà depositato presso il Bayerische Paläontologische Staatssammlung München con il numero SNSB-BSPG 2017 I 113.
L’esemplare è stato fotografato con una Canon EOS 70d dotata di un obiettivo Canon MP-E 65 mm e un Canon Twin Flash MT-24. Per evitare i riflessi, i filtri di polarizzazione sono stati montati e regolati davanti ai flash e all’obiettivo della fotocamera (luce polarizzata incrociata). Per ridurre la convessità e la concavità della superficie dell’ambra, è stata applicata una goccia di glicerina e coperta con un vetrino. Gli z-stacks delle immagini registrate sono stati fusi con Combine ZP e ulteriormente elaborati con Adobe Photoshop CS 3. L’inclusione non ha potuto essere studiata con la micro-tomografia computerizzata, a causa della presenza di inclusioni metalliche, apparentemente piritiche, che causano forti artefatti.
PALAEONTOLOGIA SISTEMATICA
Sistematica (secondo van Nieukerken et al, 2011)
Ordine LEPIDOPTERA Linnaeus, 1758
Clade DITRYSIA Börner, 1925
Superfamiglia TINEOIDEA Latreille, 1810
Famiglia TINEIDAE Latreille, 1810
Genus Forcepsites nov. gen.
zoobank.org/DDB6884D-845A-4A87-981E-A2953ADD8964
Etymology. “Forceps”, latino per forcipe, riferendosi all’organo di chiusura maschile.
Specie Forcepsites michalskii nov. spec.
zoobank.org/5494D58E-7773-473C-AFB2-140DDD049226
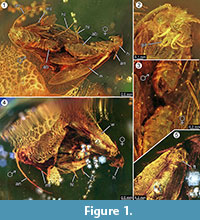 Holotypus. Esemplare ex coll. Fischer no. 7131, Figura 1.2
Holotypus. Esemplare ex coll. Fischer no. 7131, Figura 1.2
Locus typicus. Miniera d’ambra di Yantarni, GUS
Stratum typicum. “Blaue Erde” (Eocene superiore – Oligocene inferiore)
Etimologia. Il nome della specie michalskii è scelto per riconoscere Artur Michalski per aver fornito questo esemplare.
Repository. Bayerische Staatssammlung für Paläontologie und Geologie, Monaco, Germania; numero di adesione SNSB-BSPG 2017 I 113.
Diagnosi del genere. Genere monotipico con l’organo di chiusura del maschio (Figura 2.3) con una parte ventrale e una dorsale, ciascuna terminante in due protuberanze parallele, simili a spine, come carattere definitorio.
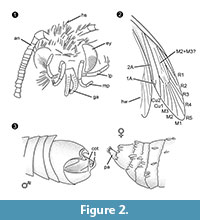 Diagnosi della specie. I rispettivi caratteri qualitativi e quantitativi delle immagini femminili e maschili (Figura 1) sono stati determinati e sono riassunti nella Tabella 1.
Diagnosi della specie. I rispettivi caratteri qualitativi e quantitativi delle immagini femminili e maschili (Figura 1) sono stati determinati e sono riassunti nella Tabella 1.
Diagnosi differenziale. La combinazione di caratteri piccola proboscide con galee separate, palpi mascellari lunghi e ripiegati con cinque segmenti, palpi labiali rivolti verso l’alto e leggermente piegati con setole laterali, testa con molte squame erette simili a capelli suggeriscono fortemente un’affiliazione a Tineidae, ma nessuno di questi è apomorfo, né tale apomorfia è attualmente nota per Tineidae adulti (Regier et al., 2014). Le vene R4 e R5 non sono fuse / peduncolate, il che sarebbe indicativo per i Gelechioidea (Gelechiidae e Oecophoridae) (Scoble, 1995), l’altro grande gruppo di Lepidoptera trovato nell’ambra baltica. La specie è diversa da qualsiasi rappresentante descritto di Tineidae o di altre famiglie dall’ambra baltica (Rebel, 1934, 1935; Kuznezov, 1941; Skalski, 1973; Kozlov, 1987, 1988; Sohn et al., 2012; Sohn e Lamas, 2013), soprattutto per quanto riguarda il suo apparato genitale maschile. Più simile sembra Tineosemopsis decurtatus Skalski 1974 (femmina nota) ma si differenzia per l’assenza di peli eretti al vertice e gli occhi più piccoli. Tillyardinea eocaenica Kusnezov 1941 (femmina), che ha squame erette al vertice e una venatura simile, si differenzia per le fronti e i palpi labiali. Simulotinea intermedia Skalski 1977 ha un habitus simile ma si differenzia anche per la presenza di una vena biforcata, che divide la grande cella dell’ala anteriore (M2+3).
Tafonomia. Maschio e femmina di Forcepsites michalskii sono fossilizzati vicini e con la parte posteriore dell’addome rivolta verso l’altro. Le due inclusioni sono in un pezzo cilindrico di ambra baltica non autoclavata con un diametro di 15 mm e un’altezza di 11 mm che è diviso a circa metà della sua altezza da un bordo irregolare tra due strati di flusso di resina. Questo bordo mostra uno strato di pirite come parte del suo piano. Un flusso di resina contiene le due falene che espongono i loro rispettivi lati dorsali a questo bordo. Sono conservate lunghe scaglie che derivano dal bordo dell’ala femminile. L’imago femminile ha perso due zampe e il suo torace è danneggiato. L’altro flusso contiene una serie non lineare di bolle. Entrambi gli individui sembrano appena emersi, a giudicare dal completo rivestimento di squame sulle ali e dal fatto che le ali non sono a brandelli. Non è stato possibile identificare alcun organo di profumo sulle ali, sull’addome o sulle zampe. Le uniche sininclusioni conservate con i Microlepidotteri sono i tricomi, tipici dell’ambra baltica.
DISCUSSIONE
Coincidenza casuale o accoppiamento conservato?
Le falene allegate sono rappresentanti maschili e femminili della stessa specie e sono disposte vicine con gli addomi orientati l’uno all’altro. Tuttavia, i genitali delle falene non sono in contatto diretto, ma in una posizione vicina. L’orientamento dorsale/ventrale del maschio e della femmina differisce leggermente, il che è causato da una leggera rotazione nell’asse del corpo (specialmente del maschio). L’orientamento della parte posteriore dell’addome di entrambe le falene è verso l’altro.
Sono noti diversi casi in cui la situazione di reclusione nella resina ancora liquida può indurre una risposta di stress, come l’ovodeposizione (Weitschat, 2009). L’induzione di un comportamento di accoppiamento da parte del flusso di resina non è generalmente plausibile, ma la situazione di clausura dimostra che leggeri movimenti all’interno della resina fresca erano possibili.
C’è anche la questione se questo risultato potrebbe anche rappresentare una co-occorrenza casuale. La probabilità di una tale co-occorrenza casuale può essere stimata approssimativamente. Tra le inclusioni di insetti le falene si presentano con una frequenza di circa una su 250 inclusioni nell’ambra baltica (Krzeminskaet al., 1991 (0,6%); Hoffeins e Hoffeins, 2003 (0,4%); Sontag, 2003 (0,27%), e la propria osservazione). Data una singola ambra con una falena inclusa, la possibilità di co-occorrenza casuale di un’altra falena è semplicemente 1:250 (le falene non si presentano in sciami). La co-occorrenza dello stesso taxon, o di uno abbondante che potrebbe essere scambiato, è stimata essere 1:10 nel migliore dei casi (Skalski, 1977), e un altro circa 1:2 per avere sessi diversi. Considerando le ulteriori possibilità di disposizione ravvicinata, sia l’allineamento degli assi corporei, sia un adeguato orientamento del corpo, una probabilità per una co-occorrenza casuale che potrebbe essere erroneamente interpretata come un evento di accoppiamento è molto inferiore alla frequenza osservata come una su 920 inclusioni di lepidotteri nella collezione dell’autore studiato.
In conclusione, l’interpretazione più probabile per questo risultato è che le falene erano in copula, e i genitali erano stati in contatto ma gli individui erano leggermente distratti l’uno dall’altro a causa del flusso di resina (vedi discussione sotto).
Tafonomia
La rilevanza di un’attenta analisi dei flussi di resina per la tafonomia delle inclusioni d’ambra è stata dimostrata da Coty et al. (2014) con il loro studio di un’interazione formica – termite conservata nell’ambra messicana del Chiapas.
Il verificarsi di un evento in copula è fortemente supportato dal trovare lunghe scaglie derivate dal bordo dell’ala femminile, che sono andate alla deriva per una certa distanza nella direzione del maschio. Questo potrebbe indicare un forte flusso laminare di resina in questo sito che si è mosso lungo il loro asse comune, e potrebbe averli allontanati per la breve distanza osservata ora. Durante l’accoppiamento delle falene, il maschio può perdere il contatto con il sito di accoppiamento e può essere fissato alla femmina solo dall’organo di aggancio, con solo la femmina che fa un contatto con la superficie. Tale comportamento e il trascinamento da un improvviso flusso di resina potrebbero essere la ragione per cui la femmina ha perso entrambe le zampe posteriori. Sul lato dorsale delle falene, che era stato esposto alla superficie convessa di questo primo flusso laminare di resina, l’ala della femmina e il suo sottostante torace è parzialmente danneggiato (Figura 1.5). Putativamente, queste aree distrutte rappresentano tracce di alimentazione causate da altri insetti, molto probabilmente formiche come spesso osservato nei campioni di ambra. Quindi, dopo il primo flusso di resina come evento di inclusione, i lati dorsali saranno stati esposti per qualche tempo, abbastanza a lungo da permettere ai predatori di camminare su questa superficie solida. Il secondo flusso di resina, che ha coperto questo lato più tardi, potrebbe essere stato un flusso veloce e turbolento di resina, come indicato da una serie di piccole bolle disposte in curve irregolari trovate al suo interno. Questo sarebbe un tipico processo tafonomico per un cosiddetto “Schlaube” di ambra baltica (Gröhn, 2016).
Dimorfismo sessuale
Il dimorfismo sessuale è difficile da osservare nelle specie fossili, di cui sono solitamente noti solo pochi esemplari. I caratteri non influenzati dal sesso devono essere diagnostici per permettere una sicura determinazione della specie come base per l’ulteriore differenziazione tra i sessi e l’elucidazione del dimorfismo sessuale. Considerando le specie esistenti altamente dimorfiche sessualmente, per esempio, con femmine brachiptere come in molti Psychidae (Scoble, 1995), una deduzione di entrambi i sessi appartenenti ad una specie sarebbe difficilmente possibile. Quindi, solo i casi di debole dimorfismo sessuale possono essere riconosciuti in modo affidabile nelle specie fossili con mezzi statistici e senza trovarli in copula. Questo sottolinea l’importanza del comportamento di accoppiamento identificato nelle specie fossili per la descrizione di tali casi di forte dimorfismo sessuale. Tali ritrovamenti conservati di accoppiamenti fossili possono anche approvare la correlazione di forme sessualmente dimorfiche precedentemente conosciute per appartenere a una specie, anche senza la possibilità di un grande supporto statistico. C’è qualche possibilità che un evento di accoppiamento conservato possa rappresentare un accoppiamento interspecifico o intergenerico, come questi sono noti da falene e farfalle (Ganyard e Brady, 1972; Deering e Scriber, 2002). Tuttavia, questi fenomeni sono molto meno abbondanti dell’accoppiamento intraspecifico e difficilmente possono essere trovati come una rara inclusione fossile.
Un dimorfismo sessuale non allometrico osservato da Forcepsites michalskii è le galee separate nella proboscide nel maschio. Questo può alludere ad uno stato non funzionale, con immagini maschili di questa specie che non si nutrono, come visto in molti Psychidae (maschi) esistenti con proboscide vestigiale o assente (Scoble, 1995). I dimorfismi sessuali allometrici qui riscontrati sono: (1) La femmina è più grande del maschio, sia nelle dimensioni del corpo che nella lunghezza delle ali. Tuttavia, i rispettivi rapporti sono quasi uguali. (2) Nella femmina l’addome è relativamente e assolutamente più largo rispetto al maschio. (3) Le antenne del maschio sono molto più grandi e spesse che nell’imago femminile. In diverse specie esistenti le antenne sono sessualmente dimorfiche (Scoble, 1995), le antenne maschili ben sviluppate servono per la chemiosensazione dei feromoni femminili. (4) I palpi mascellari del maschio sono due volte più spessi che nella femmina e hanno una struttura a coste. (5) Anche gli occhi del maschio sono più grandi ma il numero di ommatidi è circa lo stesso. Occhi più grandi riceveranno solo più luce e potrebbero essere più sensibili; tuttavia, la risoluzione sarebbe la stessa.
Il riconoscimento a lungo raggio delle falene femmine chiamanti avviene tramite i chemorecettori maschili mentre il riconoscimento a corto raggio si basa invece sull’identificazione visiva (Groot, 2014). In Forcepsites michalskii, sembra anche che la femmina fosse il sesso chiamante – come suggerito dall’apparato antennale e dagli occhi più grandi del maschio.
Habitat
In base alla discussione presentata sopra è chiaro che gli individui catturati in copula possono verificarsi solo nel luogo in cui questa specie viveva e si accoppiava. Singoli individui possono essere portati alla deriva dal vento o visitare siti non-habitat, come gli insetti acquatici raramente trovati nell’ambra baltica (Wichardet al., 2009); per gli individui che si accoppiano invece, questo difficilmente potrebbe avvenire senza separarsi. Non sembrano esserci prove in letteratura per l’accoppiamento di falene in volo. Al contrario, nella maggior parte dei Lepidotteri e nei microlepidotteri (falene) prevalentemente notturni, le femmine “chiamano” i maschi tramite feromoni, determinando così i luoghi di accoppiamento (Groot, 2014). Possono volare prima dell’accoppiamento, ma nella maggior parte dei casi sembrano essere sessili e a ventaglio per la distribuzione dei feromoni. Tuttavia, i sessi che chiamano o cercano possono anche essere invertiti in alcuni taxa, ma per i Tineidae la femmina è riportata come il sesso chiamante (Wagner e Rosovsky, 1991; Scoble, 1995). In ogni caso, il sito del flusso di resina, cioè il biotopo con gli alberi che producono ambra, molto probabilmente era anche l’habitat della falena dei vestiti qui descritta.
CONCLUSIONE
Una falena tineoide con un notevole apparato genitale maschile è descritta come nuova specie e genere Forcepsites michalskii dall’ambra baltica eocenica. La femmina e il maschio sono conservati insieme in posizione ravvicinata e con l’addome orientato l’uno verso l’altro, suggerendo che queste falene sono state intrappolate nella resina fresca durante l’accoppiamento. Un forte flusso laminare di resina, che è indicato da diverse parti del corpo della femmina alla deriva, potrebbe averli allontanati per la breve distanza osservata ora. Questo esemplare potrebbe, quindi, rappresentare il primo esempio di Lepidottero fossile catturato in copula.
Si presume che Forcepsites michalskii fosse una specie che viveva nella foresta, poiché gli individui catturati in copula possono essere documentati solo dal luogo dove questa specie viveva e si accoppiava.
Femmina e maschio di F. michalskii mostrano dimorfismi sessuali nelle dimensioni del corpo, la lunghezza delle ali, la proporzione dell’addome, la dimensione degli occhi composti, e la morfologia dei palpi mascellari, così come delle antenne. Sulla base delle antenne distinte più grandi e più spesse del maschio così come sui suoi occhi più grandi, si suggerisce che la femmina potrebbe essere il sesso chiamante in questa specie, come riportato anche per le specie Tineidae esistenti.
Riconoscimenti
A. Si ringrazia Michalski (Wroclaw, Polonia) per aver fornito questo esemplare eccezionale e aver portato la nostra attenzione su di esso. M. Schwarz dell’Oberösterreichisches Landesmuseum (Linz, Austria) ha gentilmente sostenuto lo screening della loro collezione di lepidotteri. MKH è stato gentilmente finanziato da una borsa di studio della Studienstiftung des deutschen Volkes e ringrazia S. Harzsch (Greifswald, Germania) per il suo supporto. Riconosciamo i preziosi commenti scientifici di M. Heikkilä e C. Haug (Monaco, Germania) fatti sul manoscritto, così come i commenti di J. Krieger (Greifswald, Germania) e il supporto di C. MacGraphery (Freising, Germania) e Y. Goldman (Collinsville, CT, USA) per controllare il testo inglese come madrelingua. Inoltre, ringraziamo due revisori anonimi per i loro utili commenti.
Arillo, A. 2007. Paleoetologia: comportamenti fossilizzati nell’ambra. Geologica Acta, 5(2):159-166. https://doi.org/10.1344/105.000000301
Börner, C. 1925. Lepidotteri, Schmetterlinge, p. 358-387. In Brohmer, P. (ed.). Fauna von Deutschland. Ein Bestimmungsbuch unserer heimischen Tierwelt. Quelle und Meyer, Leipzig.
Borkent, A. 1995. Biting Midges nel Cretaceo Ambra del Nord America (Diptera: Ceratopogonidae). Backhuys Publishers, Leiden, The Netherlands.
Boucot, A.J. and Poinar Jr, G.O. 2010. Compendio del comportamento fossile. CRC Press, Boca Raton, p. 147-151.
Coty, D., Aria, C., Garrouste, R., Wils, P., Legendre, F. e Nel, A. 2014. La prima sininclusione di ant-termite in ambra con analisi CT-scan di tafonomia. PLOS one, 9(8):e104410. https://doi.org/10.1371/journal.pone.0104410
Deering, M.D. e Scriber, J.M. 2002. I biotest sul campo mostrano un’asimmetria di preferenze di accoppiamento eterospecifiche tra le specie di farfalle Papilio del Nord America che si ibridano (Lepidoptera: Papilionidae). Journal of Ethology 20:25-33. https://doi.org/10.1007/s10164-002-0050-2
Fletcher, T.B. 1940. Nuovi nomi generici per microlepidotteri. Entomologist’s Record, 52:17-19.
Ganyard, M.C. e Brady, Jr.U.E. 1972. Attrazione interspecifica nei Lepidotteri sul campo. Annali della Entomological Society of America, 65 (6): 1279-1282. https://doi.org/10.1093/aesa/65.6.1279
Gröhn, C. 2016. Inclusioni nell’ambra baltica. Wachholtz Verlag – Murmann Publishers, Kiel, Hamburg.
Groot, A.T. 2014. Ritmi circadiani delle attività sessuali nelle falene: Una recensione. Frontiers in Ecology and Evolution 2:43. https://doi.org/10.3389/fevo.2014.00043
Hoffeins, C. e Hoffeins, H.W. 2003. Studi sull’abbondanza di inclusioni nell’ambra del Baltico e del Bitterfeld (Terziario, Eocene) da collezioni non selezionate con particolare riferimento all’ordine dei Ditteri. Studia Dipterologica, 10(2):381-392.
Kozlov, M.V. 1987. Nuovi lepidotteri simili a falene dall’ambra del Baltico. Paleontological Journal, 4:59-67.
Kozlov, M.V. 1988. Paleontologia dei lepidotteri e problemi di filogenesi dell’ordine Papilionida, p. 16-69. In Ponomarenko A.G. (ed.), La crisi mesozoica-cenozoica nell’evoluzione degli insetti. Accademia delle Scienze, Mosca.
Krzeminska, E., Krzeminski, W., Haenni, J.-P., e Dufour, C. 1991. Les Fantomes De L’Ambre. Muséed’histoire naturelle de Neuchâtel, Neuchâtel, Svizzera.
Kusnezov, N. 1941. Una revisione dei lepidotteri dell’ambra. Istituto Paleontologico, Accademia delle Scienze dell’URSS, Mosca & Leningrado.
Latreille, P.A. 1810. Considerazioni generali sull’ordine naturale degli animali che compongono le classi di crostacei, aracnidi e insetti: con una tabella metodica dei loro generi, organizzati in famiglie. Parigi, Schoell.
Menken, S.B.J., Boomsma, J.J. e van Nieukerken, E.J. 2009. Modelli evolutivi su larga scala delle associazioni di piante ospiti nei Lepidotteri. Evolution, 64(4):1098-1119. https://doi.org/10.1111/j.1558-5646.2009.00889.x
Rebel, H. 1934. Bernstein-Lepidopteren (aus der Sammlung Bachofen-Echt). Palaeobiologica, 6:1-16.
Rebel, H. 1935. Bernstein-Lepidopteren. Entomologische Zeitschrift Iris, 49:162-186.
Regier, J.C., Mitter, C., Davis, D.R., Harrison, T.L., Sohn J.-C., Cummings, M.P., Zwick, A., e Mitter, K.T. 2014. Una filogenesi molecolare e una classificazione rivista per i più antichi lignaggi di falene ditrysiane (Lepidoptera: Tineoidea), con implicazioni per le abitudini alimentari ancestrali della mega-diversa Ditrysia. Entomologia sistematica, 40(2). https://doi.org/10.1111/syen.12110
Scoble, M.J. 1995. I Lepidotteri – Forma, funzione e diversità. The Natural History Museum / Oxford University Press, Oxford.
Skalski, A.W. 1973. Studi sui Lepidotteri dalle resine fossili. Parte II. Epiborkhausenites obscurotrimaculatus gen. et sp. nov. (Oecophoridae) e una falena Tineide scoperta nell’ambra baltica. Acta Palaeontologica Polonica, 18(1):153-160.
Skalski, A.W. 1974. Zwei neue Gattungen und Arten der Familie Tineidae aus dem Baltischen Bernstein. Studien an Lepidopteren aus fossilen Harzen V. Beiträge zur Entomologie, 1/4(24):97-104.
Skalski, A.W. 1977. Studi sui Lepidotteri delle resine fossili. Parte I. Osservazioni generali e descrizioni di nuovi generi e specie delle famiglie Tineidae e Oecophoridae dall’ambra baltica. Prace Museum Ziemi, 26:3-24.
Sohn, J.-C., Labandeira, C., Davis, D., e Mitter, C. 2012. Un catalogo annotato di Lepidoptera fossili e subfossili (Insecta: Holometabola) del mondo. Zootaxa, 3286:1-132.
Sohn, J.-C. e Lamas, G. 2013. Correzioni, aggiunte e note nomenclaturali al catalogo mondiale dei Lepidotteri fossili e subfossili di recente pubblicazione. Zootaxa, 3599:395-399.
Sontag, E. 2003. Inclusioni animali in un campione di ambra baltica non selezionata. Acta Zoologica Cracoviensia, 46 (suppl.-Fossil Insects):431-440.
van Nieukerken, E.J., Kaila, L., Kitching, I.J., Kristensen, N.P., Lees, D.C., Minet, J., Mitter, C., Mutanen, M., Regier, J.C, Simonsen, T.J., Wahlberg, N., Yen, S.-H., Zahiri, R., Adamski, D., Baixeras, J., Bartsch, D., Bengtsson, B.Å., Brown, J.W., Bucheli, S.R., Davis, D.R., De Prins, J., De Prins, W., Epstein, M.E, Gentili-Poole, P., Gielis, C., Hätteschwiler, P., Hausmann, A., Holloway, J.D., Kallies, A., Karsholt, O., Kawahara, A.Y., Koster, S.J.C., Kozlov, M.V., Lafontaine, J.D., Lamas, G., Landry, J.-F, Lee, S., Nuss, M., Park, K.-T., Penz, C., Rota, J., Schintlmeister, A., Schmidt, B.C., Sohn, J.-C, Solis, M.A., Tarmann, G.M., Warren, A.D., Weller, S., Yakovlev, R.V., Zolotuhin, V.V., and Zwick, A. 2011. Ordine Lepidoptera Linnaeus, 1758. In Zhang, Z.-Q. (a cura di), Biodiversità animale: Uno schema di classificazione di livello superiore e un’indagine sulla ricchezza tassonomica. Zootaxa, 3148:212-221.
von Linné, C. 1758. tradotto da William Turton (1806). Volume 1. Un sistema generale della natura: Attraverso i tre grandi regni di animali, vegetali e minerali, sistematicamente divisi nelle loro diverse classi, ordini, generi, specie e varietà. Lackington, Allen, and Co, London.
Wagner, D.L. e Rosovsky, J. 1991. Sistemi di accoppiamento nei Lepidotteri primitivi, con particolare attenzione al comportamento riproduttivo di Korscheltellus gracilis (Hepialidae). Zoological Journal of the Linnean Society, 102:277-303. https://doi.org/10.1111/j.1096-3642.1991.tb00003.x
Weitschat, W. e Wichard, W. 2002. Atlante di piante e animali in ambra baltica. Verlag Friedrich Pfeil, München.
Weitschat, W. 2009. Jäger, Gejagte, Parasiten und blinde Passagiere – Momentaufnahmen aus dem Bernsteinwald. Denisia, 26(86):243-256.
Wichard, W., Gröhn, C., and Seredszus, F. 2009. Insetti acquatici in ambra baltica. Verlag Kessel, Remagen-Oberwinter.