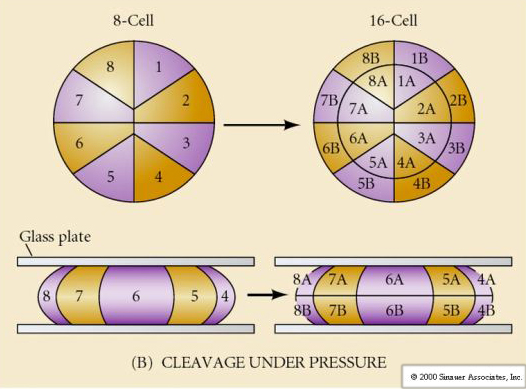
開裂とは、大量の卵細胞質を分割する初期の有糸分裂の定型パターンを指します。 初期の接合体は非常に大きいという点でユニークである。 ほとんどの細胞は有糸分裂のサイクルの間に成長期を迎えるが、初期の割球期胚珠はそうではない。 分裂のたびに細胞は小さくなっていく。 成長を伴わないこの急速な細胞分裂のパターンは、接合核が細胞周期を制御する芽球中期移行と呼ばれる段階で突然停止する。
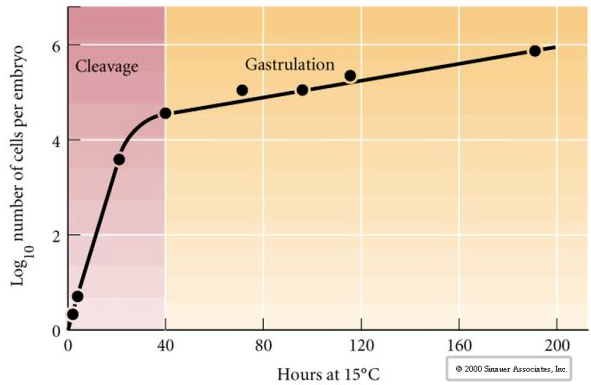 母性因子、おそらく転写制御因子が、この初期の急速な分裂パターンに関係しているという証拠がいくつかある。 細胞質 DNA と核 DNA の比率を人為的に変更することで、胚盤胞の中期の移行時期を変更することができます。
母性因子、おそらく転写制御因子が、この初期の急速な分裂パターンに関係しているという証拠がいくつかある。 細胞質 DNA と核 DNA の比率を人為的に変更することで、胚盤胞の中期の移行時期を変更することができます。
いくつかの種における受精は、細胞質決定因子が後続の開裂イベントに対して正しい位置に配置されることを確実にするために不可欠な、根本的な細胞質の移動をもたらす。
PATTERNS OF EMBRYONIC CLEAVAGE
胚の裂開のパターンは、有糸分裂紡錘体の位置と卵黄の量および分布の両方によって決定される。 卵黄は割球を阻害する傾向がある。 卵黄は分裂を遅らせるか、あるいは実際に分裂を完全に妨げてしまう。 卵黄は、多かれ少なかれ、いかなる食物供給からも隔離された胚発生を経る動物たちの適応である。 ウニのように、環境から栄養を得て自由に泳ぐ幼生に急速に成長するため、比較的卵黄を持たない動物もいる。 また、有袋類のように未熟児で生まれても、親袋の中で栄養を与えられる動物もいる。
卵黄の特徴から卵の種類を説明すると、
Isolecithal:卵黄がまばらで均等に分布、例:ウニ、マウス
Mesolecthal:卵黄が適度に多く、不均等に分布、例:ウニ、マウス
Mesolecthal:卵黄が多く、不均等に分布、例:ウニ、マウス。 frog
Telolecithal: 卵黄が一端に集中している、例:鳥、爬虫類
Centrolecithal: 卵黄が中央に集中している、例:ハエ
多くの卵は、植物極と呼ばれる卵黄の多い極と動物極と呼ばれる卵黄の少ない極に極性がある、例:frog。 接合核は一般に動物極の方に移動している。 卵黄が比較的少ない接合体(isolecithalとmesolecithal)は、HOLOBLASTICに切断される。 卵割溝は卵を貫通している。 一方、telolecithalとcentrolecithalの接合体はMEROBLASTICに切断され、切断面は蓄積した卵黄までしか広がらない。 放射状(棘皮動物、両生類)、螺旋状(軟体動物、環形動物)、両側性(ホヤ、フナムシ)、回転性(哺乳類)などがあり、自然界で見られる裂開の対称性は、棘皮動物、両生類、軟体動物、環形動物、フナムシ、哺乳類の順である。
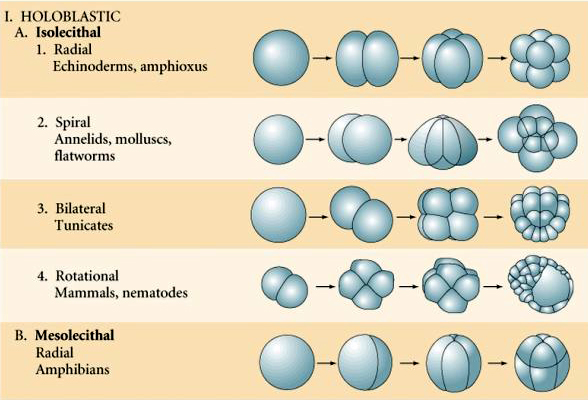
RADIAL HOLOBLASTIC CLEAVAGE
Rachel Fink氏の「A Dozen Eggs」にあるウニの裂開の素晴らしい動画があります。
ウニにも放射状ホロブラスチック割れがありますが、いくつか面白い違いがあります。 第一裂は子午線方向、第二裂は子午線方向。 しかし、4つの動物極細胞が均等に分裂して8つの同じ大きさの動物胚葉(メゾメア)を生じるのに対し、植物極細胞は赤道面に沿って非対称に分裂し、植物極に大きなマクロメア4つと非常に小さなミクロメア4つを生じる。 第5の分裂では、メゾマーは赤道方向に分裂して8個のメゾマーan1とan2の2段を作り、マクロマーは子午線方向に分裂してan2の下に8個の細胞の段を作り、ミクロマーは分裂してveg1層の下に細胞のクラスターを形成する。 6番目の分裂はすべて赤道上にあり、veg2層を形成する。 7回目の分裂はすべて子午線方向で、128個の細胞からなる胚盤が形成される。 それとも、何か固有の時計によって決定されているのだろうか。 1939年にホルスタディウスが最初の3つの切断のうち1つか2つを阻害したところ、ミクロメアの出現は切断の履歴に関係なく適切な時期に起こることがわかった
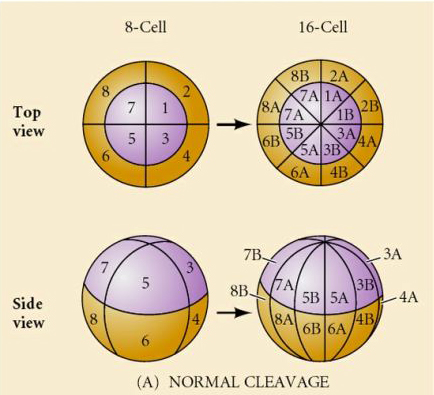
これらの実験からの結論は、卵の植物極にミクロメアの形成を決定する何らかの要因があり、さらに卵活性化に始まる分子時計があるに違いないということである。 この時計は実際の切断現象とは無関係である。
128個の細胞からなる胚盤は、中空の胚盤を取り囲む、かなりゆるい細胞の球体である。 この球は1層の厚さで、すべての細胞が外部のヒアルロン酸層と胚盤胞の内部液に接触している。 発生のこの段階で、細胞は上皮に特徴的なタイトジャンクションを形成し始める。 中央の胚盤胞は、現在、外部環境から隔離されている。 胚珠はその軸をヒアルロン酸層に平行にして分裂を続け、1細胞の厚さの上皮を残す。 胚盤胞は引き続き拡大する。
胚盤胞の拡大パターンを説明するために、2つの説がある
1. 浸透圧説は、イオンとタンパク質が胚珠から胚盤胞に分泌され、その結果、浸透圧の流れによって圧力がかかるとするものである。 Wolpertらの説では、胚盤胞とヒアルロン酸の接着作用によって、胚盤胞の分裂軸が整列されるという。 すなわち、ヒアルロン酸との接着が最も大きく、次に他の胚葉との接着があり、最後に胚盤胞壁との相互作用が最も小さいということである。
胚盤胞の細胞は外面に繊毛を伸ばし、孵化酵素(ヒアリナーゼ)を分泌し、自由遊泳するようになる。
両生類の裂開は放射状対称で全胚葉性であるが、大量の卵黄(その中分子)が裂開を妨害している。 動物極では1mm/min程度で第一裂開が進行するが、植物極では50-100倍遅く(0.02mm/min)進行する。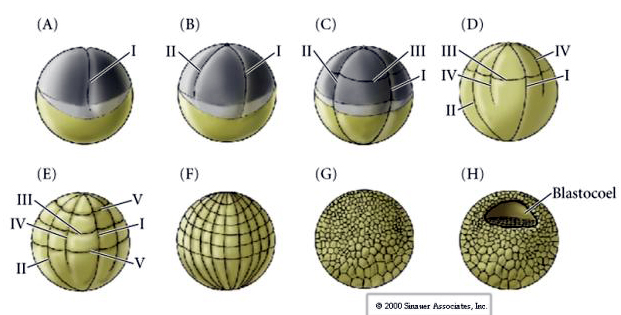
3回目の割断は赤道方向に行われるが、核とアスターが動物側にずれているため、割断面は動物の植物軸に垂直であるが動物極側にずれており、胚葉を均等に分割することができない。 その結果,4つの小さな動物胚葉(MICROMERESと呼ばれる)と4つの大きな植物極胚葉(MACROMERESと呼ばれる)ができる. この不均等なホロブラスチック切断により、より小さなミクロメアからなる分裂の早い動物極と、マクロメアからなる分裂の遅い植物極が生じる。 やがて動物極は多数の小さなミクロメスからなり、植物極は数個の卵黄を含んだ大きなマクロメスからなる。
胚盤胞はどのような機能を果たしているか?
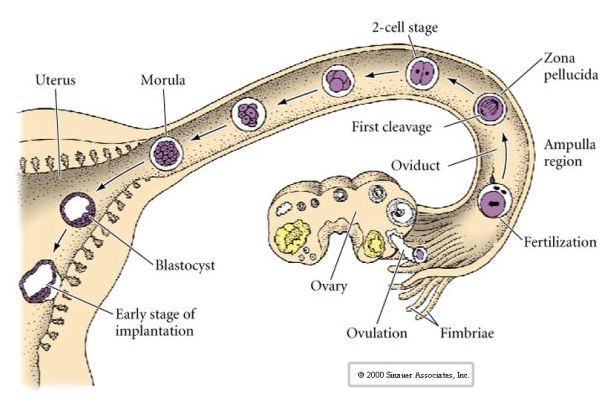
胚盤胞は、細胞が互いに接触しないように空間的に分離している。 通常、胚盤胞の屋根にある細胞は外胚葉になります。 胚盤胞の屋根にある細胞を、胚盤胞の底にあるヨロイ状の細胞の隣に移植すると、中胚葉として分化します。 中胚葉の誘導体は、通常、内胚葉の前駆体に隣接する細胞から作られる。 これから徹底的に調べるが、一つの可能性として、植物細胞が細胞間相互作用を介して、隣接する細胞を中胚葉に誘導することが考えられる。 したがって、胚盤胞の初期細胞間の不適切な「誘導的」相互作用を防ぐために、胚盤胞の形成が必要なのかもしれない。 哺乳類の卵は、卵巣から卵管に放出され、そこで受精する。 受精後約1日で卵管内で最初の割球が始まる。 ほとんどの動物とは対照的に、哺乳類の開裂は非常に遅く–1/日である。
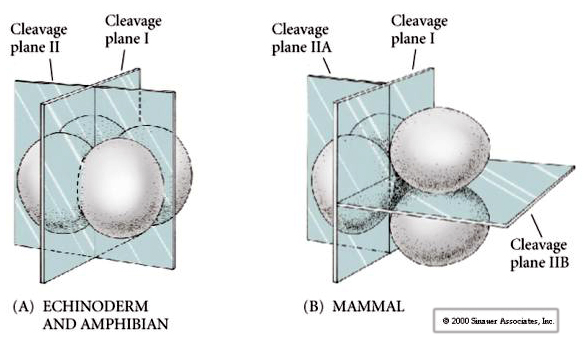 さらに、開裂面は他の動物とは多少異なっている。 第一裂開はウニやカエルと同じように子午面である。 しかし、2回目の分裂では、片方の胚珠が子午線方向に、もう片方が赤道方向に分裂するのです! このような裂開は、ROTATIONAL HOLOBLASTIC CLEAVAGEと呼ばれています。
さらに、開裂面は他の動物とは多少異なっている。 第一裂開はウニやカエルと同じように子午面である。 しかし、2回目の分裂では、片方の胚珠が子午線方向に、もう片方が赤道方向に分裂するのです! このような裂開は、ROTATIONAL HOLOBLASTIC CLEAVAGEと呼ばれています。
哺乳類の裂開のもうひとつの特徴は、ブラストメアの裂開が非同期であることです。 (ウニやカエルが胚盤胞移行中期まで同期しているのに比べて)。 哺乳類胚の裂開は最初から接合核によって制御されている。
3回目の裂開まで、胚盤は私たちが研究した他の動物と同じように、ゆるやかに結合した細胞の球を形成している。 4回目の分裂の前に、胚盤胞の細胞は互いに対する振る舞いを劇的に変化させます。

この結合は、新規の接着分子 UVOMORULIN (E-Cadherin) の産生が一因となっており、ウニと同様に外側の細胞間にタイトジャンクションが形成されて、外から胞体を遮断することで安定化されます。 また、細胞間にはギャップ結合が形成され、イオンなどの小分子やCa++、C-AMPなどのセカンドメッセンジャー分子が通過できるようになっている。 コンパクトになった16個の細胞からなるモルーラは、外側の細胞の皮と、完全に内部にある数個の細胞(1〜2個)から構成されている。 外側の細胞のほとんどは、TROBLASTICまたはTROPHECTODERMAL CELLSを生じさせる。 これらの細胞は胚そのものには寄与しないが、代わりに胚の子宮壁への着床に必要であり、後で述べる胎盤の必須成分であるCHORIANの組織を形成する。
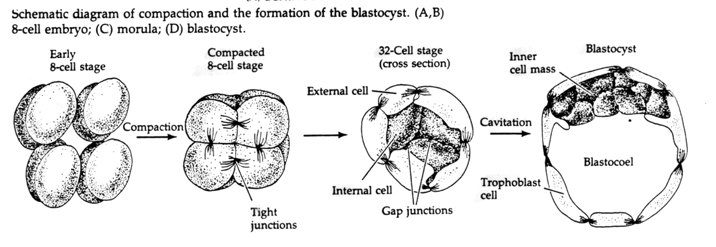
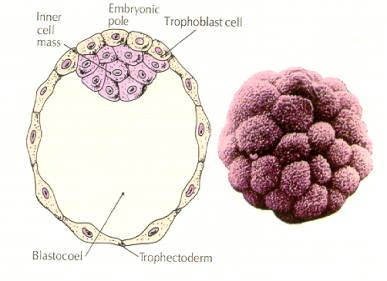
胚の細胞は、16個段階のブラストラの内側の少数の細胞から派生している。 これらの細胞は、胚全体が発達する元となる細胞の内細胞塊を生成する。 6回目の分裂の64細胞期には、内細胞塊と絨毛層は完全に分離される。 絨毛膜は内部で液体を分泌し、胚盤腔を形成する。
 内細胞塊の形成
内細胞塊の形成
内細胞塊はどのように作られるのでしょうか? 内細胞塊の前駆細胞になるように内在的な因子によって運命づけられた特定の胚盤があるのでしょうか。 答えはノーである。 すべての初期胚葉は全能性であり、どの細胞が絨毛膜層に寄与し、どの細胞が内細胞塊に寄与するかは、単に偶然の位置の問題であるように思われます。 4細胞期胚の細胞は、通常は内部細胞塊と対外真皮細胞の両方を生み出すが、32細胞期胚の外側に移植すると対外真皮のみが生み出される。 これらの細胞は、胚の正常な形成には寄与しません。 以前のクローニングの講義で、8細胞期のマウス胚を2つ融合させると正常な胚になることを思い出しましたが、これはその段階のすべての細胞が全能性であることを示唆しています。
胚盤胞
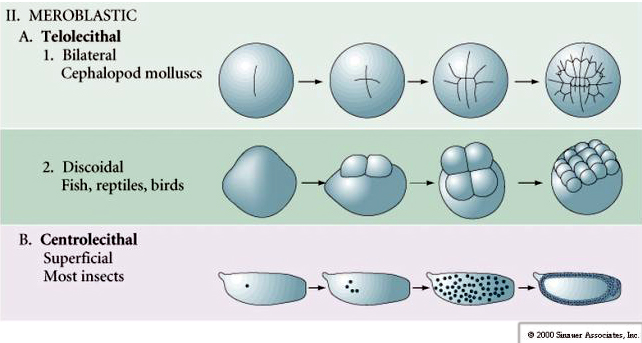
テロルシタル卵とセントロルシタル卵では、大きな密な卵黄が裂開を阻んでいます。 腹腔鏡卵は鳥類、魚類、爬虫類などに、遠心鏡卵は昆虫類に特徴的な卵である。 旋光性卵では円盤状の割球が生じる。 割球は卵の動物極にある胚盤に限定される。
ロルフ・カールストロームによるゼブラフィッシュの発生の動画は素晴らしい。 (Movie by Paul Myers)
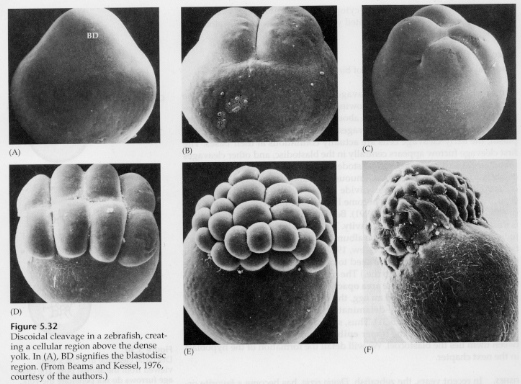 赤道裂までは、胚葉の細胞が卵黄から分離することはないのです。 さらに赤道裂が進むと、3、4個の細胞の厚い多層の胚盤胞が形成される。
赤道裂までは、胚葉の細胞が卵黄から分離することはないのです。 さらに赤道裂が進むと、3、4個の細胞の厚い多層の胚盤胞が形成される。
鳥類では、胚盤胞と卵黄の間に下胚盤腔という空間が形成される。 16回目の分裂(6万個)で胚盤腔に入り、2層目を形成する。 この2つの層は、外側のEPIBLASTと内側のHYPOBLASTと呼ばれ、その間に胚盤胞がある。 後日、鳥類と哺乳類の胚葉形成について詳しく説明する予定である
節足動物の中心卵は「スーパーフィクショナル・クリアベージ」を行う。 卵黄の塊が中心にあるため、卵の細胞質の縁に裂け目ができない。
昆虫では、興味深い、有益なバリエーションが見られる。 接合核は切断されずに分裂する。 つまり、核は細胞質分裂をせずに核分裂をするのです。 この裸の核はエネルジッドと呼ばれる。 核は驚くべき速さで分裂する–8分ごとに(胚発生のすべては22時間しかかからない)。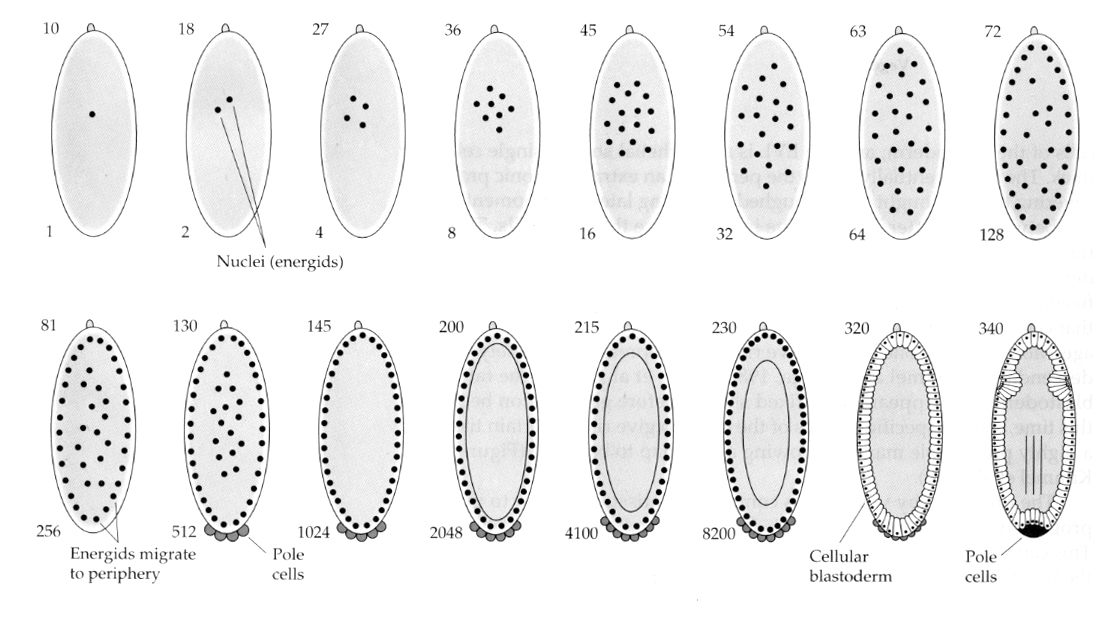
 核分裂を数回繰り返した後、裸の核は卵の周辺に移動していく。 この段階では、すべての核が同じ細胞質を共有しているため、SYNCYTIAL BLASTODERMと呼ばれる。 14回目くらいの核分裂で細胞化が起こり、CELLULAR BLASTODERMが作られる。 この時期以降、細胞は非同期に分裂する。 これは、カエルやウニの胚盤胞移行期中期に相当する。 (母性から接合体中心の遺伝子発現への移行)中胚葉移行はクロマチンと細胞質の比率によって引き起こされると考えられていたことを思い出してください。 ハエにおけるこのメカニズムの証拠は、突然変異体のハプロイド胚を調べるこ とによって見られます。 これらの胚は、中胚葉移行と細胞化を 1 分割後に起こします 15。 さらに、卵を結紮して細胞質の体積を減らすことで、細胞化を促進させることができる。 合胞体胚葉期は、細胞質決定因子に対する拡散障壁がないように見えることから、すべての核が等質であると考えられるが、実際には細胞質は非常に領域化されており、核の周囲には高度に組織化された細胞質ドメインが存在する。
核分裂を数回繰り返した後、裸の核は卵の周辺に移動していく。 この段階では、すべての核が同じ細胞質を共有しているため、SYNCYTIAL BLASTODERMと呼ばれる。 14回目くらいの核分裂で細胞化が起こり、CELLULAR BLASTODERMが作られる。 この時期以降、細胞は非同期に分裂する。 これは、カエルやウニの胚盤胞移行期中期に相当する。 (母性から接合体中心の遺伝子発現への移行)中胚葉移行はクロマチンと細胞質の比率によって引き起こされると考えられていたことを思い出してください。 ハエにおけるこのメカニズムの証拠は、突然変異体のハプロイド胚を調べるこ とによって見られます。 これらの胚は、中胚葉移行と細胞化を 1 分割後に起こします 15。 さらに、卵を結紮して細胞質の体積を減らすことで、細胞化を促進させることができる。 合胞体胚葉期は、細胞質決定因子に対する拡散障壁がないように見えることから、すべての核が等質であると考えられるが、実際には細胞質は非常に領域化されており、核の周囲には高度に組織化された細胞質ドメインが存在する。
MECHANISMS OF CLEAVAGE
Cell Cycle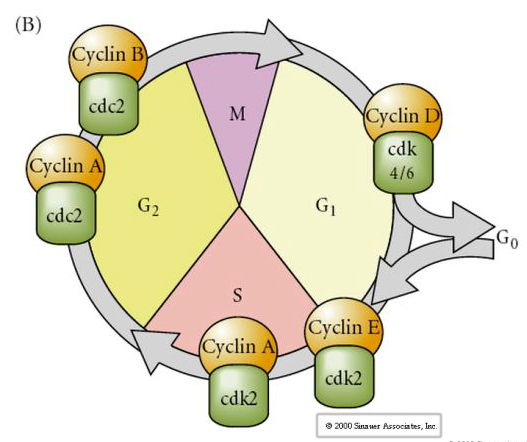
M-mitosis
G1- pre-replication gap
S- DNA synthesis
G2-premitotic gap
flux やfliesなどの開口段階胚では、芽球はG1やG2ステージを介さず直接MからSへ移行しています。 両者とも中胚葉移行後の細胞にはG1とG2がある。 エレガントな移植実験により、核分裂と細胞質分裂の両方を制御しているのは細胞質であることが証明された。 分裂している細胞の核を卵子に移植すると、すぐに分裂が停止する。
 逆に分裂していない細胞の核を受精卵の核に入れると、分裂を開始する。 中心核のない人工的に活性化された有核卵は、割球を思わせる皮質の収縮を起こす。 初期胚の細胞分裂を制御する細胞質因子のいくつかが同定されている。
逆に分裂していない細胞の核を受精卵の核に入れると、分裂を開始する。 中心核のない人工的に活性化された有核卵は、割球を思わせる皮質の収縮を起こす。 初期胚の細胞分裂を制御する細胞質因子のいくつかが同定されている。
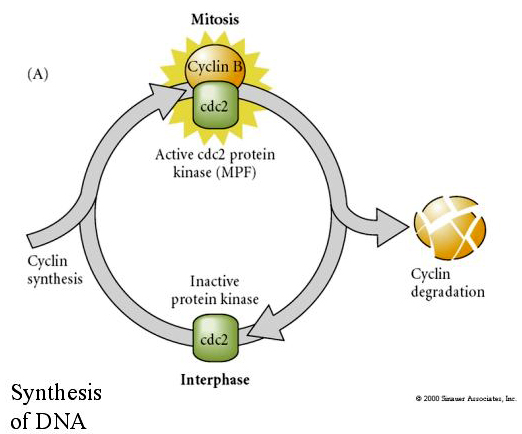
CYTOSTATIC FACTOR(CSF)は第1減数分裂後に上昇し、第2減数分裂中期に卵子を停止させる。 受精すると、CaはCSFを不活性化し、減数分裂は完了し、前核は融合する。
MITOSIS PROMOTING FACTOR(MPF)は、細胞をM期に進入させる。 MPFの活性化により 1.H1ヒストンリン酸化による染色体凝縮、2.3核ラミンの高リン酸化による核膜破壊、3.RNAポリメラーゼ阻害による転写停止、4.ミオシン調節サブユニットのリン酸化による細胞質分裂の阻害。
胚発生の分裂期における細胞周期の周期的制御のモデルとして提案される。 MPFは細胞をSからMに誘導し、CSFはMPFに結合してその不活性化を阻止する。 細胞はMに留まる。Caが増加してCSFが不活性化されると、MPFが不活性化され、細胞はMからSに進み、このサイクルが繰り返される。 MPFはサイクリンBとcdc2という2つのサブユニットで構成されている。 通常の体細胞ではサイクリンBが細胞核で制御された細胞周期特異的な合成と分解を行い、細胞周期を制御している。 しかし、卵形成期の卵にはサイクリンBの「制御因子」とサイクリンBのmRNAが搭載されており、その合成は接合核から独立した母性因子によって制御される。 したがって、母性成分が「なくなる」まで、接合核が引き継ぎ、正常な細胞周期(M、G1、S、G2)が戻ることはない。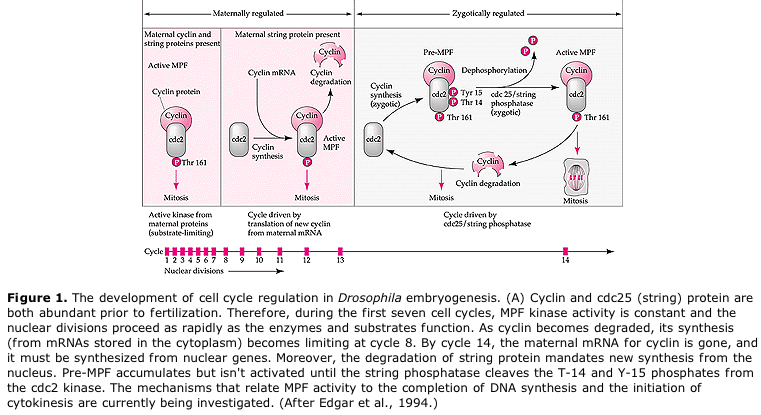
CELL FATE DETERMINATION
初期パターニングの一般および基本メカニズムとしてのディーターミネートの細胞質への局在(例 Tunicate and Sea Urchin)。 発生生物学の主要な問題は、発生中にいつ、どのように細胞の運命が決定されるかということである。 これは、発生中にパターン形成がどのように行われるかという問題と密接に関連している。 胚が機能的な動物を形成するためには、適切な数と種類の分化した細胞 を生み出すだけでなく、それらが胚の他のすべての細胞に対して正しい方法で組 織化されていなければなりません。 我々は、細胞運命決定とパターン形成の2つの可能性を検討する。 1. 1つは、卵生時に卵の中に入れられた内在的な因子によって細胞運命が決定され、その後、割球時に特定の胚葉に区画される可能性、もう1つは、胚の環境から与えられる外来シグナルによって細胞運命を制御するためのパターニング情報がもたらされる可能性です。
細胞質決定因子による自律的な細胞運命指定は、細胞の運命が完全にその系統に依存することを示唆し、一方「制御的」発生は、細胞の運命が他の細胞からの外部シグナルによって決定されることを示唆している。 この2つの細胞仕様のメカニズムは、分離、切除、移植実験によって実験的に区別することができる。 胚から分離した芽球が正常に分化した場合(あたかも胚の正常な位置にあるかのように)、その芽球にはその運命を規定する内在的な決定因子があるはずだと言うことができる。 しかし、もし異常な分化をしたなら、その細胞の運命は外部からのシグナルに依存していると言えるでしょう。 胚から胚盤胞を切除した場合、その胚は異常に発達し、切除した胚盤胞から通常生じ るはずのすべての細胞の運命が失われると、発生は細胞自律的であり、内在的に指 定されていると言うことができる。 しかし、もし胚が正常に発育すれば、残りの胚盤胞がその細胞運命を制御して、欠損した細胞を補うことができる、と言います。
CYTOPLASMIC LOCALIZATION AND REGULATION IN THE TUNICATE EGG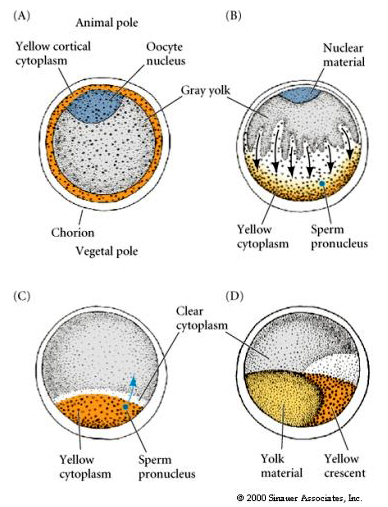
卵形成の終わりに、Tunicate eggには動物と植物の極がはっきりと区別されています。 黄色の皮質細胞質は灰色の黄白色の内部細胞質を取り囲んでいる。 卵丘の核は動物極の方に移動している。 植物極から侵入した精子は卵と受精し、発生を開始する。
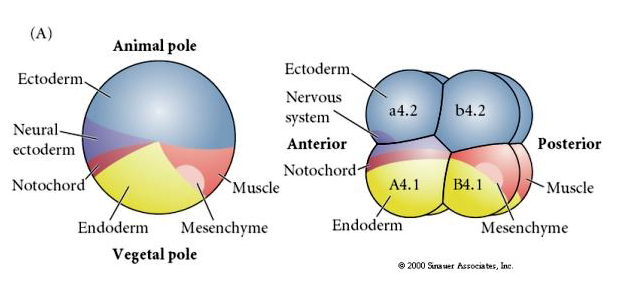 Note the fate map correlated with the different colored cytoplasms of the tunicate embryo.受精後、卵の細胞質の劇的な再配置が起こり、その後の胚腫の運命に相関していると思われる地域的に色のついた細胞質を生じさせます。 2つの図で色が違うので混乱しないように。 オレンジ」黄色の三日月形の細胞質は筋肉の運命と相関し、ヨルキー(黄色)の細胞質は内胚葉の運命と相関している。
Note the fate map correlated with the different colored cytoplasms of the tunicate embryo.受精後、卵の細胞質の劇的な再配置が起こり、その後の胚腫の運命に相関していると思われる地域的に色のついた細胞質を生じさせます。 2つの図で色が違うので混乱しないように。 オレンジ」黄色の三日月形の細胞質は筋肉の運命と相関し、ヨルキー(黄色)の細胞質は内胚葉の運命と相関している。
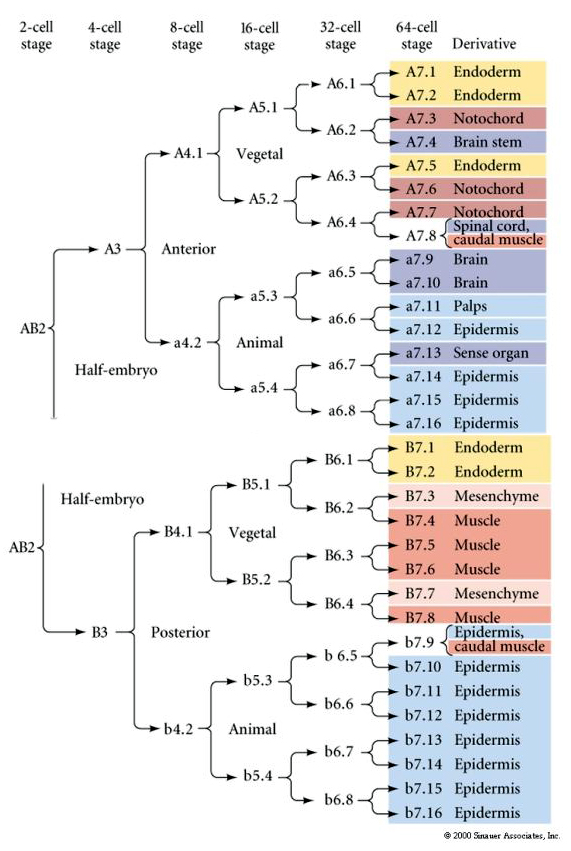 この系統図は、不変細胞切断によって特定の色の細胞質に区画された胚珠との不変系統相関を示している。 しかし、不変の切断と系統は、必ずしも細胞質決定因子による自律的な細胞指定を証明するものではない。
この系統図は、不変細胞切断によって特定の色の細胞質に区画された胚珠との不変系統相関を示している。 しかし、不変の切断と系統は、必ずしも細胞質決定因子による自律的な細胞指定を証明するものではない。
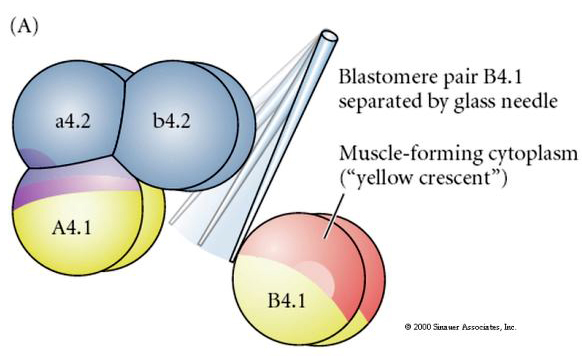 細胞運命の調節的決定と細胞自律的決定を検証するには、実験的操作が必要である。 次の3つの図に示す古典的な分離実験は、細胞運命が、立体構造切断によって獲得した細胞質決定因子によって決定されることを示そうとするものである。 ガラス針を用いて、B4.1対の胚珠を胚の残りの部分から分離する。 B4.1胚葉は通常、筋肉細胞の運命と相関する黄色のクレセント細胞質を獲得する。
細胞運命の調節的決定と細胞自律的決定を検証するには、実験的操作が必要である。 次の3つの図に示す古典的な分離実験は、細胞運命が、立体構造切断によって獲得した細胞質決定因子によって決定されることを示そうとするものである。 ガラス針を用いて、B4.1対の胚珠を胚の残りの部分から分離する。 B4.1胚葉は通常、筋肉細胞の運命と相関する黄色のクレセント細胞質を獲得する。
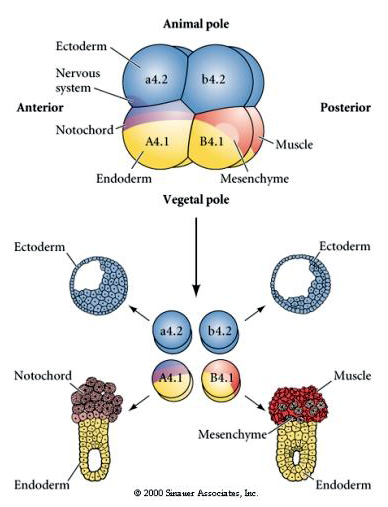
ここで、分離実験の結果を見ることができます。 いずれの場合も、単離された胚珠は、無傷の胚で通常生成されるであろう細胞運命のサブセットのみを生じさせる。 分離された胚盤胞は、欠落した隣人を補うようにその運命を制御することはない。 動物極胚葉のa4.2およびb4.2は外胚葉細胞のみを生じさせる. A4.1はノトコルドと内胚葉の細胞、B4.1は筋肉と内胚葉の細胞を生み出す。
次の実験では、針を使って赤道切断面を操作して、通常よりも植物的にし、今度は動物極の胚盤、b4.2に「黄色の三日月」の細胞質の一部を獲得させるようにします。 これらの胚盤胞を分離すると、今度は筋肉細胞が生まれる。 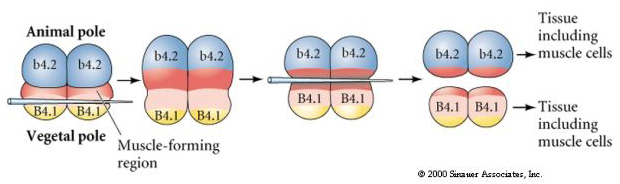
LOCALIZATION AND REGULATION IN THE SEA URCHIN EGG
A jelly canal decines the location of the animal pole and reflect the early polarity of egg. 卵の極性は、精子が侵入する部位に依存せず、卵の固有な極性/非対称性によって決定されるため、初期の開裂パターンは、精子が侵入する部位に依存しない。 Boveri (1901) は、動物-植物軸に直交するように配列された赤道下の色素のバンドを報告した。 また、これらの顆粒は、後にアーケンテロンの細胞に含まれる細胞質の位置を示している。 Horstadius(1928)は,動物と植物の胚盤を分離し,植物胚盤のみが微小胚盤を生じ,原腸を形成し,骨格を形成することを示した. 彼の結論は、植物体半分に存在する細胞質因子が、微小突起、原腸形成、骨格形成に必要であるというものであった 初期裂開のパターンを覚えておこう。
初期裂開のパターンを覚えておこう。
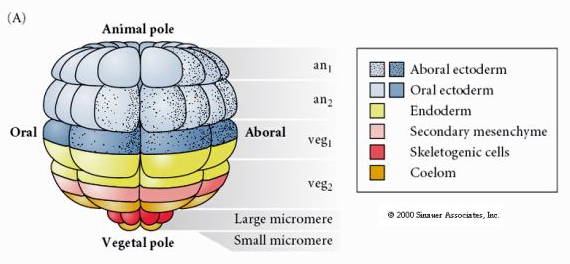 これは64細胞期のウニ胚葉の運命地図である。 微小突起が主要な間充織細胞であり、幼生骨格(pluteus期の有棘細胞)を生じさせることに注目。
これは64細胞期のウニ胚葉の運命地図である。 微小突起が主要な間充織細胞であり、幼生骨格(pluteus期の有棘細胞)を生じさせることに注目。
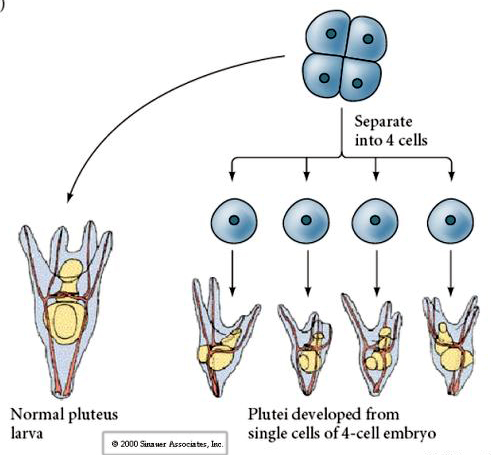 4 細胞の段階で、胚珠が互いに隔離されていると、その運命を「調節」することができ、4つの小さなpluteus期の幼生を生じさせることが可能である。
4 細胞の段階で、胚珠が互いに隔離されていると、その運命を「調節」することができ、4つの小さなpluteus期の幼生を生じさせることが可能である。
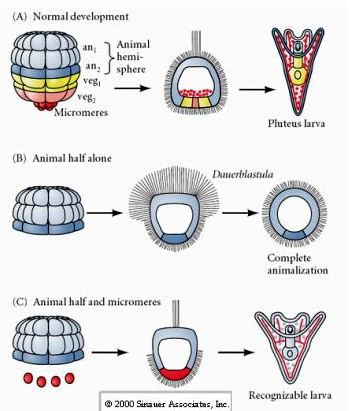 これに対し、後の段階で動物の半胚葉を分離すると、中胚葉や内胚葉の細胞運命を発現しない「動物化した」ダワーブラストゥラを生み出すだけであることがわかる。 植物性半胚葉を分離すると、外胚葉、中胚葉、内胚葉の細胞運命を発現する幼生が生まれ、これらの細胞の運命は制御できることがわかる。 単離されたミクロメア(原始中胚葉)は正しい数の細胞分裂を行い、常に予定通りに棘突起を生じる。 このように、ミクロメアは、16細胞の段階で初めて出現したとき、骨格形成の間充織細胞の前駆体として決定的に特定されるのです。 重要なのは、ミクロメアを動物極の胚珠と一緒に並べて、ミクロメアの運命が生まれた時点で「確定」しているにもかかわらず、ミクロメアが動物極の胚珠に新しい細胞の運命を「誘導」できることを示す実験であった。 ミクロメアは、動物極の胚盤胞に内胚葉と中胚葉の運命を誘導することができたのである。 したがって、「C」の後半の実験は、動物半胚葉にミクロメアを加えると、内胚葉、中胚葉、外胚葉の運命を発現する認識できる幼生の形成を誘導できることを示している。 このことは、ミクロメアが細胞運命を規定する細胞質因子を獲得し、ウミユリ胚の軸構造をパターン化する誘導シグナルを提供することを再び論証している。 ミクロメアの運命は変えられないが、ミクロメアからのシグナルは他のすべての胚葉の運命を変えることができる
これに対し、後の段階で動物の半胚葉を分離すると、中胚葉や内胚葉の細胞運命を発現しない「動物化した」ダワーブラストゥラを生み出すだけであることがわかる。 植物性半胚葉を分離すると、外胚葉、中胚葉、内胚葉の細胞運命を発現する幼生が生まれ、これらの細胞の運命は制御できることがわかる。 単離されたミクロメア(原始中胚葉)は正しい数の細胞分裂を行い、常に予定通りに棘突起を生じる。 このように、ミクロメアは、16細胞の段階で初めて出現したとき、骨格形成の間充織細胞の前駆体として決定的に特定されるのです。 重要なのは、ミクロメアを動物極の胚珠と一緒に並べて、ミクロメアの運命が生まれた時点で「確定」しているにもかかわらず、ミクロメアが動物極の胚珠に新しい細胞の運命を「誘導」できることを示す実験であった。 ミクロメアは、動物極の胚盤胞に内胚葉と中胚葉の運命を誘導することができたのである。 したがって、「C」の後半の実験は、動物半胚葉にミクロメアを加えると、内胚葉、中胚葉、外胚葉の運命を発現する認識できる幼生の形成を誘導できることを示している。 このことは、ミクロメアが細胞運命を規定する細胞質因子を獲得し、ウミユリ胚の軸構造をパターン化する誘導シグナルを提供することを再び論証している。 ミクロメアの運命は変えられないが、ミクロメアからのシグナルは他のすべての胚葉の運命を変えることができる
Horstadius: (1928, 1935)は16細胞期胚において、キメラ胚の異なる位置に移植すると、ミクロメアを除くすべての層の胚珠が異なる運命をたどることを実験的に示した。 ベグ2細胞を除去し、ミクロメアをベグ1層に接触させると、ベグ1胚葉からアルケステロンが発生する。 ミクロメアがない場合、veg 2胚葉はアルケステロンと骨格構造を生じさせる。 古典的には、これらの結果を説明するために、動物-植物勾配が引き合いに出されてきた。 しかし、この結果は、隣接する胚葉層の間で決定的な誘導的相互作用が起こることを示しているに過ぎない。
動物極の近くに移植された個々のミクロメアは、頂端房の形成を抑制し、場合によっては新しい胚軸を誘導する。
GENERAL RESULT OF TRANSPLANTATIONS:ある胚葉の運命は、正常胚では常に、隣接する異なる隣接細胞の付着によって影響を受けることが判明しています。
。