Cleavage verwijst naar het stereotiepe patroon van vroege mitotische delingen waarbij het grote volume cytoplasma van het ei wordt opgedeeld. De vroege zygote is uniek omdat hij zo groot is. De meeste cellen ondergaan een periode van groei tussen cycli van mitose, maar dit geldt niet voor de vroege blastomeren in het cleavage stadium. Bij elke deling worden de cellen kleiner. Dit snelle patroon van celdeling zonder gelijktijdige groei stopt abrupt in het stadium dat de mid-blastula-overgang wordt genoemd, waar de zygotische kern de controle over de celcyclus overneemt.
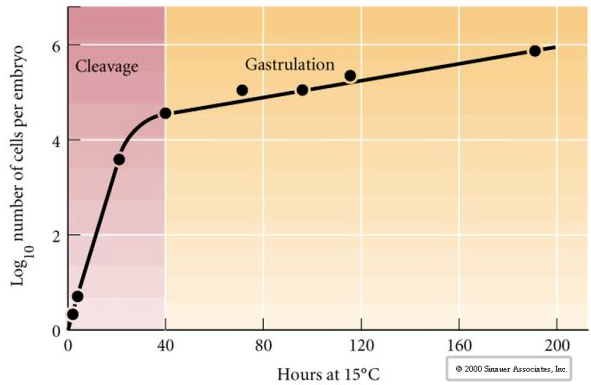 Er zijn aanwijzingen dat een maternale factor, misschien een transcriptionele regulator, verantwoordelijk is voor dit vroege snelle patroon van splijtingsdeeltingen. Door de verhouding tussen cytoplasmatisch en kern-DNA kunstmatig te wijzigen, kan het tijdstip van de midblastula-overgang worden gewijzigd. De midblastula-overgang is het tijdstip waarop de grote omschakeling van expressie van maternale naar zygotische genen plaatsvindt.
Er zijn aanwijzingen dat een maternale factor, misschien een transcriptionele regulator, verantwoordelijk is voor dit vroege snelle patroon van splijtingsdeeltingen. Door de verhouding tussen cytoplasmatisch en kern-DNA kunstmatig te wijzigen, kan het tijdstip van de midblastula-overgang worden gewijzigd. De midblastula-overgang is het tijdstip waarop de grote omschakeling van expressie van maternale naar zygotische genen plaatsvindt.
Vruchting leidt bij sommige soorten tot radicale cytoplasmatische bewegingen die essentieel zijn om ervoor te zorgen dat de cytoplasmatische determinanten zich op de juiste plaats bevinden ten opzichte van de daaropvolgende splitsingsgebeurtenissen.
PATTERNEN VAN EMBRYONISCHE CLEAVAGE
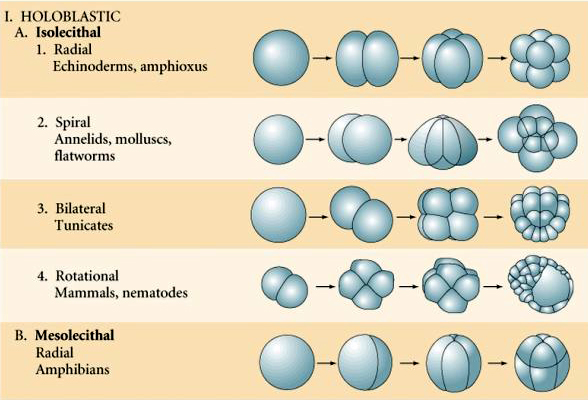
Patroon van embryonale cleavage wordt bepaald door zowel de positie van de mitotische spindels als door de hoeveelheid en verdeling van dooier. Dooier heeft de neiging de splitsing te remmen. Het vertraagt de splitsing of verhindert zelfs de volledige splitsing. Dooier is een aanpassing van die dieren die min of meer de embryogenese doorlopen geïsoleerd van enig voedselaanbod. Sommige dieren, zoals zee-egels, hebben betrekkelijk weinig dooier omdat zij zich snel ontwikkelen tot een vrij zwemmende larvale vorm die voedingsstoffen uit hun omgeving haalt. Andere dieren, zoals buideldieren, worden te vroeg geboren, maar worden gevoed in een ouderlijke buidel. Placentale zoogdieren ontwikkelen een gespecialiseerd orgaan waardoor het embryo tijdens de ontwikkeling wordt gevoed en hebben dus ook weinig dooier.
De soorten eieren op basis van dooierkenmerken worden beschreven als:
Isolecithaal: spaarzame, gelijkmatig verdeelde dooier, bv. zee-egel, muis
Mesolecthal: matige hoeveelheid dooier, vaak ongelijk verdeeld, bv, kikker
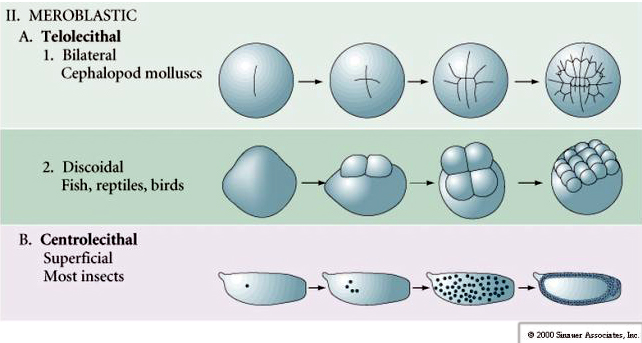
Telolecithaal: dichte dooier geconcentreerd aan één uiteinde, b.v. vogel, reptiel
Centrolecithaal: dooier geconcentreerd in het midden van het ei, b.v. vlieg
Veel eieren zijn gepolariseerd met een dooierrijke pool, de vegetale pool genoemd, en een dooierarme pool, de dierlijke pool, b.v., kikker. De zygotische kern is over het algemeen verplaatst naar de dierlijke pool. Zygoten met betrekkelijk weinig dooier (isolecithale en mesolecithale) klieven HOLOBLASTISCH. De splijtingsgroef loopt helemaal door het ei. Terwijl telolecithale en centrolecithale zygoten MEROBLASTISCHE splitsing ondergaan, waarbij het splitsingsvlak zich slechts tot de opgehoopte dooier uitstrekt. In centrolecithale eieren (veel insecteneieren) is de splijting meroblastisch en oppervlakkig, terwijl in telolecithale eieren (vogels en vissen) de splijting schijfvormig is
Er zijn verschillende types van splijting symmetrie in de natuur: radiaal (stekelhuidigen, amfibieën), spiraalvormig (weekdieren, anneliden), bilateraal (ascidiën, manteldieren), roterend (zoogdieren). De twee onderstaande figuren tonen voorbeelden van holoblastische en meroblastische splijtingsymmetrieën.
RADIALE HOLOBLASTISCHE CLEAVAGE
Uitstekende film van de splijting van zee-egels uit “A Dozen Eggs” van Rachel Fink.
Zee-egels hebben ook een radiale holoblastische splijting, maar met enkele interessante verschillen. De eerste splijting is meridionaal. De tweede splijting is meridionaal. De derde splitsing is equatoriaal De vierde splitsing is meridionaal, maar terwijl de vier cellen van de dierlijke pool zich gelijk verdelen om acht even grote dierlijke blastomeren te vormen, die MESOMERES worden genoemd, verdelen de vegetale cellen zich asymmetrisch langs het equatoriale vlak om vier grote MACROMERES te vormen en vier veel kleinere MICROMERES aan de vegetale pool. De vijfde deling: de MESOMERES delen zich equatoriaal en vormen zo twee lagen van acht MESOMERES an1 en an2, de MACROMERES delen zich meridionaal en vormen zo een laag van acht cellen onder an2, de MICROMERES delen zich en vormen zo een cluster van cellen onder de veg1-laag. De zesde delingen zijn allemaal equatoriaal, waardoor een veg2-laag ontstaat. De zevende deling is meridionaal en geeft een blastula met 128 cellen.
Wat bepaalt deze splitsingspatronen? Zijn ze afhankelijk van de vorige splitsing en worden ze als een bandje afgespeeld of worden ze bepaald door een intrinsieke klok? In 1939 remde Horstadius een of twee van de eerste drie splitsingen en ontdekte dat het verschijnen van de micromeren op het juiste moment plaatsvond, ongeacht de geschiedenis van de splitsingen
De conclusie van deze experimenten is dat er een factor in de vegetale pool van het ei is die de vorming van de micromeren bepaalt en verder dat er een moleculaire klok moet zijn die begint bij de activering van het ei. De klok is onafhankelijk van de eigenlijke splitsing.
De blastula met 128 cellen is een tamelijk losse bal van cellen rond een holle blastocoel. De bal is één cellaag dik en alle cellen staan in contact met de externe hyalische laag en de interne vloeistof van de blastocoel. In dit stadium van de ontwikkeling beginnen de cellen de voor een epitheel kenmerkende tight junctions te vormen. De centrale blastocoel is nu geïsoleerd van de externe omgeving. De blastomeren blijven zich delen met hun as parallel aan de hyalische laag, en blijven een epitheel van één cel dik. De blastocoel blijft zich uitbreiden.
Twee theorieën trachten het uitbreidingspatroon van de blastocyst
te verklaren1. De osmotische theorie suggereert dat ionen en proteïnen door de blastomeren in de blastocoel worden uitgescheiden en dat dit resulteert in een drukopbouw als gevolg van de osmotische waterstroom. Deze druk zou dan verantwoordelijk zijn voor de uitlijning van de mitose-as van de blastomeren en de vergroting van de blastocoel.
2. De alternatieve theorie van Wolpert en zijn collega’s suggereert dat het eigenlijk de adhesieve interacties tussen de blastomeren onderling en tussen de blastomeren en de hyalische laag is die de mitotische assen uitlijnt. Dat wil zeggen dat de adhesie aan het hyalien het grootst is, de adhesie aan andere blastomeren volgt, en tenslotte is de interactie met de blastocoelwand het kleinst. De dominante adhesie met de hyalinelaag dwingt de expansie van de blastocyst en de blastocoel.
De cellen van de blastula groeien cilia aan hun buitenoppervlak, scheiden een broedenzym (hyalinase) af en worden vrij zwemmend.
AMPHIBIÕN CLEAVAGE
Cleavage bij veel amfibieën is holoblastisch met radiale symmetrie, maar het grote volume van de dooier (zijn mesolecithaal) interfereert met de cleavage. Aan de dierlijke pool verloopt de eerste splitsing ongeveer 1 mm/min, terwijl die aan de vegetale pool 50-100 maal langzamer verloopt (,02 mm/min). Terwijl de eerste splitsing nog onvolledig is in de yolky vegetale regio van het ei, begint de tweede meridionale splitsing.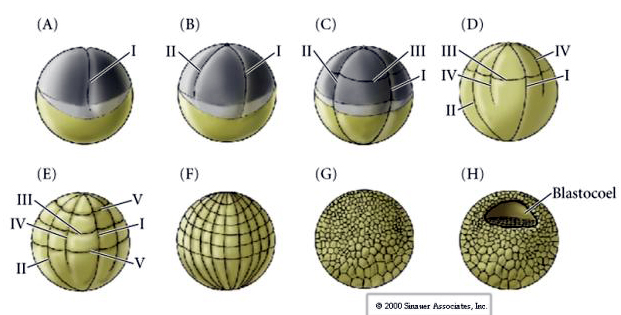
De derde splitsing is equatoriaal, maar omdat de kernen en asters naar de dierlijke pool zijn verplaatst, wordt het splitsingsvlak, hoewel het loodrecht op de dierlijke vegetale as staat, ook naar de dierlijke pool verplaatst en worden de blastomeren niet gelijkmatig gesplitst. Het resultaat zijn vier kleinere dierlijke blastomeren (MICROMERES genoemd) en vier grote blastomeren van de vegetale pool (MACROMERES genoemd). Door deze ongelijke holoblastische splitsing ontstaat een sneller delende dierlijke pool die bestaat uit kleinere micromeren en een langzamer delende vegetale pool die bestaat uit macromeren. De dierlijke pool bestaat weldra uit vele kleine micromeren en de vegetale pool uit enkele met dooier gevulde grote macromeren. Hoewel de vorming van de blastocoel begint met de eerste splitsing, wordt zij pas duidelijk in het stadium van 128 cellen.
WELKE FUNCTIE HEEFT DE BLASTOCOEL?
De blastocel scheidt de cellen ruimtelijk van elkaar, zodat zij elkaar niet raken. Cellen op het dak van de blastocoel worden normaal gesproken ectoderm. Als u cellen van het dak van de blastocoel naast de yolky cellen aan de basis van de blastocoel transplanteert, zullen zij zich differentiëren tot mesoderm. Mesodermale derivaten worden normaliter geproduceerd uit cellen die grenzen aan de voorlopers van het endoderm. Een mogelijkheid die wij grondig zullen onderzoeken is dat de vegetale cellen via cel-cel interacties de aangrenzende cellen aanzetten tot mesodermale differentiatie. De vorming van de blastocoel kan dus noodzakelijk zijn om ongepaste “inductieve” interacties tussen vroege cellen van de blastocyst te voorkomen. De tweede duidelijke behoefte aan de blastocoel kan zich voordoen tijdens het daaropvolgende ontwikkelingsstadium, GASTRULATIE, waarbij cellen naar het inwendige van de blastocoel migreren.
MAMMALIÕN KIEZING
De eicel van zoogdieren komt uit de eierstok vrij in de eileider, waar hij wordt bevrucht. De eerste splitsing begint ongeveer een dag na de bevruchting in de eileider. In schril contrast met de meeste dieren kan de ontkoling bij zoogdieren zeer traag verlopen—1/dag.
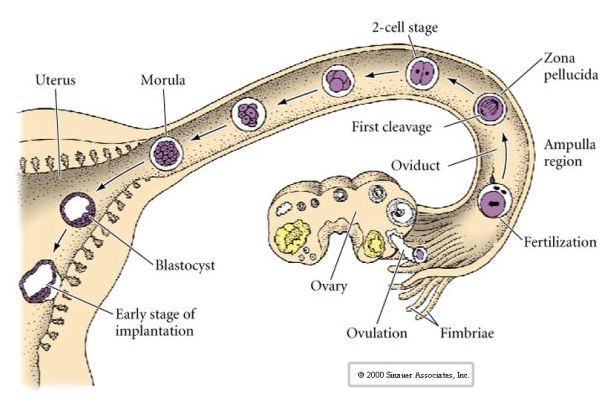
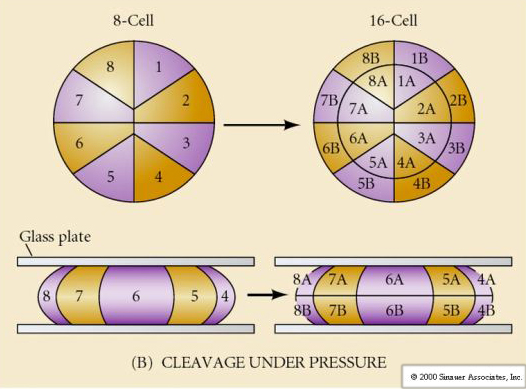
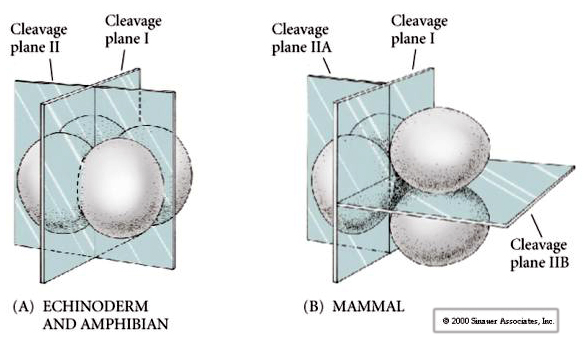 Daarnaast zijn de ontkolingsvlakken enigszins verschillend van die bij andere dieren. De eerste splitsing is meridionaal, net als bij de zee-egel en de kikker. Bij de tweede splitsing deelt een van de blastomeren zich echter meridionaal en de andere equatoriaal! Dit type splitsing wordt ROTATIONELE HOLOBLASTISCHE CLEAVAGE genoemd.
Daarnaast zijn de ontkolingsvlakken enigszins verschillend van die bij andere dieren. De eerste splitsing is meridionaal, net als bij de zee-egel en de kikker. Bij de tweede splitsing deelt een van de blastomeren zich echter meridionaal en de andere equatoriaal! Dit type splitsing wordt ROTATIONELE HOLOBLASTISCHE CLEAVAGE genoemd.
Een ander uniek kenmerk van de splitsing bij zoogdieren is dat de blastomeren asynchroon worden gesplitst. (in vergelijking met de synchronie bij de zee-egel en de kikker tot aan de midblastula-overgang). De splitsing van het zoogdierembryo wordt vanaf het begin geregeld door de zyotische kern.
Tijdens de derde splitsing vormen de blastomeren een bal van losjes geassocieerde cellen, net als bij de andere dieren die we hebben bestudeerd. Vóór de vierde splitsing veranderen de cellen van de blastula dramatisch hun gedrag ten opzichte van elkaar. Zij proberen snel hun contacten met de andere blastomeren te maximaliseren, waardoor de blastula zich verdicht.

Deze COMPACTIE is gedeeltelijk het gevolg van de productie van een nieuw adhesiemolecuul UVOMORULIN (E-Cadherine) en wordt gestabiliseerd door de vorming van hechte verbindingen tussen de buitenste cellen, die net als bij de zee-egel het inwendige van de blastula van het uitwendige afsluiten. De cellen vormen onderling ook “gap junctions” die de doorgang mogelijk maken van kleine moleculen, zoals ionen en sommige “second messenger” moleculen zoals Ca++ en C-AMP. De samengeperste 16-cellig morula bestaat uit een buitenste korst van cellen en enkele cellen (1-2) volledig inwendig. Uit de meeste uitwendige cellen ontstaan de TROBLASTISCHE OF TROPHECTODERMALE CELLEN. Deze cellen dragen niet bij tot het eigenlijke embryo, maar zijn in plaats daarvan noodzakelijk voor de innesteling van het embryo in de baarmoederwand en vormen de weefsels van de CHORIA, een essentieel onderdeel van de placenta, waarover later meer.
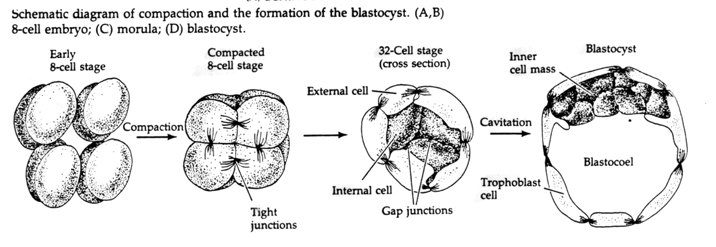
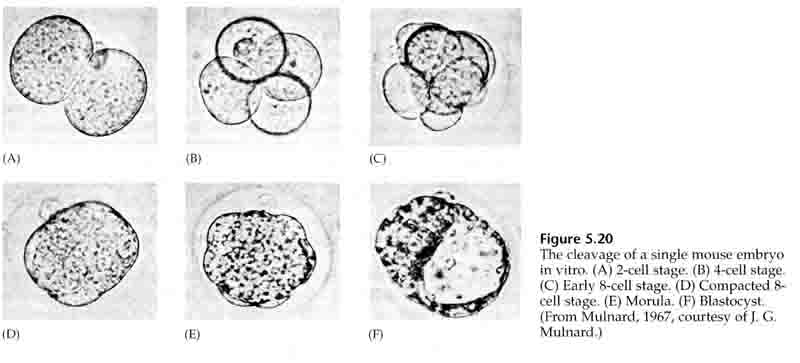
De cellen van het embryo zijn afkomstig van de binnenste paar cellen van de blastula in het 16-cellig stadium. Uit deze cellen ontstaat de binnenste celmassa waaruit het hele embryo zich ontwikkelt. Bij de 6e splitsing, het 64-cellig stadium, zijn de binnenste celmassa en de trofoblastische laag volledig gescheiden. De trofoblasten scheiden inwendig vocht af om de blastocoel te vormen. Het embryo wordt nu een blastocyste genoemd.
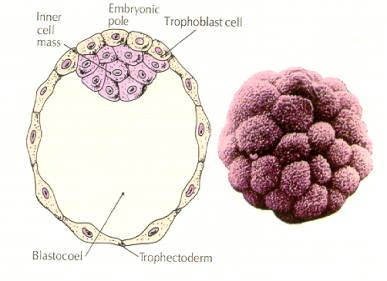 VORMING VAN DE BINNENCELMASSAGE
VORMING VAN DE BINNENCELMASSAGE
Hoe ontstaan deze cellen van de binnenste celmassa? Zijn er bepaalde blastomeren die door intrinsieke factoren voorbestemd zijn om binnencelmassa-progenitor te worden? Het antwoord lijkt neen te zijn. Alle vroege blastomeren lijken totipotent te zijn en de bepaling van welke cellen zullen bijdragen tot de trofoblastische laag en welke tot de binnenste celmassa is gewoon een kwestie van toevallige positie. Cellen van een embryo in het vierde celstadium, waaruit normaliter zowel de binnenste celmassa als de trophectodermcellen ontstaan, die aan de buitenkant van een embryo in het 32e celstadium worden getransplanteerd, geven alleen trophectoderm. Zij dragen niet bij tot het eigenlijke embryo. Herinner u uit de eerdere lezing over klonen dat fusie van twee muizenembryo’s in het 8-cellig stadium een normaal embryo oplevert, wat suggereert dat alle cellen in dat stadium totipotent zijn.
MEROBLASTIC CLEAVAGE
In telolecithale en centrolecithale eieren verhindert de grote dichte dooier splitsing. Telolecithale eieren zijn kenmerkend voor vogels, vissen en reptielen, terwijl centrolecithale eieren kenmerkend zijn voor insecten. Telolecithale eieren resulteren in meroblastische discoïdale klieving. De splitsing is beperkt tot de blastodiscus aan de dierlijke pool van het ei. Bij vroege splitsingen, omdat de splitsing niet door de dooier kan gaan, zijn de blastomeren aan hun vegetale randen ononderbroken.
Deze film van de ontwikkeling van de zebravis doorolf Karlstrom is uitstekend. (Film door Paul Myers)
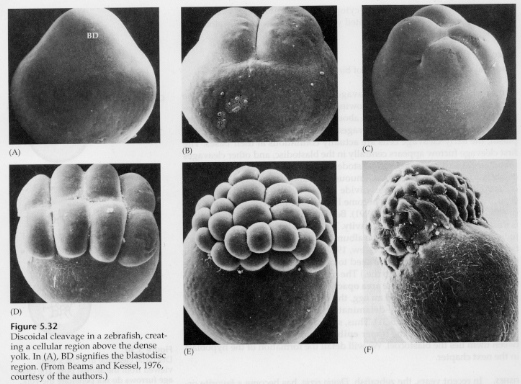 Pas bij de equatoriale splitsingen scheiden de cellen van het blastoderm zich van de dooier. Verdere equatoriale splitsingen creëren een meerlagig blastoderm met een dikte van drie of vier cellen.
Pas bij de equatoriale splitsingen scheiden de cellen van het blastoderm zich van de dooier. Verdere equatoriale splitsingen creëren een meerlagig blastoderm met een dikte van drie of vier cellen.
Bij vogels vormt zich tussen het blastoderm en de dooier een ruimte die de SUBGERMINALE Holte wordt genoemd. Door de 16-deling (60.000 cellen) migreren cellen van het blastoderm in de subgerminale holte om een tweede laag te vormen. De twee lagen worden de buitenste EPIBLAST en de binnenste HYPOBLAST genoemd, met daartussen de blastocoel. Wij zullen dit later meer in detail bestuderen wanneer wij de gastrulatie bij vogels en zoogdieren bespreken
Centrocital eieren van geleedpotigen ondergaan een SUPERFICIËLE CLEAVAGE. De grote centrale dooiermassa beperkt de splitsing tot de cytoplasmatische rand van het ei.
Een interessante en informatieve variatie wordt gezien bij insecten. De zygotische kernen delen zich zonder splitsing. Dat wil zeggen de kernen ondergaan karyokinesis—-mitotische deling van de celkern–zonder cytokinesis–de deling van de cel. Deze naakte kernen worden ENERGIDS genoemd. De kernen delen zich met een verbazingwekkende snelheid–om de 8 minuten (de gehele embryogenese duurt slechts 22 uur).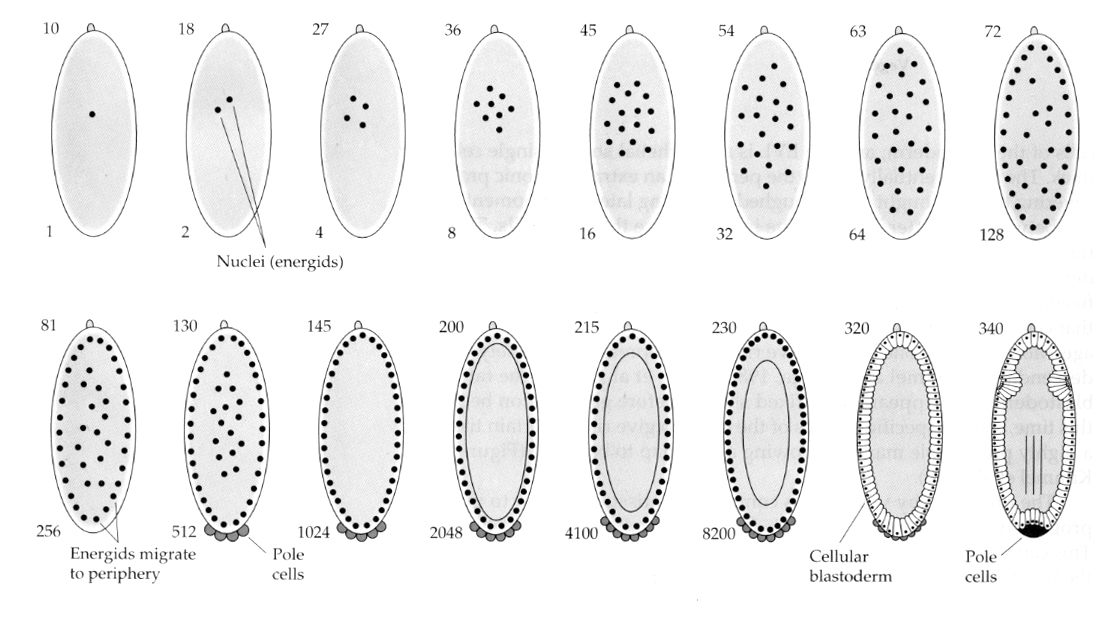
 Na verschillende rondes van karyokinese migreren de naakte kernen naar de periferie van het ei. In dit stadium wordt het SYNCYTIALE BLASTODERM genoemd omdat alle kernen hetzelfde cytoplasma delen. Cellularisatie treedt op bij ongeveer de 14e celdeling om het CELLULAIRE BLASTODERM te vormen. Na dit tijdstip delen de cellen zich asynchroon. Dit komt overeen met de midblastula-overgang bij kikkers en zee-egels. (overgang van maternale naar hoofdzakelijk zygotische genexpressie) Vergeet niet dat men dacht dat de midblastula-overgang werd teweeggebracht door de verhouding chromatine/cytoplasma. Bewijs voor dit mechanisme bij vliegen wordt geleverd door mutante haploïde embryo’s te onderzoeken. Deze embryo’s ondergaan de midblastula-overgang en cellularisatie een deling later 15e. Bovendien kun je de cellularisatie versnellen door het ei af te binden en het cytoplasmavolume te verkleinen. Hoewel het syncytiale blastoderstadium suggereert dat alle kernen equipotent zijn in die zin dat er geen diffusionele barrières voor cytoplasmatische determinanten lijken te zijn, is het cytoplasma in feite sterk geregionaliseerd en hebben de kernen sterk georganiseerde cytoplasmatische domeinen rondom zich.
Na verschillende rondes van karyokinese migreren de naakte kernen naar de periferie van het ei. In dit stadium wordt het SYNCYTIALE BLASTODERM genoemd omdat alle kernen hetzelfde cytoplasma delen. Cellularisatie treedt op bij ongeveer de 14e celdeling om het CELLULAIRE BLASTODERM te vormen. Na dit tijdstip delen de cellen zich asynchroon. Dit komt overeen met de midblastula-overgang bij kikkers en zee-egels. (overgang van maternale naar hoofdzakelijk zygotische genexpressie) Vergeet niet dat men dacht dat de midblastula-overgang werd teweeggebracht door de verhouding chromatine/cytoplasma. Bewijs voor dit mechanisme bij vliegen wordt geleverd door mutante haploïde embryo’s te onderzoeken. Deze embryo’s ondergaan de midblastula-overgang en cellularisatie een deling later 15e. Bovendien kun je de cellularisatie versnellen door het ei af te binden en het cytoplasmavolume te verkleinen. Hoewel het syncytiale blastoderstadium suggereert dat alle kernen equipotent zijn in die zin dat er geen diffusionele barrières voor cytoplasmatische determinanten lijken te zijn, is het cytoplasma in feite sterk geregionaliseerd en hebben de kernen sterk georganiseerde cytoplasmatische domeinen rondom zich.
MECHANISMEN VAN DE CLEAVAGE
Celcyclus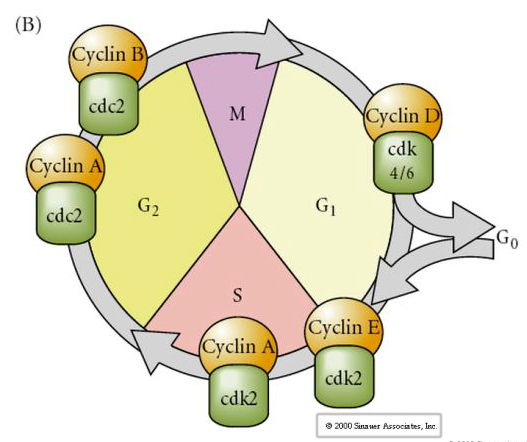
M-mitose
G1- pre-replicatiekloof
S- DNA-synthese
G2-premitotische kloof
In embryo’s met een cleavagestadium, zoals kikkers en vliegen, gaan de blastomeren rechtstreeks van M naar S zonder tussenliggende G1- of G2-stadia. Na de midblastula-overgang hebben cellen in beide dieren een G1- en G2-stadium. Elegante transplantatie-experimenten hebben aangetoond dat het het cytoplasma is dat zowel de karyokinese als de cytokinese regelt. Als kernen van delende cellen worden getransplanteerd in eicellen, stoppen zij onmiddellijk met delen.
 Omgekeerd, als kernen van niet-delende cellen in bevruchte enucleaire eicellen worden gebracht, beginnen zij te delen. Kunstmatig geactiveerde eicellen zonder centriolen zullen corticale contracties ondergaan die doen denken aan splitsing. Enkele van de cytoplasmatische factoren die de celdeling in het vroege embryo regelen, zijn geïdentificeerd.
Omgekeerd, als kernen van niet-delende cellen in bevruchte enucleaire eicellen worden gebracht, beginnen zij te delen. Kunstmatig geactiveerde eicellen zonder centriolen zullen corticale contracties ondergaan die doen denken aan splitsing. Enkele van de cytoplasmatische factoren die de celdeling in het vroege embryo regelen, zijn geïdentificeerd.
CYTOSTATIC FACTOR (CSF) wordt verhoogd na de eerste meiotische deling en stopt de eicel in de tweede meiotische metafase. Bij de bevruchting inactiveert de Ca CSF, de meiose wordt voltooid en de pronuclei versmelten.
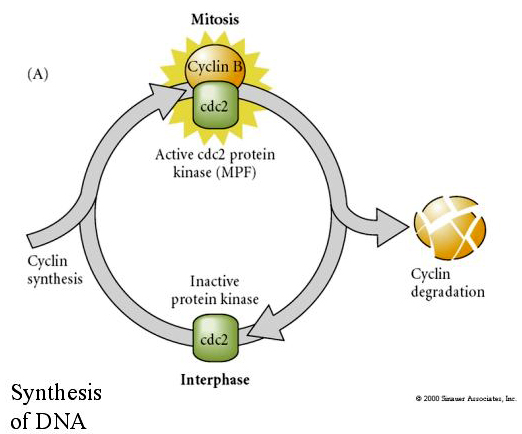
MITOSIS PROMOTING FACTOR (MPF) zorgt ervoor dat de cellen in de M-fase komen. MPF-activering veroorzaakt: 1. chromosoomcondensatie door H1 histonfosforylering, 2. afbraak van de nucleaire envelop door hyperfosforylering van 3 nucleaire lamines, 3. remming van RNA polymerase om de transcriptie stil te leggen, 4. fosforylering van Myosine regulerende subeenheid om de cytokinese af te remmen.
Gesteld model voor cyclische regulering van de celcyclus tijdens de splitsingsfasen van de embrogenese. MPF induceert cel om van S naar M te gaan. CSF bindt aan MPF en voorkomt inactivatie. De cel blijft in M. Ca neemt toe en veroorzaakt de inactivering van CSF, die op haar beurt leidt tot de inactivering van MPF en de cel gaat via M naar S en de cyclus wordt herhaald. MPF bestaat uit twee subeenheden, cycline B en cdc2. Het is cycline B dat een celcyclus-specifieke synthese en degradatie ondergaat die door de celkern wordt gereguleerd om de celcyclus in normale somatische cellen te controleren. Tijdens de oogenese is de eicel echter geladen met “regulatoren” van cycline B en cycline B-mRNA, zodat de synthese ervan wordt geregeld door maternale factoren, onafhankelijk van de zygotische kern. Pas wanneer de maternale componenten “opgebruikt” zijn, neemt de zygotische kern het over en keert een normale celcyclus (M, G1, S, G2) terug.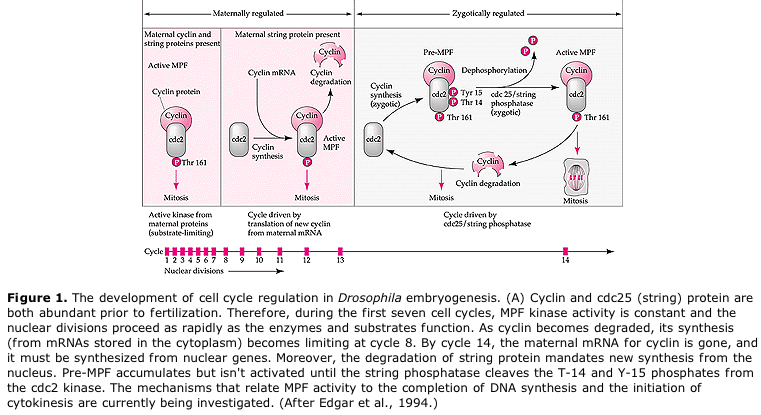
CELFAATDETERMINATIE
Cytoplasmatische lokalisatie van DETERMINANTEN als een algemeen en basismechanisme voor vroege patroonvorming (voorbeelden Tunicate en Sea Urchin). Een belangrijke vraag in de ontwikkelingsbiologie is wanneer en hoe het lot van cellen wordt bepaald tijdens de ontwikkeling. Dit is nauw verbonden met de vraag hoe patroonvorming tijdens de ontwikkeling plaatsvindt. Het embryo moet niet alleen het juiste aantal en type gedifferentieerde cellen genereren, maar ze moeten ook op de juiste manier georganiseerd zijn ten opzichte van alle andere cellen in het embryo om een functioneel dier te vormen. We zullen twee mogelijkheden van cel lot bepaling en patroonvorming onderzoeken: 1. 1. Het lot van de cellen kan worden bepaald door intrinsieke factoren die tijdens de oogenese in de eicel worden gebracht en vervolgens tijdens de splitsing aan specifieke blastomeren worden toegewezen, 2. Extrinsieke signalen uit de omgeving van het embryo kunnen de patrooninformatie leveren om het lot van de cellen te regelen. Zoals we zullen zien, gebruiken de meeste complexe organismen een combinatie van intrinsieke en extrinsieke signalen om de celdeling en embryonale patroonvorming te regelen.
Autonome celdeling door cytoplasmatische determinanten suggereert dat het lot van een cel volledig afhankelijk is van zijn afstamming, terwijl “regulatieve” ontwikkeling suggereert dat het lot van een cel wordt bepaald door externe signalen van andere cellen. Deze twee mechanismen van celspecificatie kunnen experimenteel van elkaar worden onderscheiden door isolatie-, ablatie- en transplantatie-experimenten. Als een uit een embryo geïsoleerde blastmere normaal differentieert (alsof hij nog op zijn normale plaats in het embryo zit), kunnen we zeggen dat hij intrinsieke determinanten moet hebben die zijn lot bepalen. Maar als het abnormaal differentieert, kunnen we zeggen dat het lot van de cel afhankelijk is van externe signalen. Als we een blastomeer van een embryo wegsnijden en het embryo zich abnormaal ontwikkelt, waarbij alle cellymfaten ontbreken die normaal uit het weggesneden blastomeer ontstaan, dan zeggen we dat de ontwikkeling celautonoom en intrinsiek bepaald is. Als het embryo zich echter normaal ontwikkelt, zeggen we dat de resterende blastomeren hun celbestemming kunnen reguleren om de ontbrekende cellen te compenseren. Als een getransplanteerde cel zijn celbestemming op basis van zijn oorspronkelijke positie behoudt, zeggen we dat zijn bestemming is bepaald, als hij een nieuwe bestemming krijgt op basis van zijn nieuwe getransplanteerde positie, zeggen we dat zijn bestemming wordt gereguleerd door externe signalen van cellen in de buurt.
CYTOPLASMISCHE LOCALISATIE EN REGELING IN HET TUNICAATSEEG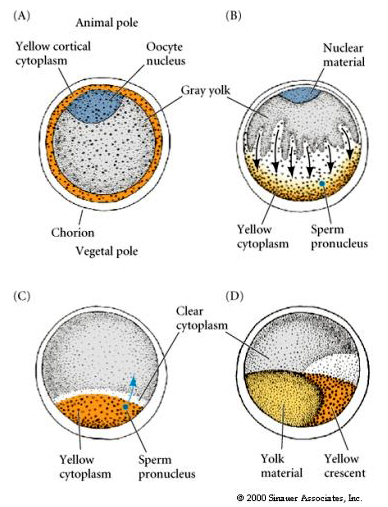
Aan het einde van de oogenese heeft het tunicaatsei een duidelijk onderscheiden dierlijke en plantaardige pool. Er is een geel corticaal cytoplasma dat een grijs yolky binnenste cytoplasma omringt. De kern van de eicel is verplaatst naar de dierlijke pool. Het binnendringen van het sperma in de vegetale hemisfeer bevrucht de eicel en brengt de ontwikkeling op gang. Na de bevruchting vindt een dramatische herschikking van het cytoplasma van de eicel plaats, waardoor regionaal gekleurde cytoplasma’s ontstaan die lijken te correleren met het verdere lot van de blastomeren.
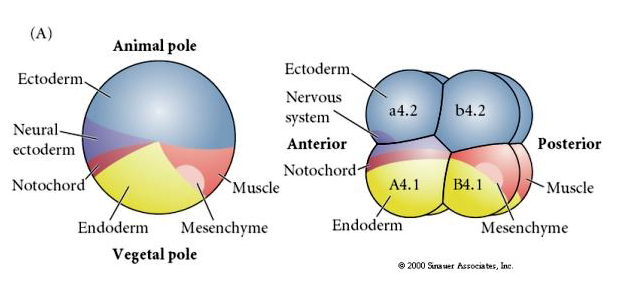 Noteer dat de lotgevallenkaart correleert met de verschillend gekleurde cytoplasma’s van het manteldierembryo. Laat u niet verwarren door de verschillende kleuren in twee figuren. Het “oranje” gele halvemaanvormige cytoplasma is gecorreleerd met het lot van de spieren en het Yolky (gele) cytoplasma is gecorreleerd met het lot van de endodermale organen. Het grijze (witte of blauwpaarse) cytoplasma boven de gele sikkel is gecorreleerd met neuraal ectoderm.
Noteer dat de lotgevallenkaart correleert met de verschillend gekleurde cytoplasma’s van het manteldierembryo. Laat u niet verwarren door de verschillende kleuren in twee figuren. Het “oranje” gele halvemaanvormige cytoplasma is gecorreleerd met het lot van de spieren en het Yolky (gele) cytoplasma is gecorreleerd met het lot van de endodermale organen. Het grijze (witte of blauwpaarse) cytoplasma boven de gele sikkel is gecorreleerd met neuraal ectoderm.
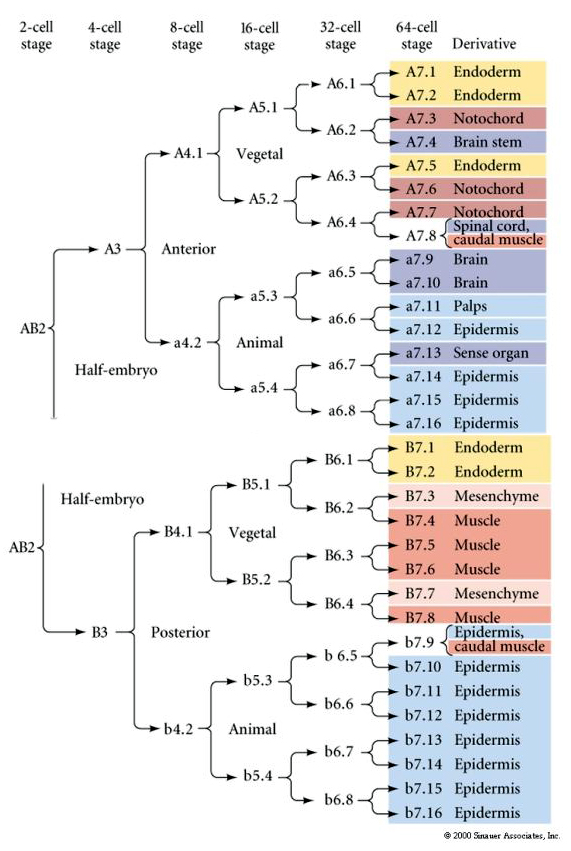 Deze lijnenkaart toont de invariante lijncorrelatie met blastomeren die door de invariante celsplitsingen in bepaalde gekleurde cytoplasma’s zijn geparcelleerd. Echter, invariante splitsingen en lineages niet noodzakelijkerwijs bewijzen autonome celspecificatie door cytoplasmatische determinanten.
Deze lijnenkaart toont de invariante lijncorrelatie met blastomeren die door de invariante celsplitsingen in bepaalde gekleurde cytoplasma’s zijn geparcelleerd. Echter, invariante splitsingen en lineages niet noodzakelijkerwijs bewijzen autonome celspecificatie door cytoplasmatische determinanten.
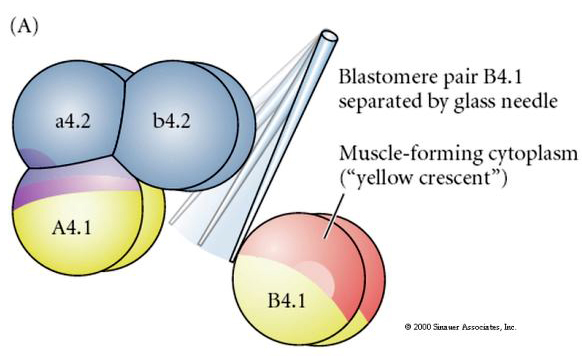 Experimentele manipulaties nodig zijn om regulerende versus cel autonome bepaling van het lot van de cel te testen. De klassieke isolatie-experimenten die in de volgende drie figuren worden getoond, proberen aan te tonen dat het lot van cellen wordt bepaald door cytoplasmatische determinanten die zij verwerven via stereotype splitsingen. Een glazen naald wordt gebruikt om het B4.1 paar blastomeren te scheiden van de rest van het embryo. De B4.1 blastomeren krijgen normaal het gele crecente cytoplasma dat gecorreleerd is met het lot van spiercellen.
Experimentele manipulaties nodig zijn om regulerende versus cel autonome bepaling van het lot van de cel te testen. De klassieke isolatie-experimenten die in de volgende drie figuren worden getoond, proberen aan te tonen dat het lot van cellen wordt bepaald door cytoplasmatische determinanten die zij verwerven via stereotype splitsingen. Een glazen naald wordt gebruikt om het B4.1 paar blastomeren te scheiden van de rest van het embryo. De B4.1 blastomeren krijgen normaal het gele crecente cytoplasma dat gecorreleerd is met het lot van spiercellen.
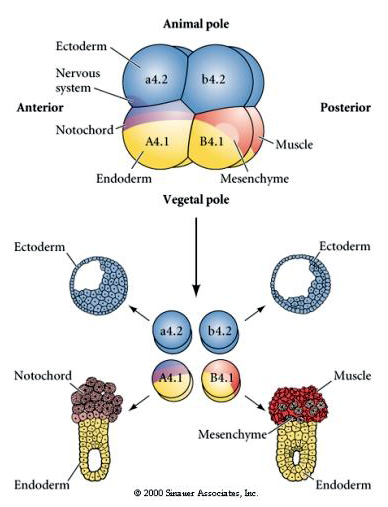
Hier zien we de resultaten van de isolatie-experimenten. De geïsoleerde blastomeren leiden telkens slechts tot die subset van celtypes die ze normaal in het intacte embryo zouden voortbrengen. De geïsoleerde blastomeren regelen hun lot niet om hun ontbrekende buren te compenseren. Dierlijke pool blastomeren, a4.2 en b4.2, geven alleen aanleiding tot ectodermale cellen. A4.1 geeft aanleiding tot notochorda- en endodermale cellen, terwijl B4.1 aanleiding geeft tot spier- en endodermale cellen. Geen van de geïsoleerde blastomeren kan aanleiding geven tot alle cellulaire componenten van een normaal embryo.
Het volgende experiment hieronder gebruikt een naald om het equatoriale splitsingsvlak te manipuleren zodat het meer plantaardig is dan normaal en nu krijgen de dierlijke pool blastomeren, b4.2, wat van het “gele halvemaan” cytoplasma. Wanneer deze blastomeren worden geïsoleerd, ontstaan daaruit enkele spiercellen. Dit toont mooi aan dat het “gele halvemaan”-cytoplasma het lot van spiercellen kan bepalen en dit op een celautonome manier kan doen.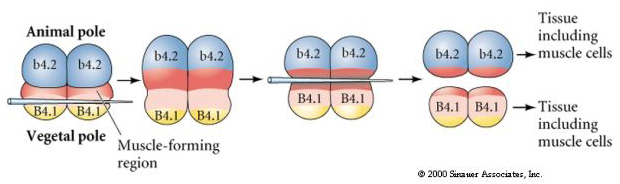
LOCALISATIE EN REGELING IN HET EIGEEL VAN DE ZEEUW
Een geleikanaal bepaalt de plaats van de dierlijke pool en weerspiegelt de vroege polariteit van het ei. Het vroege patroon van splitsingen hangt niet af van de plaats waar het sperma binnendringt, maar wordt bepaald door de intrinsieke polariteit/asymmetrie van de eicel. Boveri (1901) beschreef een subequatoriale band van pigment die orthongonaal ten opzichte van de dierlijke-vegetale as was gerangschikt. Deze korrels gaven ook de plaats aan van cytoplasma dat later wordt opgenomen in de cellen van het archenteron. Horstadius (1928) scheidde dierlijke en plantaardige blastomeren en toonde aan dat alleen de plantaardige blastomeer micromeren zou voortbrengen, gastruleren, en skelet vormen. Zijn conclusie was dat cytoplasmatische factoren die zich in de vegetale helft bevinden, noodzakelijk zijn voor micromeren, gastrulatie en archenteronvorming, en skeletvorming. Houd het patroon van vroege splitsingen in gedachten. De micromeren ontstaan tijdens de vierde splitsing (16-cellig stadium) uit een ongelijke equatoriale deling van de blastomeren van de vegetale pool.
Houd het patroon van vroege splitsingen in gedachten. De micromeren ontstaan tijdens de vierde splitsing (16-cellig stadium) uit een ongelijke equatoriale deling van de blastomeren van de vegetale pool.
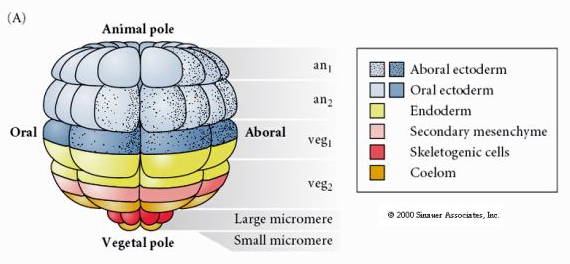 Dit toont de lotgevallenkaart van de blastula van de zee-egel in het 64-cellig stadium. Merk op dat de micromeren de primaire mesenchymcellen zijn en aanleiding geven tot het larvale skelet (de spicules in het pluteusstadium).
Dit toont de lotgevallenkaart van de blastula van de zee-egel in het 64-cellig stadium. Merk op dat de micromeren de primaire mesenchymcellen zijn en aanleiding geven tot het larvale skelet (de spicules in het pluteusstadium).
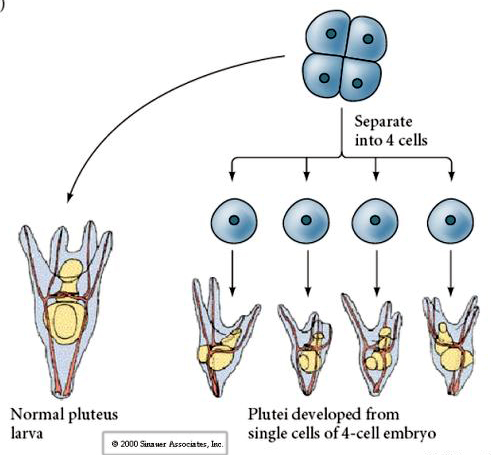 In het viercellig stadium zijn de blastomeren, als ze van elkaar geïsoleerd zijn, in staat hun lot te “regelen” en aanleiding te geven tot vier kleine larven in het pluteusstadium.
In het viercellig stadium zijn de blastomeren, als ze van elkaar geïsoleerd zijn, in staat hun lot te “regelen” en aanleiding te geven tot vier kleine larven in het pluteusstadium.
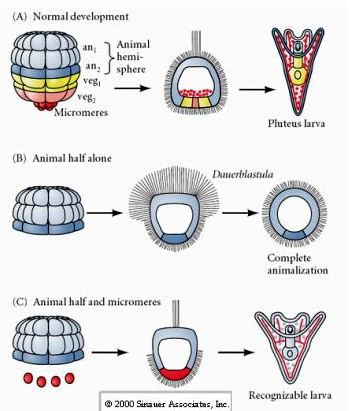 Als men daarentegen in latere stadia dierlijke halve blastomeren isoleert, blijkt dat deze slechts een “dierlijke” dauerblastula produceren die geen mesodermale of endodermale celsoorten tot uitdrukking brengt. Geïsoleerde plantaardige halve blastomeren geven aanleiding tot larven die ectodermale, mesodermale en endodermale celtoesten tot expressie brengen, waaruit blijkt dat het lot van deze cellen kan worden gereguleerd. Geïsoleerde micromeren (primair mesenchym) ondergaan het juiste aantal celdelingen en geven ALTIJD volgens schema aanleiding tot spicules. Micromeren zijn dus definitief gespecificeerd als de voorlopers van de skeletogene mesenchymcellen wanneer zij voor het eerst verschijnen in het 16-cellig stadium. De belangrijkste experimenten waren het samenbrengen van micromeren en dierlijke pool blastomeren en aantonen dat, hoewel het lot van micromeren “gefixeerd of bepaald” was op het moment van hun geboorte, micromeren in staat waren om een nieuw celtype te “induceren” in de dierlijke pool blastomeren. De micromeren waren in staat om endodermale en mesodermale fasen te induceren in de dierlijke blastomeren! Het laatste experiment in “C” toont dus aan dat wanneer je micromeren toevoegt aan een dierlijke halve blastula, je nu de vorming kunt induceren van een herkenbare larve die endodermale, mesodermale en ectodermale fates tot expressie brengt.
Als men daarentegen in latere stadia dierlijke halve blastomeren isoleert, blijkt dat deze slechts een “dierlijke” dauerblastula produceren die geen mesodermale of endodermale celsoorten tot uitdrukking brengt. Geïsoleerde plantaardige halve blastomeren geven aanleiding tot larven die ectodermale, mesodermale en endodermale celtoesten tot expressie brengen, waaruit blijkt dat het lot van deze cellen kan worden gereguleerd. Geïsoleerde micromeren (primair mesenchym) ondergaan het juiste aantal celdelingen en geven ALTIJD volgens schema aanleiding tot spicules. Micromeren zijn dus definitief gespecificeerd als de voorlopers van de skeletogene mesenchymcellen wanneer zij voor het eerst verschijnen in het 16-cellig stadium. De belangrijkste experimenten waren het samenbrengen van micromeren en dierlijke pool blastomeren en aantonen dat, hoewel het lot van micromeren “gefixeerd of bepaald” was op het moment van hun geboorte, micromeren in staat waren om een nieuw celtype te “induceren” in de dierlijke pool blastomeren. De micromeren waren in staat om endodermale en mesodermale fasen te induceren in de dierlijke blastomeren! Het laatste experiment in “C” toont dus aan dat wanneer je micromeren toevoegt aan een dierlijke halve blastula, je nu de vorming kunt induceren van een herkenbare larve die endodermale, mesodermale en ectodermale fates tot expressie brengt.
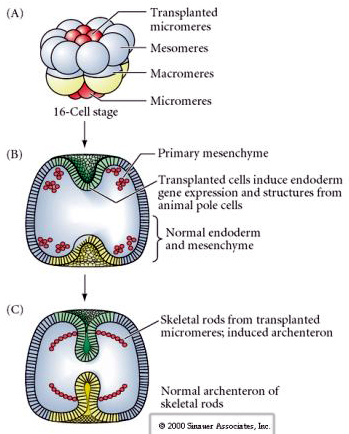 De laatste reeks experimenten toont aan dat zelfs in een normaal embryo, als je micromeren transplanteert naar de dierlijke poolkap, je een secundair archenteron kunt induceren en de normale axiale patroonvorming kunt veranderen. Dit bewijst opnieuw dat de micromeren een cytoplasmatische derminant verwerven die hun celbestemming bepaalt en dat zij het inductieve signaal leveren dat de axiale structuren van het zee-egel embryo bepaalt. Het lot van de micromeren kan niet worden veranderd, maar signalen van de micromeren kunnen het lot van alle andere blastomeren veranderen.
De laatste reeks experimenten toont aan dat zelfs in een normaal embryo, als je micromeren transplanteert naar de dierlijke poolkap, je een secundair archenteron kunt induceren en de normale axiale patroonvorming kunt veranderen. Dit bewijst opnieuw dat de micromeren een cytoplasmatische derminant verwerven die hun celbestemming bepaalt en dat zij het inductieve signaal leveren dat de axiale structuren van het zee-egel embryo bepaalt. Het lot van de micromeren kan niet worden veranderd, maar signalen van de micromeren kunnen het lot van alle andere blastomeren veranderen.
Horstadius: (1928, 1935) toonde experimenteel aan dat in een embryo in het 16-celstadium alle lagen van blastomeren behalve de micromeren een ander lot zullen aannemen wanneer ze in chimere embryo’s op verschillende plaatsen worden getransplanteerd. Het archenteron zal zich ontwikkelen uit veg 1 blastomeren als veg 2 cellen worden verwijderd en de micromeren in contact worden gebracht met de veg 1 laag. Bij afwezigheid van micromeren ontstaan uit de veg 2 blastomeren het archenteron en de skeletstructuren. Klassiek wordt een tweeledige gradiënt tussen dier en plant aangevoerd om deze resultaten te verklaren. Deze resultaten geven echter alleen aan dat er beslissende inductieve interacties optreden tussen aangrenzende blastomeer lagen.
Geplante individuele micromeren in de buurt van de dierlijke pool remmen apicale tuft vorming en in sommige gevallen induceren ze een nieuwe embryonale as. Veg 2 blastomeren zullen ook veranderingen induceren die vergelijkbaar zijn met micromeren wanneer ze naast dierlijke pool blastomeren worden getransplanteerd.
GENERAAL RESULTAAT VAN TRANSPLANTATIES: het lot van bepaalde blastomeren blijkt bij normale embryo’s altijd te worden beïnvloed door de appositie van verschillende aangrenzende cellen.
HYPOTHESE: Gelokaliseerde maternale cytoplasmatische determinanten specificeren bepaalde cellen in het normale embryo, in het bijzonder de micromeren en de voorlopers van het archenteron nabij de vegetale pool. Deze cellen bepalen dan inductief het lot van naburige blastomeren, die op hun beurt interageren met hun buren. Veel van de blastomeren behouden andere potentialiteiten dan die welke zij normaal tot expressie brengen, en gedurende enige tijd zijn deze blastomeren slechts reversibel gespecificeerd, zoals vereist is voor een ontwikkelingssysteem dat in hoge mate afhankelijk is van inductie.