Cleavage si riferisce al modello stereotipato delle prime divisioni mitotiche che divide il grande volume del citoplasma dell’uovo. Lo zigote precoce è unico per essere così grande. La maggior parte delle cellule subisce un periodo di crescita tra i cicli di mitosi, ma questo non è vero per i blastomeri allo stadio iniziale di scissione. Con ogni divisione le cellule diventano più piccole. Questo modello rapido di divisione cellulare senza crescita concomitante si arresta bruscamente allo stadio chiamato transizione di metà blastula dove il nucleo zigotico prende il controllo del ciclo cellulare.
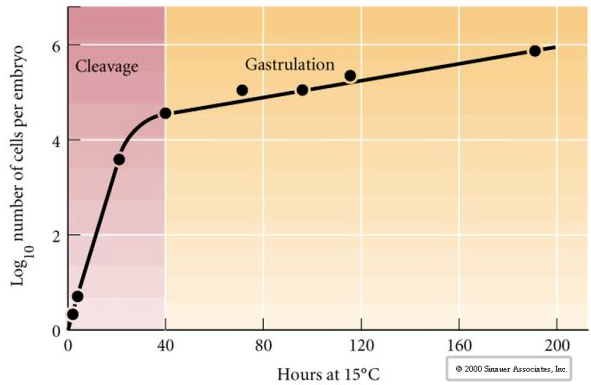 C’è qualche prova che un fattore materno, forse un regolatore trascrizionale, è responsabile di questo modello rapido iniziale di divisioni di clivaggio. Alterando artificialmente il rapporto tra DNA citoplasmatico e nucleare si può cambiare il tempo della transizione midblastula. La transizione midblastula si riferisce al momento in cui avviene il principale passaggio dall’espressione dei geni materni a quelli zigotici.
C’è qualche prova che un fattore materno, forse un regolatore trascrizionale, è responsabile di questo modello rapido iniziale di divisioni di clivaggio. Alterando artificialmente il rapporto tra DNA citoplasmatico e nucleare si può cambiare il tempo della transizione midblastula. La transizione midblastula si riferisce al momento in cui avviene il principale passaggio dall’espressione dei geni materni a quelli zigotici.
La fecondazione in alcune specie porta a radicali movimenti citoplasmatici che sono essenziali per assicurare che i determinanti citoplasmatici siano posizionati correttamente rispetto ai successivi eventi di scissione.
PATTERNS OF EMBRYONIC CLEAVAGE
Il modello del clivaggio embrionale è determinato sia dalla posizione dei fusi mitotici che dalla quantità e distribuzione del tuorlo. Il tuorlo tende a inibire il clivaggio. Lo rallenta o addirittura impedisce la completa scissione. Il tuorlo è un adattamento di quegli animali che attraversano più o meno l’embriogenesi isolati da qualsiasi alimentazione. Alcuni animali, come il riccio di mare, hanno relativamente poco tuorlo perché si sviluppano rapidamente in una forma larvale a nuoto libero che acquisisce nutrienti dal loro ambiente. Altri animali, come i marsupiali, nascono prematuramente, ma ricevono nutrimento in un marsupio parentale. I mammiferi placentari sviluppano un organo specializzato attraverso il quale l’embrione viene nutrito durante tutto lo sviluppo e quindi hanno anche poco tuorlo.
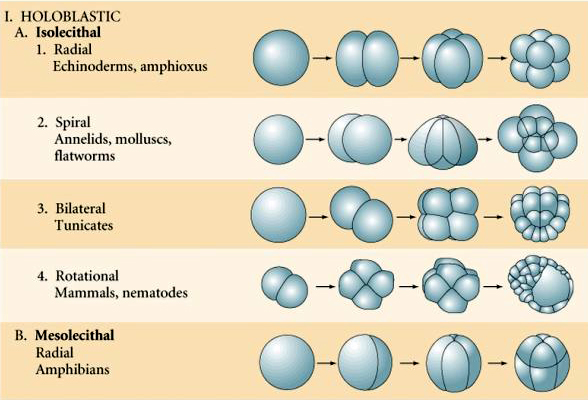
I tipi di uova basati sulle caratteristiche del tuorlo sono descritti come:
Isolecitale: tuorlo rado uniformemente distribuito, es., riccio di mare, topo
Mesolectale: moderata quantità di tuorlo, spesso non uniformemente distribuito, es, rana
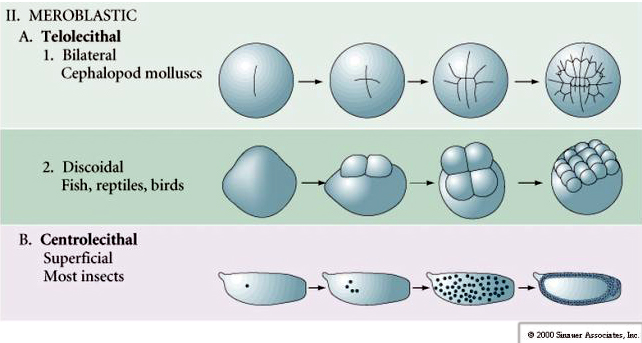
Telolecitale: tuorlo denso concentrato ad una estremità, es. uccello, rettile
Centrolecitale: tuorlo concentrato al centro dell’uovo, es. mosca
Molte uova sono polarizzate con un polo ricco di tuorlo, chiamato polo vegetale e un polo povero di tuorlo chiamato polo animale, es. rana. Il nucleo zigotico è generalmente spostato verso il polo animale. Gli zigoti con relativamente poco tuorlo (isolecitale e mesolecitale) si scindono OLOBLASTICAMENTE. Il solco di clivaggio si estende per tutta la lunghezza dell’uovo. Mentre gli zigoti telolecitici e centrolecitici subiscono una scissione MEROBLASTICA dove il piano di scissione si estende solo al tuorlo accumulato. Nelle uova centrolecitiche (molte uova di insetti) la scissione è meroblastica e superficiale, mentre nelle uova telolecitiche (uccelli e pesci) la scissione è discoidale
Ci sono diversi tipi di simmetria di scissione visti in natura: radiale (echinodermi, anfibi), a spirale (molluschi, anellidi), bilaterale (ascidie, tunicati), rotazionale (mammiferi). Le due figure seguenti mostrano esempi di simmetrie di scissione oloblastica e meroblastica.
CLEVAGGIO OLOBLASTICO RADIALE
Eccellente filmato della scissione del riccio di mare da “A Dozen Eggs” di Rachel Fink.
Anche i ricci di mare hanno un clivaggio radiale oloblastico, ma con alcune interessanti differenze. Il primo clivaggio è meridiano. Il secondo clivaggio è meridiano. La terza scissione è equatoriale La quarta scissione è meridiana, ma mentre le quattro cellule del polo animale si dividono equamente per dare origine a otto blastomeri animali di uguali dimensioni chiamati MESOMERI, le cellule vegetali si dividono asimmetricamente lungo il piano equatoriale per dare 4 grandi MACROMERI e 4 MICROMERI molto più piccoli al polo vegetale. Quinta divisione le MESOMERES si dividono equatorialmente per dare due livelli di otto MESOMERES an1 e an2, le MACROMERES si dividono meridionalmente formando un livello di otto cellule sotto an2, le MICROMERES si dividono per dare un gruppo di cellule sotto lo strato veg1. Le seste divisioni sono tutte equatoriali, dando uno strato veg2. Le settime divisioni sono tutte meridionali e danno una blastula di 128 cellule.
Cosa determina questi modelli di scissione? Dipendono dalla scissione precedente e sono riprodotti come un nastro o sono determinati da qualche orologio intrinseco? Nel 1939 Horstadius inibì una o due delle prime tre scissioni e trovò che la comparsa dei micromeri avveniva al momento giusto indipendentemente dalla storia delle scissioni
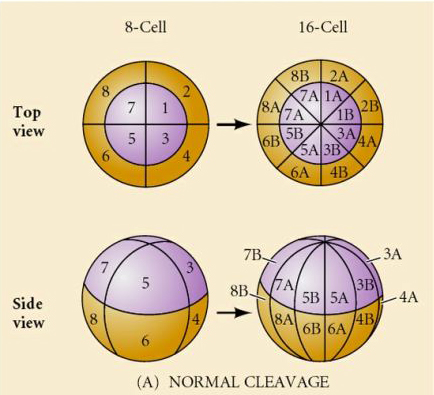
La conclusione di questi esperimenti è che c’è qualche fattore nel polo vegetale dell’uovo che determina la formazione dei micromeri e inoltre che deve esserci un orologio molecolare che inizia all’attivazione dell’uovo. L’orologio è indipendente dall’effettivo evento di scissione.
La blastula di 128 cellule è una palla piuttosto sciolta di cellule che circonda un blastocoel cavo. La palla è spessa uno strato di cellule con tutte le cellule in contatto con lo strato ialino esterno e il fluido interno del blastocoel. In questa fase dello sviluppo le cellule iniziano a formare le giunzioni strette caratteristiche di un epitelio. Il blastocoel centrale è ora isolato dall’ambiente esterno. I blastomeri continuano a dividersi con il loro asse parallelo allo strato ialino, rimanendo un epitelio spesso una cellula. La blastocisti continua ad allargarsi.
Due teorie tentano di spiegare il modello di allargamento della blastocisti
1. La teoria osmotica suggerisce che gli ioni e le proteine sono secreti nella blastocisti dai blastomeri e questo provoca un accumulo di pressione dovuto al flusso osmotico dell’acqua. Questa pressione sarebbe poi responsabile dell’allineamento dell’asse mitotico dei blastomeri e dell’allargamento del blastocoel.
2. La teoria alternativa di Wolpert e dei suoi colleghi suggerisce che sono proprio le interazioni adesive tra i blastomeri e tra i blastomeri e lo strato ialino che allineano gli assi mitotici. Cioè l’adesione allo strato ialino è maggiore, l’adesione ad altri blastomeri è successiva, e infine l’interazione con la parete del blastocoel è minore. L’adesione dominante con lo strato ialino forza l’espansione della blastocisti e del blastocoel.
Le cellule della blastula fanno crescere le ciglia sulla loro superficie esterna, secernono un enzima di schiusa (ialinasi) e diventano a nuoto libero.
CLEVAGGIO DEGLI ANFIBI
Il clivaggio in molti anfibi è oloblastico con simmetria radiale, tuttavia il grande volume del tuorlo (il mesolecito) interferisce con il clivaggio. Al polo animale la prima scissione procede a circa 1mm/min, mentre attraverso il polo vegetale procede 50-100 volte più lentamente (.02mm/min). Mentre il primo clivaggio è ancora incompleto nella regione vegetale dell’uovo, il secondo clivaggio meridiano comincia ad avere luogo.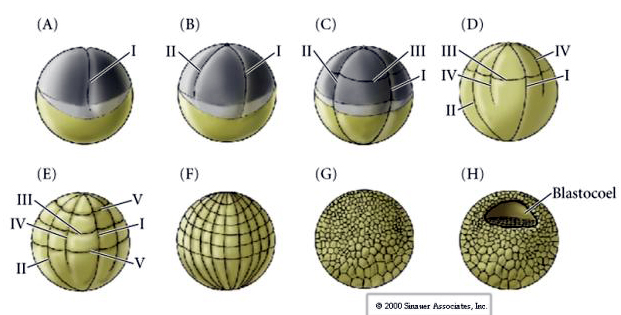
Il terzo clivaggio è equatoriale, ma poiché i nuclei e gli astri sono spostati verso l’animale, il piano di clivaggio, sebbene sia perpendicolare all’asse animale vegetale, è anche spostato verso il polo animale e non divide equamente i blastomeri. Il risultato sono quattro blastomeri animali più piccoli (chiamati MICROMERI) e quattro grandi blastomeri del polo vegetale (chiamati MACROMERI). Questa scissione oloblastica ineguale dà origine a un polo animale che si divide più rapidamente, composto da micromeri più piccoli, e un polo vegetale che si divide più lentamente, composto da macromeri. Il polo animale è presto composto da molti piccoli micromeri e il polo vegetale da alcuni grandi macromeri pieni di tuorlo. Anche se la formazione del blastocel inizia con la prima scissione, non diventa evidente fino allo stadio di 128 cellule.
Quale funzione svolge il blastocel?
Il blastocel separa spazialmente le cellule in modo che non si tocchino tra loro. Le cellule sul tetto del blastocel normalmente diventano ectoderma. Se si trapiantano le cellule del tetto del blastocel accanto alle cellule giallastre alla base del blastocel, queste si differenzieranno come mesoderma. I derivati mesodermici sono normalmente prodotti da cellule adiacenti ai precursori endodermici. Una possibilità che esploreremo a fondo è che le cellule vegetali inducano tramite interazioni cellula-cellula le cellule adiacenti a diventare mesodermiche. Così la formazione del blastocoel può essere necessaria per prevenire interazioni “induttive” inappropriate tra le prime cellule della blastocisti. La seconda ovvia necessità del blastocoel può essere durante la successiva fase di sviluppo, la GASTRULAZIONE, dove le cellule migrano all’interno del blastocoel.
CLEVAGGIO DEI MAMMALI
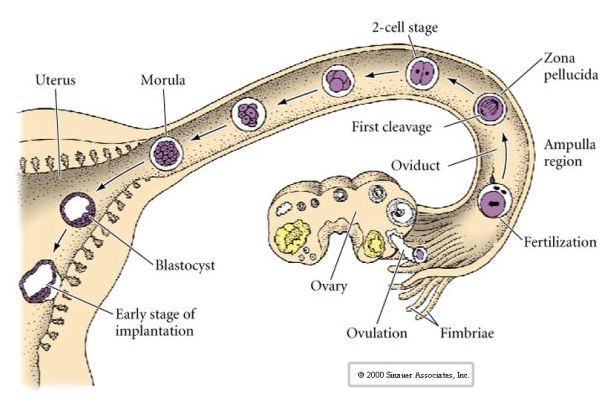
L’uovo dei mammiferi viene rilasciato dall’ovaio nell’ovidotto dove viene fecondato. La prima scissione inizia circa un giorno dopo la fecondazione all’interno dell’ovidotto. In netto contrasto con la maggior parte degli animali, la scissione nei mammiferi può essere molto lenta—1/giorno.
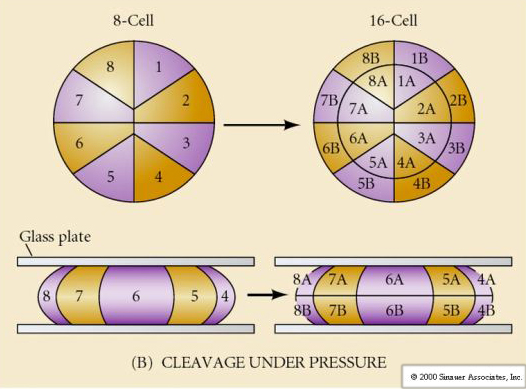
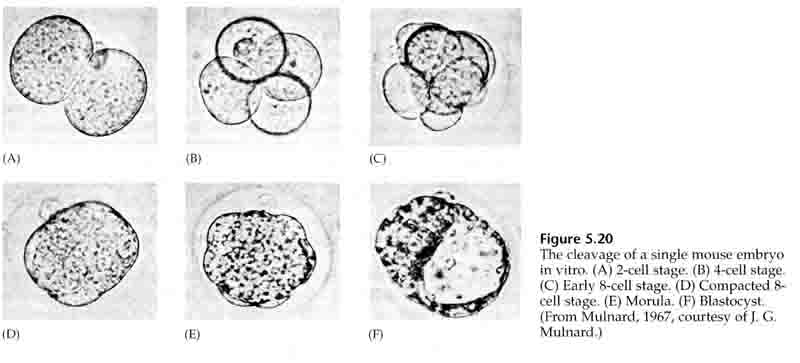
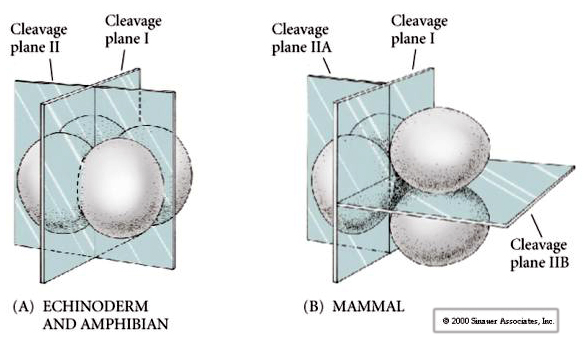 Inoltre, i piani di scissione sono un po’ diversi dagli altri animali. Il primo clivaggio è meridiano proprio come il riccio di mare e la rana. Tuttavia, la seconda divisione di clivaggio vede uno dei blastomeri dividersi meridionalmente e l’altro equatorialmente! Questo tipo di clivaggio è chiamato ROTATIONAL HOLOBLASTIC CLEAVAGE.
Inoltre, i piani di scissione sono un po’ diversi dagli altri animali. Il primo clivaggio è meridiano proprio come il riccio di mare e la rana. Tuttavia, la seconda divisione di clivaggio vede uno dei blastomeri dividersi meridionalmente e l’altro equatorialmente! Questo tipo di clivaggio è chiamato ROTATIONAL HOLOBLASTIC CLEAVAGE.
Un’altra caratteristica unica del clivaggio dei mammiferi è che i clivaggi dei blastomeri sono asincroni. (rispetto alla sincronia del riccio di mare e della rana fino alla transizione della metà della blastula). Il clivaggio dell’embrione di mammifero è regolato dal nucleo zyotico fin dall’inizio.
Per quanto riguarda il terzo clivaggio, i blastomeri formano una palla di cellule liberamente associate, proprio come gli altri animali che abbiamo studiato. Prima della quarta scissione, le cellule della blastula cambiano drammaticamente il loro comportamento le une verso le altre. Cercano rapidamente di massimizzare i loro contatti con gli altri blastomeri e così facendo causano la compattazione della blastula.

Questa COMPATTEZZA deriva in parte dalla produzione di una nuova molecola di adesione UVOMORULIN (E-Cadherin) ed è stabilizzata dalla formazione di giunzioni strette tra le cellule esterne che, come nel riccio di mare, sigillano l’interno della blastula dall’esterno. Le cellule formano anche delle gap junctions tra di loro che permettono il passaggio di piccole molecole, come gli ioni e alcune molecole secondo messaggero come Ca++ e C-AMP. La morula compattata a 16 cellule consiste in una crosta esterna di cellule e poche cellule (1-2) completamente interne. La maggior parte delle cellule esterne danno origine alle CELLULE TROBLASTICHE O TROFECTODERMALI. Queste cellule non contribuiscono all’embrione vero e proprio, ma sono invece necessarie per l’impianto dell’embrione nella parete uterina e formano i tessuti della CORIANA, un componente essenziale della placenta di cui parleremo più avanti.
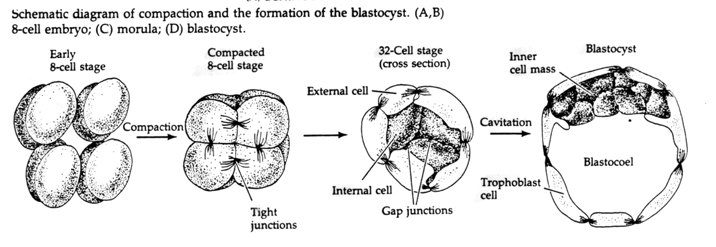
Le cellule dell’embrione derivano dalle poche cellule interne della blastula allo stadio di 16 cellule. Queste cellule generano la massa cellulare interna da cui si sviluppa l’intero embrione. Al sesto clivaggio, lo stadio di 64 cellule, la massa cellulare interna e lo strato trofoblastico sono completamente separati. I trofoblasti secernono fluido internamente per creare il blastocoel. L’embrione è ora chiamato blastocisti.
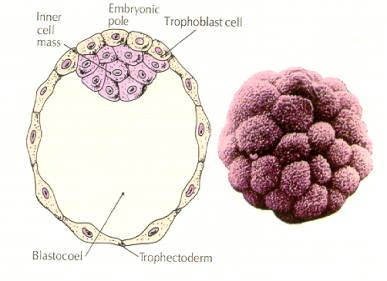 Formazione della massa cellulare interna
Formazione della massa cellulare interna
Come vengono create queste cellule della massa cellulare interna? Ci sono alcuni blastomeri destinati da fattori intrinseci a diventare progenitori della massa cellulare interna? La risposta sembra essere no. Tutti i primi blastomeri sembrano essere totipotenti e la determinazione di quali cellule contribuiranno allo strato trofoblastico e quali alla massa cellulare interna è semplicemente una questione di posizione casuale. Le cellule di un embrione a 4 cellule, che normalmente daranno origine sia alla massa cellulare interna che alle cellule del trofectoderma, trapiantate all’esterno di un embrione a 32 cellule danno origine solo al trofectoderma. Non contribuiscono all’embrione vero e proprio. Ricordate dalla lezione precedente sulla clonazione che la fusione di due embrioni di topo allo stadio di 8 cellule dà come risultato un embrione normale, suggerendo che tutte le cellule a quello stadio sono totipotenti.
CLEVAGGIO MEROBLASTICO
Nelle uova telolecitali e centrolecitali il tuorlo denso e grande impedisce il clivaggio. Le uova telolecitiche sono caratteristiche di uccelli, pesci e rettili, mentre le uova centrolecitiche sono caratteristiche degli insetti. Le uova telolecitiche risultano in una scissione discoidale meroblastica. La scissione è limitata al blastodisco al polo animale dell’uovo. Alle prime scissioni, poiché la scissione non può procedere attraverso il tuorlo, i blastomeri sono continui ai loro margini vegetali.
Questo filmato dello sviluppo del pesce zebra di Rolf Karlstrom è eccellente. (Film di Paul Myers)
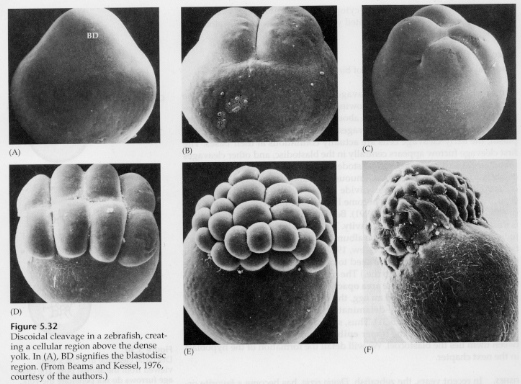 Non è fino alle scissioni equatoriali che le cellule del blastoderma si separano dal tuorlo. Ulteriori scissioni equatoriali creano un blastoderma multistrato spesso tre o quattro cellule.
Non è fino alle scissioni equatoriali che le cellule del blastoderma si separano dal tuorlo. Ulteriori scissioni equatoriali creano un blastoderma multistrato spesso tre o quattro cellule.
Negli uccelli si forma uno spazio tra il blastoderma e il tuorlo chiamato cavità SUBGERMINALE. Con la 16° divisione (60.000 cellule) le cellule del blastoderma migrano nella cavità subgerminale per formare un secondo strato. I due strati sono chiamati EPIBLAST esterno e HYPOBLAST interno con il blastocoel in mezzo. Lo studieremo più dettagliatamente in seguito, quando parleremo della gastrulazione degli uccelli e dei mammiferi
Le uova centrolecitali degli artropodi subiscono un CLEAVAGE SUPERFICIALE. La grande massa centrale di tuorlo confina le scissioni al bordo citoplasmatico dell’uovo.
Una variazione interessante e informativa si vede negli insetti. I nuclei zigotici si dividono senza scissione. Cioè i nuclei subiscono la karyokinesis—-mitotic division of the nucleus— senza cytokinesis—la divisione della cellula. Questi nuclei nudi sono chiamati ENERGIDI. I nuclei si dividono ad un ritmo incredibile—ogni 8 minuti (tutta l’embriogenesi dura solo 22 ore).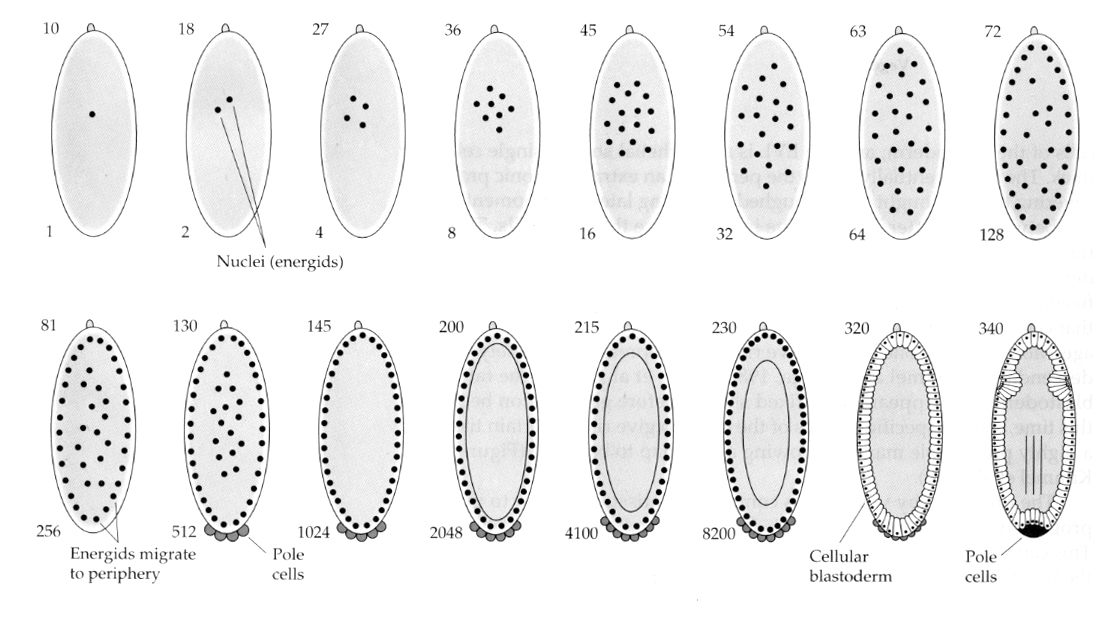
 Dopo diversi cicli di cariocinesi i nuclei nudi migrano alla periferia dell’uovo. A questo stadio è chiamato BLASTODERMA SINTETICO perché tutti i nuclei condividono lo stesso citoplasma. La cellularizzazione avviene a circa la 14a divisione nucleare per creare il BLASTODERM CELLULARE. Dopo questo momento le cellule si dividono in modo asincrono. Questo corrisponde alla transizione midblastula delle rane e dei ricci di mare. (transizione dall’espressione genica materna a quella principalmente zigotica) Ricordate che la transizione midblastula è stata pensata per essere innescata dal rapporto tra cromatina e citoplasma. La prova di questo meccanismo nelle mosche si vede esaminando gli embrioni aploidi mutanti. Questi embrioni subiscono la transizione midblastula e la cellularizzazione una divisione più tardi 15th. Inoltre è possibile accelerare la cellularizzazione legando l’uovo e riducendo il volume del citoplasma. Anche se lo stadio di blastoderma sinciziale suggerisce che tutti i nuclei sono equipotenti in quanto non sembrano esserci barriere diffusionali ai determinanti citoplasmatici, in realtà il citoplasma è molto regionalizzato e i nuclei hanno domini citoplasmatici altamente organizzati intorno a loro.
Dopo diversi cicli di cariocinesi i nuclei nudi migrano alla periferia dell’uovo. A questo stadio è chiamato BLASTODERMA SINTETICO perché tutti i nuclei condividono lo stesso citoplasma. La cellularizzazione avviene a circa la 14a divisione nucleare per creare il BLASTODERM CELLULARE. Dopo questo momento le cellule si dividono in modo asincrono. Questo corrisponde alla transizione midblastula delle rane e dei ricci di mare. (transizione dall’espressione genica materna a quella principalmente zigotica) Ricordate che la transizione midblastula è stata pensata per essere innescata dal rapporto tra cromatina e citoplasma. La prova di questo meccanismo nelle mosche si vede esaminando gli embrioni aploidi mutanti. Questi embrioni subiscono la transizione midblastula e la cellularizzazione una divisione più tardi 15th. Inoltre è possibile accelerare la cellularizzazione legando l’uovo e riducendo il volume del citoplasma. Anche se lo stadio di blastoderma sinciziale suggerisce che tutti i nuclei sono equipotenti in quanto non sembrano esserci barriere diffusionali ai determinanti citoplasmatici, in realtà il citoplasma è molto regionalizzato e i nuclei hanno domini citoplasmatici altamente organizzati intorno a loro.
MECCANISMI DI CLEAVAGE
Ciclo cellulare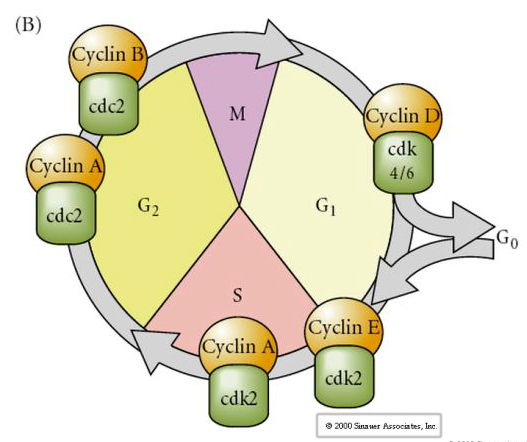
M-mitosi
G1- gap pre-replicazione
S- sintesi del DNA
G2- gap premitotico
Negli embrioni allo stadio di cleavage come rane e mosche i blastomeri passano direttamente da M a S senza intervenire nelle fasi G1 o G2. Dopo la transizione midblastula le cellule di entrambi gli animali hanno uno stadio G1 e G2. Esperimenti di trapianto eleganti hanno dimostrato che è il citoplasma che regola sia la cariocinesi che la citochinesi. Se nuclei di cellule in divisione vengono trapiantati nell’ovocita, smettono immediatamente di dividersi.
 Al contrario, se nuclei di cellule non in divisione vengono messi in uova enucleate fecondate, iniziano a dividersi. Uova enucleate artificialmente senza centrioli subiranno contrazioni corticali che ricordano la scissione. Alcuni dei fattori citoplasmatici che regolano la divisione cellulare nell’embrione precoce sono stati identificati.
Al contrario, se nuclei di cellule non in divisione vengono messi in uova enucleate fecondate, iniziano a dividersi. Uova enucleate artificialmente senza centrioli subiranno contrazioni corticali che ricordano la scissione. Alcuni dei fattori citoplasmatici che regolano la divisione cellulare nell’embrione precoce sono stati identificati.
Il FATTORE CITOSTATICO (CSF) è elevato dopo la prima divisione meiotica e arresta l’ovocita nella seconda metafase meiotica. Alla fecondazione il Ca inattiva il CSF, la meiosi è completata e i pronuclei si fondono.
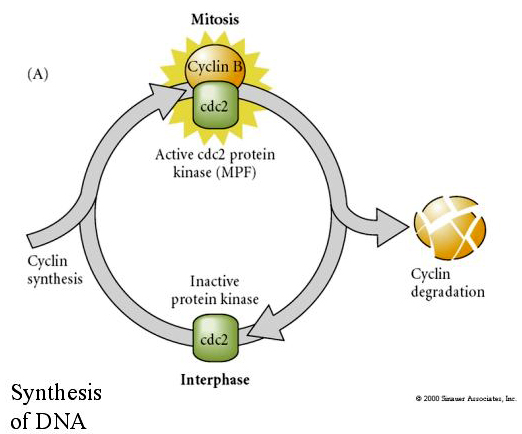
MITOSIS PROMOTING FACTOR (MPF) fa entrare le cellule nella fase M. L’attivazione del MPF causa: 1. condensazione dei cromosomi tramite fosforilazione dell’istone H1, 2. rottura dell’involucro nucleare tramite iperfosforilazione di 3 lamine nucleari, 3. inibizione della RNA polimerasi per arrestare la trascrizione, 4. fosforilazione della subunità regolatrice della miosina per inibire la citochinesi.
Modello suggerito per la regolazione ciclica del ciclo cellulare durante le fasi di scissione dell’embrogenesi. MPF induce la cellula a procedere da S a M. CSF si lega a MPF e impedisce la sua inattivazione. La cellula rimane in M. Il Ca aumenta e causa l’inattivazione del CSF che a sua volta porta all’inattivazione di MPF e la cellula procede da M a S e il ciclo si ripete. MPF è composto da due subunità, la ciclina B e cdc2. È la ciclina B che subisce una sintesi e una degradazione specifica del ciclo cellulare regolata dal nucleo delle cellule per controllare il ciclo cellulare nelle normali cellule somatiche. Tuttavia, durante l’oogenesi l’uovo è carico di “regolatori” della ciclina B e dell’mRNA della ciclina B in modo che la sua sintesi sia regolata da fattori materni indipendenti dal nucleo zigotico. Quindi non è fino a quando i componenti materni “si esauriscono” che il nucleo zigotico prende il sopravvento e ritorna un normale ciclo cellulare (M, G1, S, G2).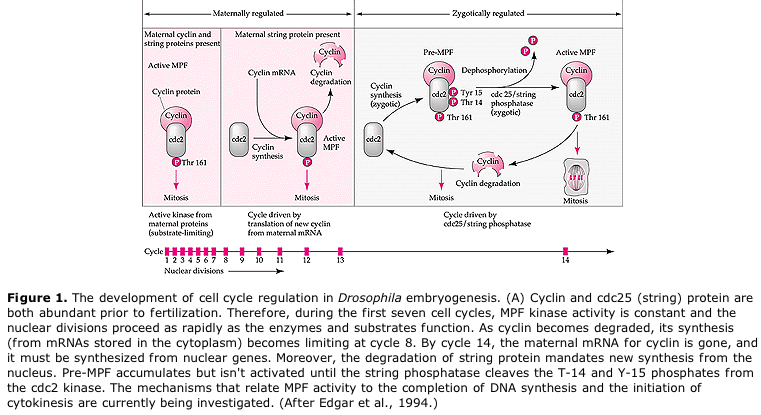
DETERMINAZIONE DEL FATO CELLULARE
Localizzazione citoplasmatica dei DETERMINANTI come meccanismo generale e basilare per il patterning precoce (Esempi Tunicato e Riccio di mare). Una delle principali domande della biologia dello sviluppo è quando e come i destini cellulari sono determinati durante lo sviluppo. Questo è intimamente legato alla questione di come avviene la formazione del modello durante lo sviluppo. L’embrione non solo deve generare il giusto numero e tipo di cellule differenziate, ma queste devono essere organizzate nel modo corretto rispetto a tutte le altre cellule dell’embrione per formare un animale funzionale. Esamineremo due possibilità di determinazione del destino cellulare e di formazione del modello: 1. 1. Il destino cellulare potrebbe essere determinato da fattori intrinseci inseriti nell’uovo durante l’oogenesi e poi distribuiti a blastomeri specifici durante la scissione, 2. Segnali estrinseci forniti dall’ambiente dell’embrione potrebbero fornire le informazioni di patterning per regolare il destino cellulare. Come vedremo, la maggior parte degli organismi complessi usa una combinazione di segnali intrinseci ed estrinseci per regolare il destino cellulare e la formazione del modello embrionale.
La specificazione autonoma del destino cellulare tramite determinanti citoplasmatici suggerisce che il destino di una cellula dipende interamente dal suo lignaggio, mentre lo sviluppo “regolativo” suggerisce che il destino di una cellula è determinato da segnali esterni di altre cellule. Questi due meccanismi di specificazione cellulare possono essere distinti sperimentalmente tramite esperimenti di isolamento, ablazione e trapianto. Se un blastmore isolato da un embrione si differenzia normalmente (come se fosse ancora nella sua posizione normale nell’embrione) possiamo dire che deve avere determinanti intrinseci che specificano il suo destino. Tuttavia, se si differenzia in modo anormale, possiamo dire che il suo destino cellulare dipende da segnali esterni. Se abliamo un blastomero da un embrione e l’embrione si sviluppa in modo anormale, mancando tutti i destini cellulari che normalmente nascono dal blastomero ablato, diciamo che lo sviluppo è autonomo e intrinsecamente specificato. Tuttavia, se l’embrione si sviluppa normalmente, diciamo che i blastomeri rimanenti possono regolare il loro destino cellulare per compensare le cellule mancanti. Se una cellula trapiantata mantiene il suo destino cellulare basato sulla sua posizione originale, allora diciamo che il suo destino è stato determinato, se assume un nuovo destino basato sulla sua nuova posizione trapiantata, diciamo che il suo destino è regolato da segnali esterni provenienti da cellule vicine.
Localizzazione e regolazione citoplasmatica nell’uovo tunicato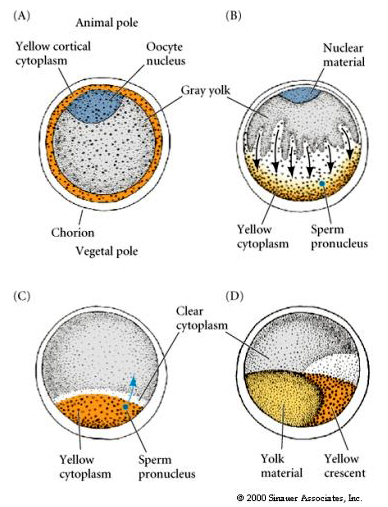
Al termine dell’oogenesi l’uovo tunicato ha un polo animale e vegetale chiaramente distinti. C’è un citoplasma corticale giallo che circonda un citoplasma interno grigio e giallastro. Il nucleo dell’ovocita è spostato verso il polo animale. L’ingresso dello sperma nell’emisfero vegetale feconda l’uovo e inizia lo sviluppo. Un riarrangiamento drammatico del citoplasma dell’uovo si verifica dopo la fecondazione dando origine a citoplasmi colorati a livello regionale che sembrano correlare con i successivi destini dei blastomeri.
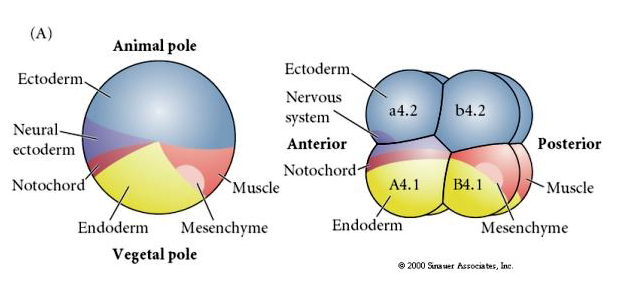 Nota che la mappa del destino si correla con i diversi citoplasmi colorati dell’embrione tunicato. Non essere confuso dai diversi colori in due figure. Il citoplasma giallo “arancione” a mezzaluna è correlato ai destini muscolari e il citoplasma Yolky (giallo) è correlato ai destini endodermici. Il citoplasma grigio (bianco o viola bluastro) sopra la mezzaluna gialla è correlato all’ectoderma neurale.
Nota che la mappa del destino si correla con i diversi citoplasmi colorati dell’embrione tunicato. Non essere confuso dai diversi colori in due figure. Il citoplasma giallo “arancione” a mezzaluna è correlato ai destini muscolari e il citoplasma Yolky (giallo) è correlato ai destini endodermici. Il citoplasma grigio (bianco o viola bluastro) sopra la mezzaluna gialla è correlato all’ectoderma neurale.
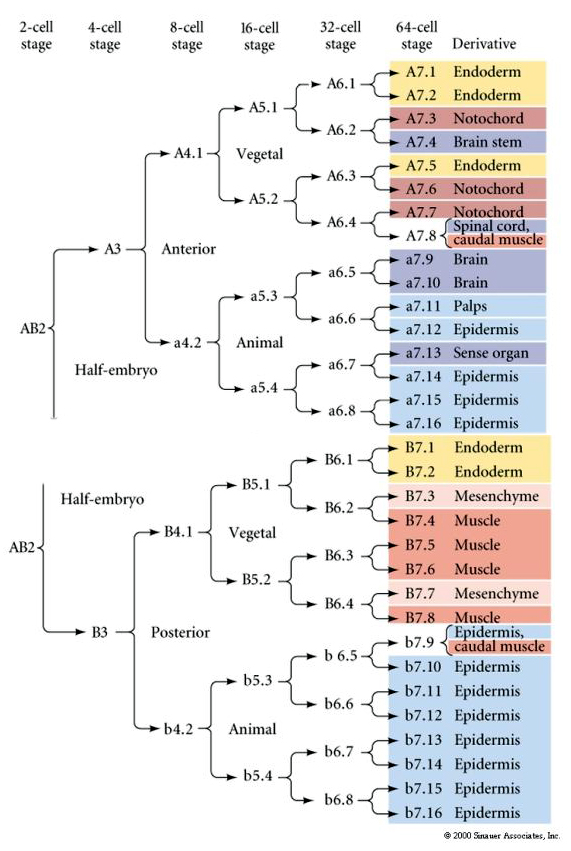 Questa mappa di lignaggio mostra la correlazione del lignaggio invariante con i blastomeri suddivisi in particolari citoplasmi colorati dalle scissioni cellulari invarianti. Tuttavia, le scissioni invarianti e i lignaggi non provano necessariamente una specificazione cellulare autonoma da parte di determinanti citoplasmatici.
Questa mappa di lignaggio mostra la correlazione del lignaggio invariante con i blastomeri suddivisi in particolari citoplasmi colorati dalle scissioni cellulari invarianti. Tuttavia, le scissioni invarianti e i lignaggi non provano necessariamente una specificazione cellulare autonoma da parte di determinanti citoplasmatici.
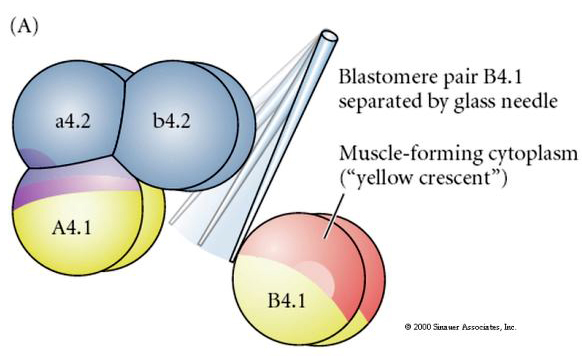 Sono necessarie manipolazioni sperimentali per testare la determinazione regolativa rispetto a quella autonoma del destino cellulare. I classici esperimenti di isolamento mostrati nelle prossime tre figure tentano di dimostrare che il destino cellulare è determinato da determinanti citoplasmatici che acquisiscono attraverso scissioni stereotipiche. Un ago di vetro è usato per separare la coppia di blastomeri B4.1 dal resto dell’embrione. I blastomeri B4.1 acquisiscono normalmente il citoplasma giallo crecente correlato al destino delle cellule muscolari.
Sono necessarie manipolazioni sperimentali per testare la determinazione regolativa rispetto a quella autonoma del destino cellulare. I classici esperimenti di isolamento mostrati nelle prossime tre figure tentano di dimostrare che il destino cellulare è determinato da determinanti citoplasmatici che acquisiscono attraverso scissioni stereotipiche. Un ago di vetro è usato per separare la coppia di blastomeri B4.1 dal resto dell’embrione. I blastomeri B4.1 acquisiscono normalmente il citoplasma giallo crecente correlato al destino delle cellule muscolari.
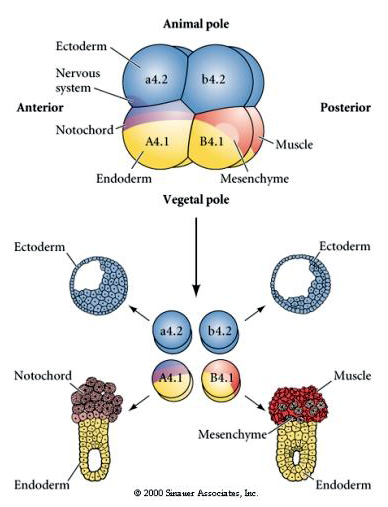
Qui possiamo vedere i risultati degli esperimenti di isolamento. In ogni caso i blastomeri isolati danno origine solo a quel sottoinsieme di destini cellulari che produrrebbero normalmente nell’embrione intatto. I blastomeri isolati non regolano il loro destino per compensare i loro vicini mancanti. I blastomeri del polo animale, a4.2 e b4.2, danno origine solo a cellule ectodermiche. A4.1 dà origine a cellule notocordali ed endodermiche, mentre B4.1 dà origine a cellule muscolari ed endodermiche. Nessuno dei blastomeri isolati può dare origine a tutti i componenti cellulari di un embrione normale.
L’esperimento successivo qui sotto usa un ago per manipolare il piano di clivaggio equatoriale in modo che sia più vegetale del normale e ora i blastomeri del polo animale, b4.2, acquisiscono parte del citoplasma “mezzaluna gialla”. Quando questi blastomeri sono isolati, ora danno origine ad alcune cellule muscolari. Questo dimostra che il citoplasma “mezzaluna gialla” può determinare il destino delle cellule muscolari e può farlo in modo autonomo. 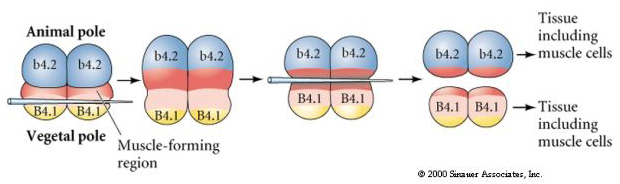
LOCALIZZAZIONE E REGOLAZIONE NELL’UOVO DI URCHINA MARINA
Un canale di gelatina definisce la posizione del polo animale e riflette la prima polarità dell’uovo. Il modello precoce delle scissioni non dipende dal sito di ingresso dello sperma, ma sono determinate dalla polarità/asimmetria intrinseca dell’uovo. Boveri (1901) ha descritto una banda subequatoriale di pigmento disposta ortogonalmente all’asse animale-vegetale. Questi granuli indicavano anche la posizione del citoplasma che è poi incluso nelle cellule dell’archenteron. Horstadius (1928) separò i blastomeri animali e vegetali e dimostrò che solo il blastomero vegetale avrebbe dato origine a micromeri, gastrulato e formato lo scheletro. La sua conclusione fu che i fattori citoplasmatici situati nella metà vegetale sono necessari per i micromeri, la gastrulazione e la formazione dell’archenteron e dello scheletro. Ricorda il modello dei primi clivaggi. I micromeri nascono durante il quarto clivaggio (stadio di 16 cellule) da una divisione equatoriale ineguale dei blastomeri del polo vegetale.
Ricorda il modello dei primi clivaggi. I micromeri nascono durante il quarto clivaggio (stadio di 16 cellule) da una divisione equatoriale ineguale dei blastomeri del polo vegetale.
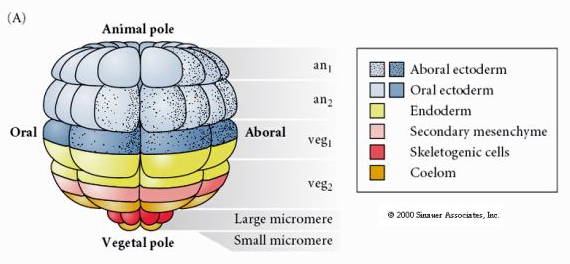 Questo mostra la mappa del destino della blastula del riccio di mare allo stadio di 64 cellule. Notate che i micromeri sono le cellule primarie del mesenchima e danno origine allo scheletro larvale (le spicole dello stadio pluteo).
Questo mostra la mappa del destino della blastula del riccio di mare allo stadio di 64 cellule. Notate che i micromeri sono le cellule primarie del mesenchima e danno origine allo scheletro larvale (le spicole dello stadio pluteo).
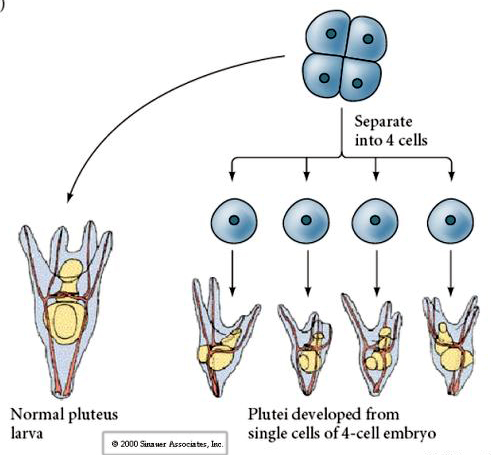 Allo stadio di quattro cellule, se i blastomeri sono isolati tra loro sono in grado di “regolare” il loro destino e dare origine a 4 piccole larve dello stadio pluteo.
Allo stadio di quattro cellule, se i blastomeri sono isolati tra loro sono in grado di “regolare” il loro destino e dare origine a 4 piccole larve dello stadio pluteo.
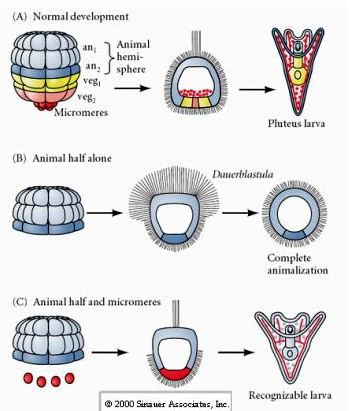 Al contrario, negli stadi successivi, se si isolano i mezzi blastomeri animali si scopre che producono solo una dauerblastula “animalizzata” che non esprime alcun destino cellulare mesodermico o endodermico. I mezzi blastomeri vegetali isolati danno origine a larve che esprimono destini cellulari ectodermici, mesodermici ed endodermici, dimostrando che il destino di queste cellule può essere regolato. I micromeri isolati (mesenchima primario) subiscono il numero corretto di divisioni cellulari e danno SEMPRE origine alle spicole secondo il programma. Così, i micromeri sono definitivamente specificati come i precursori delle cellule del mesenchima scheletrico quando appaiono per la prima volta allo stadio di 16 cellule. Gli esperimenti chiave sono stati mettere insieme i micromeri con i blastomeri del polo animale e mostrare che, sebbene il destino dei micromeri fosse “fisso o determinato” al momento della loro nascita, i micromeri erano in grado di “indurre” nuovi destini cellulari nei blastomeri del polo animale. I micromeri erano in grado di indurre destini endodermici e mesodermici nei blastomeri del polo animale! Così, l’ultimo esperimento in “C” dimostra che quando i micromeri vengono aggiunti a una mezza blastula animale si può ora indurre la formazione di una larva riconoscibile che esprime destini endodermici, mesodermici ed ectodermici.
Al contrario, negli stadi successivi, se si isolano i mezzi blastomeri animali si scopre che producono solo una dauerblastula “animalizzata” che non esprime alcun destino cellulare mesodermico o endodermico. I mezzi blastomeri vegetali isolati danno origine a larve che esprimono destini cellulari ectodermici, mesodermici ed endodermici, dimostrando che il destino di queste cellule può essere regolato. I micromeri isolati (mesenchima primario) subiscono il numero corretto di divisioni cellulari e danno SEMPRE origine alle spicole secondo il programma. Così, i micromeri sono definitivamente specificati come i precursori delle cellule del mesenchima scheletrico quando appaiono per la prima volta allo stadio di 16 cellule. Gli esperimenti chiave sono stati mettere insieme i micromeri con i blastomeri del polo animale e mostrare che, sebbene il destino dei micromeri fosse “fisso o determinato” al momento della loro nascita, i micromeri erano in grado di “indurre” nuovi destini cellulari nei blastomeri del polo animale. I micromeri erano in grado di indurre destini endodermici e mesodermici nei blastomeri del polo animale! Così, l’ultimo esperimento in “C” dimostra che quando i micromeri vengono aggiunti a una mezza blastula animale si può ora indurre la formazione di una larva riconoscibile che esprime destini endodermici, mesodermici ed ectodermici.
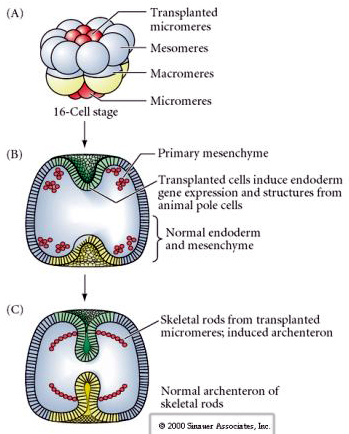 L’ultima serie di esperimenti dimostra che anche in un embrione normale, se si trapiantano micromeri nella calotta del polo animale si può indurre un arcenteron secondario e alterare il normale pattern assiale. Questo sostiene ancora una volta che i micromeri acquisiscono un derminante citoplasmatico che specifica il loro destino cellulare e che forniscono il segnale induttivo che modella le strutture assiali dell’embrione di ucina di mare. Il destino dei micromeri non può essere alterato, ma i segnali provenienti dai micromeri possono alterare il destino di tutti gli altri blastomeri.
L’ultima serie di esperimenti dimostra che anche in un embrione normale, se si trapiantano micromeri nella calotta del polo animale si può indurre un arcenteron secondario e alterare il normale pattern assiale. Questo sostiene ancora una volta che i micromeri acquisiscono un derminante citoplasmatico che specifica il loro destino cellulare e che forniscono il segnale induttivo che modella le strutture assiali dell’embrione di ucina di mare. Il destino dei micromeri non può essere alterato, ma i segnali provenienti dai micromeri possono alterare il destino di tutti gli altri blastomeri.
Horstadius: (1928, 1935) ha dimostrato sperimentalmente che in un embrione allo stadio di 16 cellule tutti i livelli di blastomeri tranne i micromeri assumeranno destini diversi quando trapiantati in posizioni diverse negli embrioni chimerici. L’archenteron si svilupperà dai blastomeri veg 1 se le cellule veg 2 vengono rimosse e i micromeri vengono messi in contatto con lo strato veg 1. In assenza di micromeri, i blastomeri veg 2 danno origine all’archenteron e alle strutture scheletriche. Classicamente, un gradiente animale-vegetale è stato invocato per spiegare questi risultati. Tuttavia questi risultati indicano solo che le interazioni induttive decisive si verificano tra livelli di blastomeri adiacenti.
I micromeri individuali impiantati vicino al polo animale inibiscono la formazione del ciuffo apicale e in alcuni casi inducono un nuovo asse embrionale. Anche i blastomeri Veg 2 inducono cambiamenti simili ai micromeri quando vengono trapiantati vicino ai blastomeri del polo animale.
Risultato GENERALE DEI TRAPIANTI: il destino di determinati blastomeri risulta sempre influenzato dall’apposizione di diverse cellule vicine che li affiancano negli embrioni normali.
HYPOTHESIS: I determinanti citoplasmatici materni localizzati specificano alcune cellule nell’embrione normale, in particolare i micromeri e i precursori dell’archenteron vicino al polo vegetale. Queste cellule determinano poi induttivamente i destini dei blastomeri vicini, che interagiscono a loro volta con i loro vicini. Molti dei blastomeri conservano potenzialità diverse da quelle che esprimono normalmente, e per un certo tempo questi blastomeri sono specificati solo in modo reversibile, come richiesto per un sistema di sviluppo che dipende in larga misura dall’induzione.