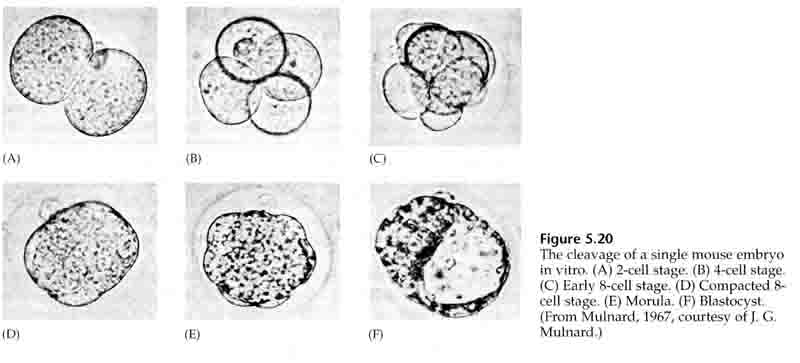
Klyvning hänvisar till det stereotypa mönstret av tidiga mitotiska delningar som delar upp den stora volymen äggcytoplasma. Den tidiga zygoten är unik genom att vara så stor. De flesta celler genomgår en period av tillväxt mellan mitoscyklerna, men detta gäller inte för blastomerer i det tidiga klyvningsstadiet. Med varje delning blir cellerna mindre. Detta snabba mönster av celldelning utan samtidig tillväxt avstannar abrupt i det skede som kallas för mitten av blastomeren, där den zygotiska kärnan tar kontroll över cellcykeln.
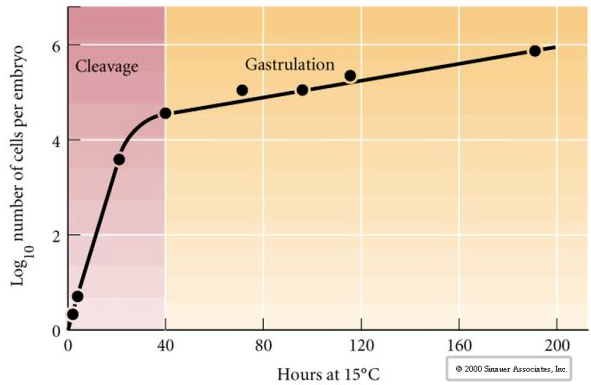 Det finns vissa belägg för att en maternell faktor, kanske en transkriptionsregulator, är ansvarig för detta tidiga snabba mönster av klyvningsdelningar. Genom att på konstgjord väg ändra förhållandet mellan cytoplasmatiskt och nukleärt DNA kan man ändra tidpunkten för midblastulaövergången. Midblastulaövergången avser den tidpunkt då den stora övergången från uttryck av moderliga till zygotiska gener äger rum.
Det finns vissa belägg för att en maternell faktor, kanske en transkriptionsregulator, är ansvarig för detta tidiga snabba mönster av klyvningsdelningar. Genom att på konstgjord väg ändra förhållandet mellan cytoplasmatiskt och nukleärt DNA kan man ändra tidpunkten för midblastulaövergången. Midblastulaövergången avser den tidpunkt då den stora övergången från uttryck av moderliga till zygotiska gener äger rum.
Fertilisering hos vissa arter leder till radikala cytoplasmatiska rörelser som är viktiga för att se till att de cytoplasmatiska bestämningsfaktorerna befinner sig i rätt positioner i förhållande till efterföljande klyvningshändelser.
PATTERNS AV EMBRYONISK KÄLLNING
Mönstret för embryonal klyvning bestäms både av mitotiska spindlarnas position och av mängden och fördelningen av äggula. Yolk tenderar att hämma klyvningen. Den saktar ner den eller förhindrar faktiskt fullständig klyvning. Yolk är en anpassning av de djur som genomgår en större eller mindre del av embryogenesen isolerat från all föda. Vissa djur, som t.ex. sjöborrar, har relativt lite gula eftersom de snabbt utvecklas till en frisimmande larvform som hämtar näring från sin omgivning. Andra djur, t.ex. pungdjur, föds för tidigt, men får näring i en föräldratäcke. Placentala däggdjur utvecklar ett specialiserat organ genom vilket embryot får näring under hela utvecklingen och har därför också lite äggula.
De typer av ägg som baseras på äggulans egenskaper beskrivs som:
Isolecithal: sparsamt med jämnt fördelad äggula, t.ex. sjöborre, mus
Mesolecthal: måttlig mängd äggula, ofta ojämnt fördelad, t.ex, groda
Telolecithal: tät äggula koncentrerad i ena änden, t.ex. fågel, reptil
Centrolecithal: äggula koncentrerad i mitten av ägget, t.ex. fluga
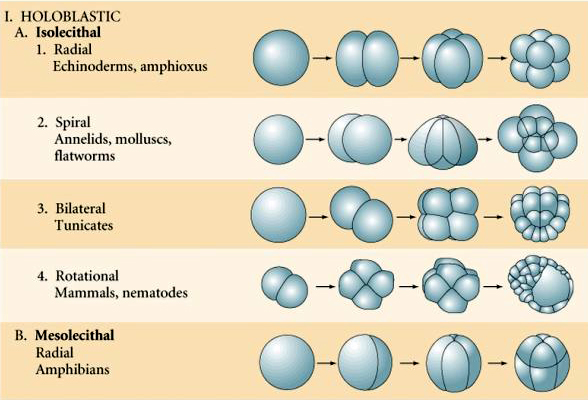
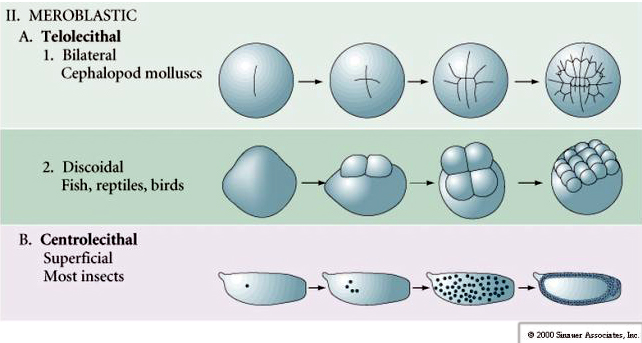
Många ägg är polariserade med en gulrik pol, kallad växtpolen, och en gulfattig pol, kallad djurpolen, t.ex. groda. Den zygotiska kärnan är i allmänhet förskjuten mot djurpolen. Zygoter med relativt lite äggula (isolecitala och mesolecitala) klyvs HOLOBLASTISKT. Klyvningsfåran sträcker sig hela vägen genom ägget. Medan telolecithala och centrolecithala zygoter genomgår MEROBLASTISK klyvning där klyvningsplanet endast sträcker sig till den ackumulerade gulan. I centrolecitala ägg (många insektsägg) är klyvningen meroblastisk och ytlig, medan klyvningen i telolecitala ägg (fåglar och fiskar) är discoidal
Det finns flera typer av klyvningssymmetri som ses i naturen: radiell (tagghudingar, amfibier), spiralformad (blötdjur, anneldjur), bilateral (ascidier, manteldjur), roterande (däggdjur). De två figurerna nedan visar exempel på holoblastisk och meroblastisk klyvningssymmetri.
RADIELL HOLOBLASTISK KLEVNING
Utmärkt film om sjöborrens klyvning från Rachel Finks ”A Dozen Eggs”.
Sjöborrar har också radiell holoblastisk klyvning, men med några intressanta skillnader. Första klyvningen är meridional. andra klyvningen är meridional. Tredje klyvningen är ekvatorial Fjärde klyvningen är meridional, men medan de fyra cellerna i djurpolen delar sig lika mycket för att ge upphov till åtta lika stora djurblastomerer, så kallade MESOMERES, delar sig de vegetabiliska cellerna asymmetriskt längs det ekvatoriala planet för att ge fyra stora MACROMERES och fyra mycket mindre MICROMERES vid den vegetabiliska polen. Femte delningen: MESOMERES delar sig ekvatoriellt för att ge två skikt med åtta MESOMERES an1 och an2, MACROMERES delar sig meridionalt och bildar ett skikt med åtta celler under an2, MICROMERES delar sig för att ge ett kluster av celler under veg1-skiktet. De sjätte delningarna är alla ekvatoriala, vilket ger ett veg2-skikt. De sjunde delningarna är alla meridionala och ger en blastula med 128 celler.
Vad bestämmer dessa klyvningsmönster? Är de beroende av den föregående klyvningen och spelas upp som ett band eller bestäms de av någon inneboende klocka? Horstadius inhiberade 1939 en eller två av de tre första klyvningarna och fann att uppkomsten av mikromererna inträffade vid rätt tidpunkt oavsett klyvningarnas historia
Slutsatsen från dessa experiment är att det finns någon faktor i äggets vegetationspol som bestämmer bildandet av mikromererna och vidare att det måste finnas en molekylär klocka som startar vid äggets aktivering. Klockan är oberoende av själva klyvningshändelsen.
Den 128-celliga blastula är en ganska lös boll av celler som omger en ihålig blastocoel. Bollen är ett cellskikt tjock med alla celler i kontakt med det yttre hyalinskiktet och den inre vätskan i blastocoeln. Vid detta utvecklingsstadium börjar cellerna bilda de täta korsningar som är karakteristiska för ett epitel. Den centrala blastocoelen är nu isolerad från den yttre miljön. Blastomererna fortsätter att dela sig med sin axel parallellt med det hyalina lagret och förblir ett epitel med en celltjocklek. Blastocysten fortsätter att utvidgas.
Två teorier försöker förklara blastocystens utvidgningsmönster
1. Den osmotiska teorin föreslår att joner och proteiner utsöndras in i blastocoelen av blastomerer och att detta resulterar i en tryckuppbyggnad på grund av det osmotiska flödet av vatten. Detta tryck skulle sedan vara ansvarigt för att rikta ut blastomerernas mitosaxel och utvidga blastocoeln.
2. Den alternativa teorin av Wolpert och hans kollegor föreslår att det i själva verket är de adhesiva interaktionerna mellan blastomererna och mellan blastomererna och det hyalina lagret som riktar ut mitosaxelns mitosaxel. Det vill säga att vidhäftningen till hyalinskiktet är störst, vidhäftningen till andra blastomerer är näst störst och slutligen är interaktionen med blastocoelväggen minst. Den dominerande vidhäftningen med hyalinskiktet tvingar blastocysten och blastocoelen att expandera.
Cellerna i blastula får cilier på sin yttre yta, utsöndrar ett kläckningsenzym (hyalinas) och blir frisimmande.
AMFIBISK KLEVERING
Kleveringen hos många amfibier är holoblastisk med radiell symmetri, men den stora volymen av äggula (dess mesolecit) stör klyvningen. Vid djurpolen går den första klyvningen framåt med cirka 1 mm/min, medan den genom växtpolen går 50-100 gånger långsammare (.02 mm/min). Medan den första klyvningen fortfarande är ofullständig i äggets yolky vegetala region börjar den andra meridionala klyvningen att äga rum.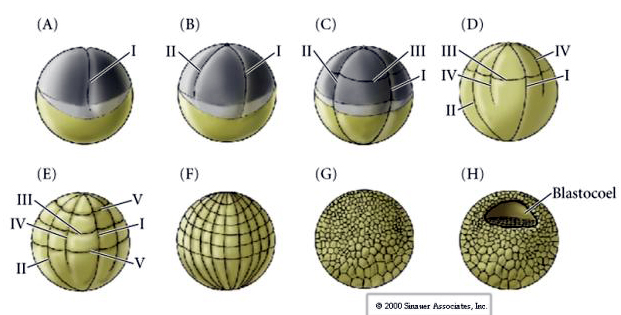
Den tredje klyvningen är ekvatorial, men eftersom kärnorna och asterna är förskjutna mot djuret förskjuts klyvningsplanet, även om det är vinkelrätt mot djurets vegetala axel, också förskjutet mot djurpolen och delar inte blastomererna lika mycket. Resultatet är fyra mindre djurblastomerer (MICROMERES) och fyra stora blastomerer från växtpolen (MACROMERES). Denna ojämna holoblastiska klyvning ger upphov till en djurpol som delar sig snabbare och består av mindre mikromerer och en växtpol som delar sig långsammare och består av makromerer. Djurpolen består snart av många små mikromerer och växtpolen av några få äggulefyllda stora makromerer. Även om bildandet av blastocellen börjar med den första klyvningen blir det inte uppenbart förrän vid 128 cellstadiet.
Vilken funktion fyller blastocellen?
Blastocellen separerar cellerna rumsligt så att de inte rör vid varandra. Celler vid blastocoelns tak blir normalt till ektoderm. Om man transplanterar celler från blastocoelns tak bredvid de yolky cellerna vid blastocoelns bas kommer de att differentieras till mesoderm. Mesodermala derivat produceras normalt från celler intill de endodermala prekursorerna. En möjlighet som vi kommer att undersöka grundligt är att de vegetativa cellerna via cellcellsinteraktioner förmår de intilliggande cellerna att bli mesodermala. Därför kan det vara nödvändigt att bilda blastocoel för att förhindra olämpliga ”induktiva” interaktioner mellan de tidiga cellerna i blastocysten. Det andra uppenbara behovet av blastocoel kan vara under det efterföljande utvecklingsstadiet, GASTRULERING, där cellerna migrerar in i blastocoelns inre.
MAMMALISK CLEAVAGE
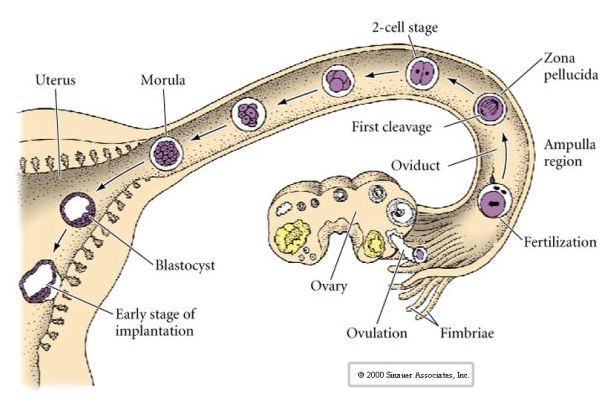
Däggdjursägget släpps ut från äggstocken till äggledaren där det befruktas. Den första klyvningen börjar ungefär ett dygn efter befruktningen i äggledaren. I skarp kontrast till de flesta djur kan klyvningen hos däggdjur vara mycket långsam—1/dag.
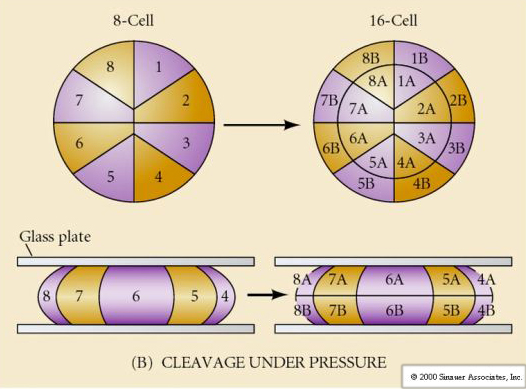
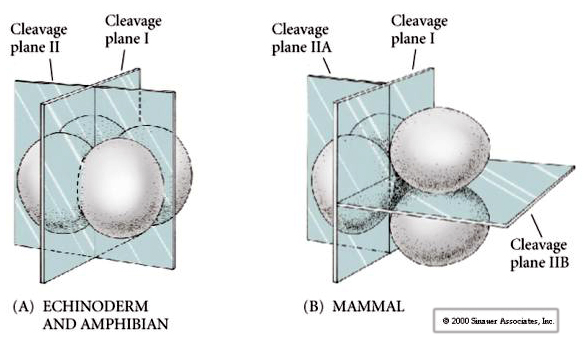 Till detta kommer att klyvningsplanerna skiljer sig något från andra djur. Första klyvningen är meridional precis som för sjöborrar och grodor. Vid den andra klyvningsdelningen delas dock en av blastomererna meridionalt och den andra ekvatoriellt! Denna typ av klyvning kallas ROTATIONAL HOLOBLASTIC CLEAVAGE.
Till detta kommer att klyvningsplanerna skiljer sig något från andra djur. Första klyvningen är meridional precis som för sjöborrar och grodor. Vid den andra klyvningsdelningen delas dock en av blastomererna meridionalt och den andra ekvatoriellt! Denna typ av klyvning kallas ROTATIONAL HOLOBLASTIC CLEAVAGE.
En annan unik egenskap hos däggdjurens klyvning är att blastomerernas klyvningar är asynkrona. (Jämfört med synkroniteten hos sjöborrar och grodor fram till mitten av blastulaövergången). Klyvningen av däggdjursembryot regleras av den zyotiska kärnan redan från början.
Igenom den tredje klyvningen bildar blastomererna en boll av löst associerade celler precis som de andra djur vi har studerat. Före den fjärde klyvningen ändrar blastomercellerna dramatiskt sitt beteende gentemot varandra. De försöker snabbt maximera sina kontakter med de andra blastomererna och får på så sätt blastula att komprimeras.

Denna kompaktering beror delvis på produktionen av en ny adhesionsmolekyl UVOMORULIN (E-Cadherin) och stabiliseras av bildandet av täta förbindningar mellan de yttre cellerna, vilket liksom hos sjöborren förseglar blastulaens inre från det yttre. Cellerna bildar också s.k. gap junctions sinsemellan som tillåter passage av små molekyler, t.ex. joner och vissa andra budbärarmolekyler, t.ex. Ca++ och C-AMP. Den kompakterade 16-celliga morula består av ett yttre skal av celler och ett fåtal celler (1-2) helt invändigt. De flesta av de yttre cellerna ger upphov till TROBLASTISKA ELLER TROPHECTODERMALA CELLER. Dessa celler bidrar inte till det egentliga embryot, utan är istället nödvändiga för embryots implantation i livmoderväggen och bildar vävnaderna i CHORIAN, en viktig komponent i placentan som vi kommer att prata om senare.
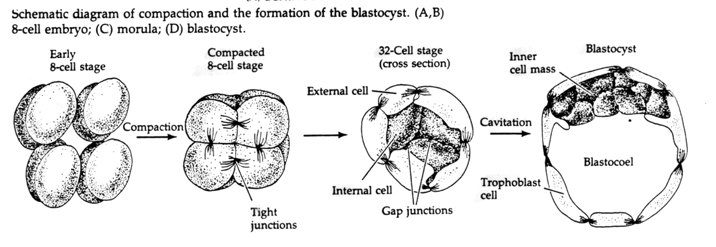
Embryots celler härstammar från de få inre cellerna i blastula i 16-cellsstadiet. Dessa celler genererar den inre cellmassan av celler från vilken hela embryot utvecklas. Vid den sjätte klyvningen, 64-cellsstadiet, är den inre cellmassan och det trophoblastiska lagret helt separerade. Trophoblasterna utsöndrar vätska internt för att skapa blastocoel. Embryot kallas nu blastocyst.
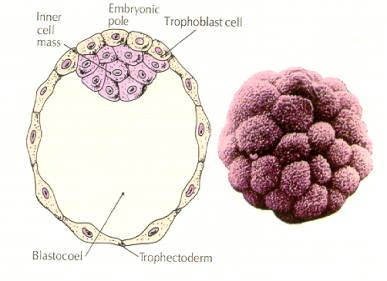 Den inre cellmassans bildning
Den inre cellmassans bildning
Hur bildas den inre cellmassan? Finns det vissa blastomerer som genom inneboende faktorer är förutbestämda att bli progenitorer för inre cellmassa? Svaret verkar vara nej. Alla tidiga blastomerer verkar vara totipotenta och fastställandet av vilka celler som kommer att bidra till det trophoblastiska lagret och vilka som kommer att bidra till den inre cellmassan är helt enkelt en fråga om slumpmässig placering. Celler från ett embryo i 4-cellsstadiet, som normalt ger upphov till både inre cellmassa och trophektodermceller, som transplanteras till utsidan av ett embryo i 32-cellsstadiet ger endast upphov till trophektoderm. De bidrar inte till det egentliga embryot. Kom ihåg från den tidigare föreläsningen om kloning att fusion av två musembryon i 8-cellsstadiet ger ett normalt embryo, vilket tyder på att alla celler i det stadiet är totipotenta.
MEROBLASTIC CLEAVAGE
I telolecitala och centrolecitala ägg förhindrar den stora, täta gulan klyvningen. Telolecitala ägg är karakteristiska för fåglar, fiskar och reptiler medan centrolecitala ägg är karakteristiska för insekter. Telolecitala ägg resulterar i meroblastisk discoidal klyvning. Klyvningen är begränsad till blastodisken vid äggets djurpol. Vid tidiga klyvningar, eftersom klyvningen inte kan fortsätta genom äggulan, är blastomererna sammanhängande vid sina vegetabiliska marginaler.
Denna film om zebrafiskens utveckling avRolf Karlstrom är utmärkt. (Film av Paul Myers)
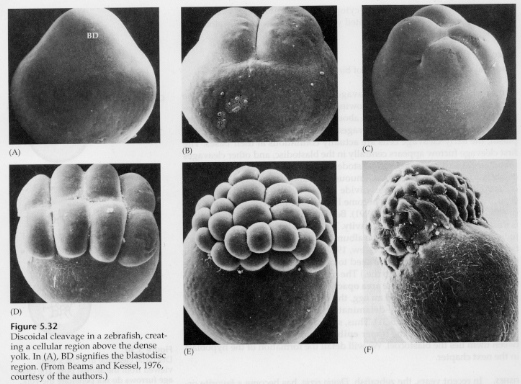 Det är inte förrän vid de ekvatoriella klyvningarna som blastodermens celler separeras från gula. Ytterligare ekvatoriella klyvningar skapar en flerskiktad blastoderm som är tre eller fyra celler tjock.
Det är inte förrän vid de ekvatoriella klyvningarna som blastodermens celler separeras från gula. Ytterligare ekvatoriella klyvningar skapar en flerskiktad blastoderm som är tre eller fyra celler tjock.
Hos fåglar bildas ett utrymme mellan blastodermen och gulesäcken som kallas för SUBGERMINAL hålighet. Vid den 16:e divisionen (60 000 celler) vandrar celler från blastodermen in i det subgerminala hålrummet för att bilda ett andra lager. De två lagren kallas yttre EPIBLAST och inre HYPOBLAST med blastocoel däremellan. Vi kommer att studera detta mer i detalj senare när vi diskuterar fågel- och däggdjursgastrulation
Centrolecitala ägg hos leddjur genomgår en SUPERFICIAL CLEAVAGE. Den stora centrala massan av äggula begränsar klyvningarna till äggets cytoplasmatiska kant.
En intressant och informativ variation ses hos insekter. De zygotiska kärnorna delar sig utan klyvning. Det vill säga kärnorna genomgår karyokinesis—-mitotisk delning av kärnan— utan cytokinesis— celldelningen. Dessa nakna kärnor kallas ENERGIDER. Kärnorna delar sig i en otrolig takt—var åttonde minut (hela embryogenesen tar bara 22 timmar).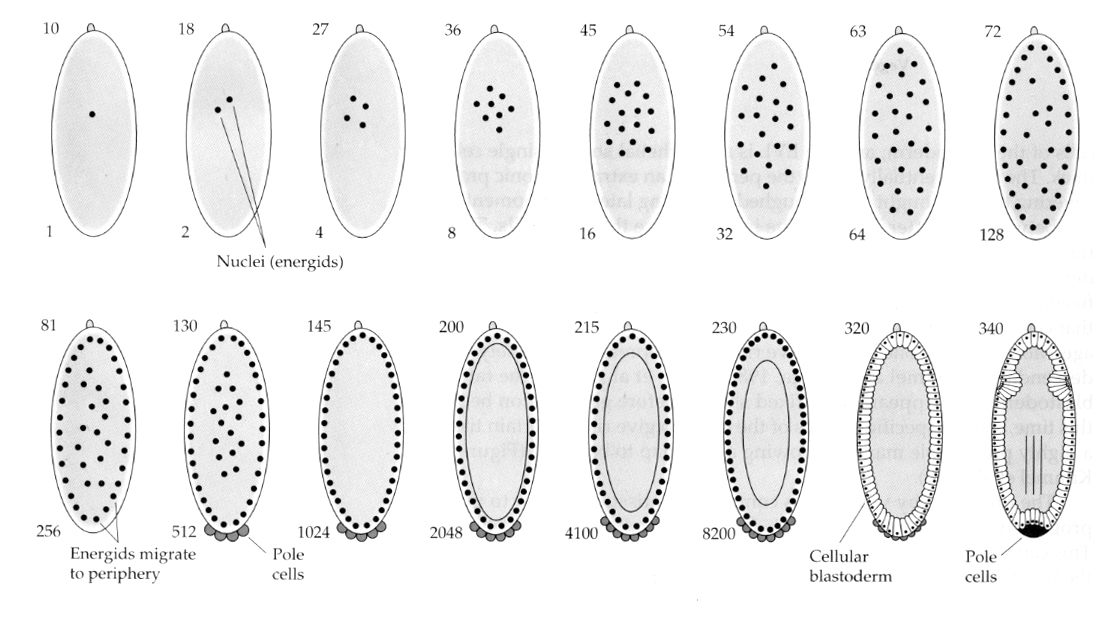
 Efter flera omgångar karyokinesi vandrar de nakna kärnorna till äggets periferi. I detta skede kallas det för SYNCYTIAL BLASTODERM eftersom alla kärnor delar samma cytoplasma. Cellulariseringen sker ungefär vid den 14:e kärndelningen för att skapa den CELLULära BLASTODERMEN. Efter denna tidpunkt delar sig cellerna asynkront. Detta motsvarar midblastulaövergången hos grodor och sjöborrar. (övergång från moderligt till huvudsakligen zygotiskt genuttryck) Kom ihåg att man trodde att midblastulaövergången utlöstes av förhållandet mellan kromatin och cytoplasma. Bevis för denna mekanism hos flugor ses genom att undersöka muterade haploida embryon. Dessa embryon genomgår midblastulaövergången och cellulariseringen en division senare 15th. Dessutom kan man påskynda cellulariseringen genom att ligera ägget och minska volymen cytoplasma. Även om det syncytiala blastodermstadiet antyder att alla kärnor är likvärdiga i och med att det inte verkar finnas några spridningsbarriärer för cytoplasmatiska bestämningsfaktorer, är cytoplasman i själva verket mycket regionaliserad och kärnorna har mycket organiserade cytoplasmatiska domäner runt omkring dem.
Efter flera omgångar karyokinesi vandrar de nakna kärnorna till äggets periferi. I detta skede kallas det för SYNCYTIAL BLASTODERM eftersom alla kärnor delar samma cytoplasma. Cellulariseringen sker ungefär vid den 14:e kärndelningen för att skapa den CELLULära BLASTODERMEN. Efter denna tidpunkt delar sig cellerna asynkront. Detta motsvarar midblastulaövergången hos grodor och sjöborrar. (övergång från moderligt till huvudsakligen zygotiskt genuttryck) Kom ihåg att man trodde att midblastulaövergången utlöstes av förhållandet mellan kromatin och cytoplasma. Bevis för denna mekanism hos flugor ses genom att undersöka muterade haploida embryon. Dessa embryon genomgår midblastulaövergången och cellulariseringen en division senare 15th. Dessutom kan man påskynda cellulariseringen genom att ligera ägget och minska volymen cytoplasma. Även om det syncytiala blastodermstadiet antyder att alla kärnor är likvärdiga i och med att det inte verkar finnas några spridningsbarriärer för cytoplasmatiska bestämningsfaktorer, är cytoplasman i själva verket mycket regionaliserad och kärnorna har mycket organiserade cytoplasmatiska domäner runt omkring dem.
Mekanismer för klyvning
Cellcykel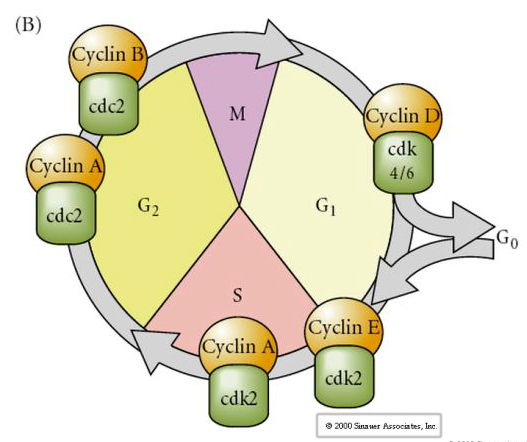
M-mitos
G1- pre-replikationsgap
S- DNA-syntes
G2-premitotiskt gap
I embryon i klyvningsstadiet, t.ex. grodor och flugor, går blastomererna direkt från M till S utan att det finns några mellanliggande G1- eller G2-stadier. Efter midblastulaövergången har cellerna i båda djuren ett G1- och G2-stadium. Eleganta transplantationsförsök har visat att det är cytoplasman som reglerar både karyokinesis och cytokinesis. Om kärnor från delande celler transplanteras till oocyter slutar de omedelbart att dela sig.
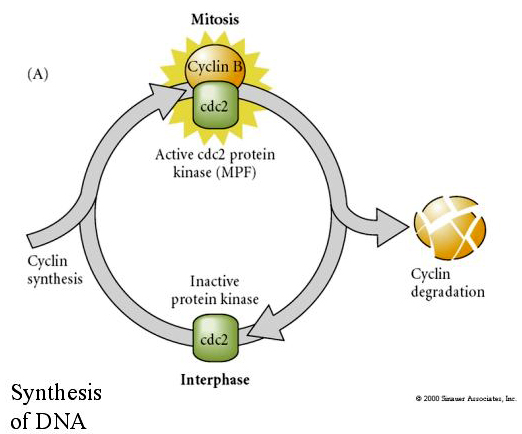 Omvänt om kärnor från icke-delande celler sätts in i befruktade enukleerade ägg börjar de att dela sig. Artificiellt aktiverade enukleerade ägg utan centrioler kommer att genomgå kortikala sammandragningar som påminner om klyvning. Några av de cytoplasmatiska faktorer som reglerar celldelningen i det tidiga embryot har identifierats.
Omvänt om kärnor från icke-delande celler sätts in i befruktade enukleerade ägg börjar de att dela sig. Artificiellt aktiverade enukleerade ägg utan centrioler kommer att genomgå kortikala sammandragningar som påminner om klyvning. Några av de cytoplasmatiska faktorer som reglerar celldelningen i det tidiga embryot har identifierats.
CYTOSTATIC FACTOR (CSF) höjs efter den första meiotiska delningen och stoppar oocyten i den andra meiotiska metafasen. Vid befruktning inaktiverar Ca CSF, meiosen avslutas och pronukleerna smälter samman.
MITOSIS PROMOTING FACTOR (MPF) får cellerna att gå in i M-fasen. MPF-aktivering orsakar: 1. kromosomkondensering genom H1 histonfosforylering, 2. nedbrytning av kärnhöljet genom hyperfosforylering av 3 kärnlaminer, 3. RNA-polymerashämning för att stänga av transkriptionen, 4. fosforylering av myosinreglerande subenheter för att hindra cytokinesin.
Föreslagen modell för cyklisk reglering av cellcykeln under klyvningsstadierna i embrogenesen. MPF inducerar cellen att gå från S till M. CSF binder till MPF och förhindrar dess inaktivering. Cellen stannar i M. Ca ökar och orsakar inaktivering av CSF vilket i sin tur leder till inaktivering av MPF och cellen går från M till S och cykeln upprepas. MPF består av två underenheter, Cyklin B och cdc2. Det är cyklin B som genomgår en cellcykelspecifik syntes och nedbrytning som regleras av cellkärnan för att kontrollera cellcykeln i normala somatiska celler. Under oogenesen är dock ägget laddat med ”regulatorer” av cyklin B och cyklin B mRNA så att dess syntes regleras av maternella faktorer som är oberoende av den zygotiska kärnan. Det är alltså inte förrän de maternella komponenterna ”tar slut” som den zygotiska kärnan tar över och en normal cellcykel (M, G1, S, G2) återkommer.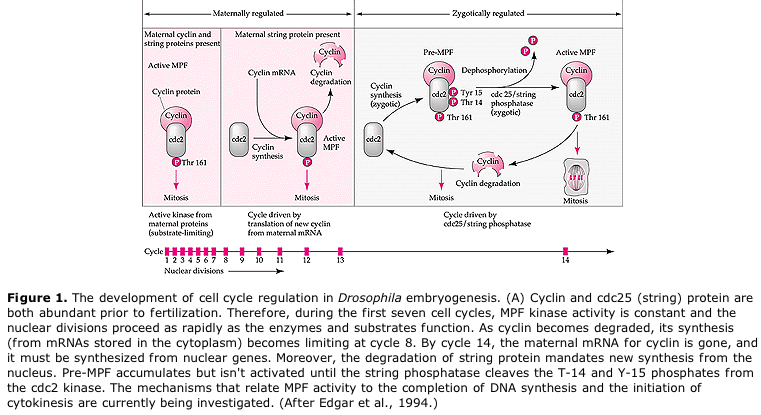
CELLFATE DETERMINATION
Cytoplasmatisk lokalisering av DETERMINANTER som en allmän och grundläggande mekanism för tidig mönstring (exempel Tunikat och Havsurikad). En viktig fråga inom utvecklingsbiologin är när och hur cellöden bestäms under utvecklingen. Detta är intimt förknippat med frågan om hur mönsterbildningen sker under utvecklingen. Embryot måste inte bara generera rätt antal och typ av differentierade celler, utan de måste också vara organiserade på rätt sätt i förhållande till alla andra celler i embryot för att bilda ett fungerande djur. Vi kommer att undersöka två möjligheter till bestämning av cellens öde och mönsterbildning: 1. Cellfödet kan bestämmas av inneboende faktorer som placeras i ägget under oogenesen och sedan fördelas till specifika blastomerer under klyvningen, 2. Extrinsika signaler från embryots omgivning kan ge mönstringsinformation för att reglera cellfödet. Som vi kommer att se använder de flesta komplexa organismer en kombination av intrinsikala och extrinsikala signaler för att reglera cellöde och embryonal mönsterbildning.
Autonom specifikation av cellöde med hjälp av cytoplasmatiska bestämningsfaktorer antyder att en cells öde helt och hållet är beroende av dess härstamning, medan ”regulativ” utveckling antyder att en cells öde bestäms av externa signaler från andra celler. Dessa två mekanismer för cellspecifikation kan särskiljas experimentellt genom isolering, ablation och transplantationsexperiment. Om en blastmere som isolerats från ett embryo differentierar sig normalt (som om den fortfarande befann sig i sin normala position i embryot) kan vi säga att den måste ha inneboende bestämningsfaktorer som specificerar dess öde. Om den däremot differentierar sig onormalt kan vi säga att dess cellöde är beroende av externa signaler. Om vi tar bort en blastomera från ett embryo och embryot utvecklas onormalt och saknar alla de cellöden som normalt uppstår från den borttagna blastomeren, säger vi att utvecklingen är cellautonom och intrinsikaliskt specificerad. Om embryot däremot utvecklas normalt säger vi att de återstående blastomererna kan reglera sitt cellöde för att kompensera för de celler som saknas. Om en transplanterad cell bibehåller sitt cellöde baserat på sin ursprungliga position säger vi att dess öde har bestämts, om den antar ett nytt öde baserat på sin nyligen transplanterade position säger vi att dess öde regleras av externa signaler från närliggande celler.
CYTOPLASMISK LOKALISERING OCH REGLERING I TUNICATE-ÄGGET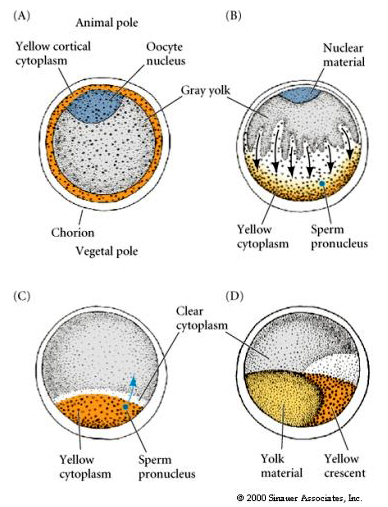
I slutet av oogenesen har tunicate-ägget en tydligt åtskild djur- och växtpol. Det finns en gul kortikal cytoplasma som omger en grå yolky inre cytoplasma. Oocytkärnan är förskjuten mot djurpolen. Sperma som kommer in i den vegetativa hemisfären befruktar ägget och inleder utvecklingen. En dramatisk omorganisering av äggets cytoplasma sker efter befruktningen vilket ger upphov till regionalt färgade cytoplasmer som tycks korrelera med efterföljande blastomeras öden.
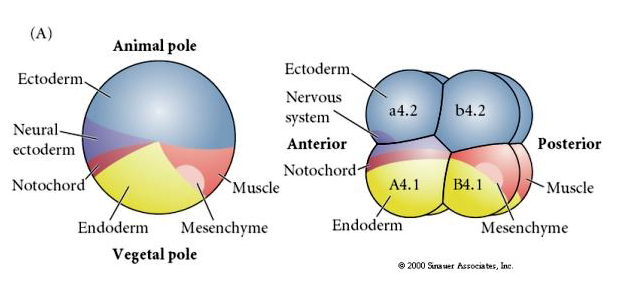 Bemärk att ödeskartan korrelerar med de olika färgade cytoplasmerna i tunikatembryot. Låt dig inte förvirras av de olika färgerna i två figurer. Den ”orange” gula halvmåne cytoplasman korrelerar med muskelöden och den Yolky (gula) cytoplasman korrelerar med endodermala öden. Den grå (vita eller blålila) cytoplasman ovanför den gula halvmånen korrelerar med neural ektoderm.
Bemärk att ödeskartan korrelerar med de olika färgade cytoplasmerna i tunikatembryot. Låt dig inte förvirras av de olika färgerna i två figurer. Den ”orange” gula halvmåne cytoplasman korrelerar med muskelöden och den Yolky (gula) cytoplasman korrelerar med endodermala öden. Den grå (vita eller blålila) cytoplasman ovanför den gula halvmånen korrelerar med neural ektoderm.
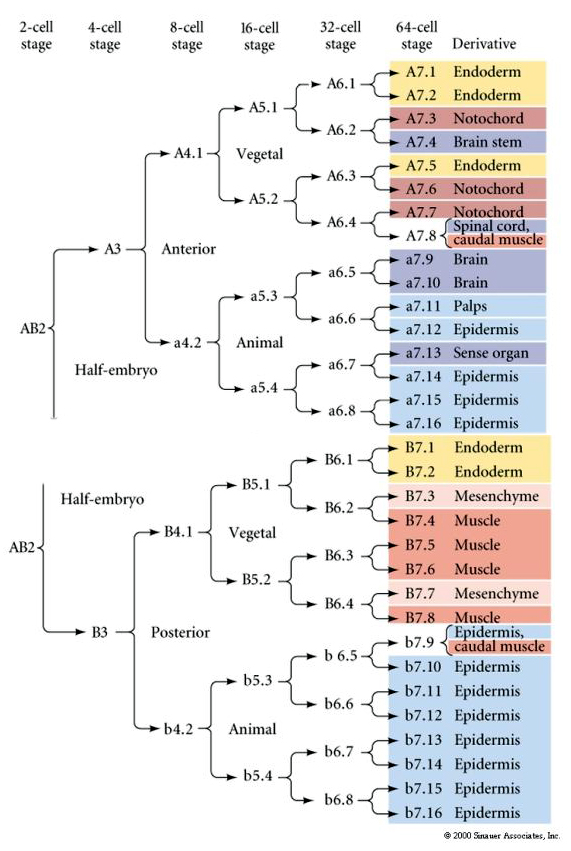 Denna linjekarta visar den invarianta linjekorrelationen med blastomerer som är parcelerade särskilda färgade cytoplasmer av de invarianta cellklyvningarna. Invarianta klyvningar och linjebildningar bevisar dock inte nödvändigtvis autonom cellspecifikation genom cytoplasmatiska bestämningsfaktorer.
Denna linjekarta visar den invarianta linjekorrelationen med blastomerer som är parcelerade särskilda färgade cytoplasmer av de invarianta cellklyvningarna. Invarianta klyvningar och linjebildningar bevisar dock inte nödvändigtvis autonom cellspecifikation genom cytoplasmatiska bestämningsfaktorer.
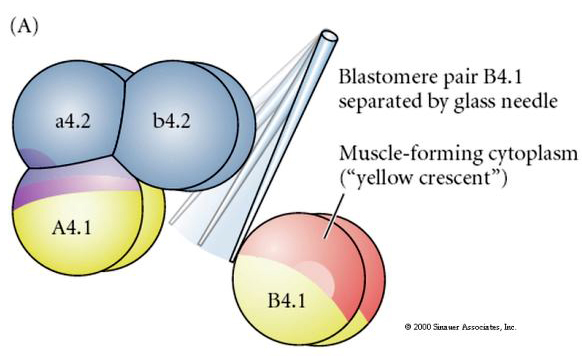 Experimentella manipulationer krävs för att testa regulativ kontra cellautonom bestämning av cellens öde. De klassiska isoleringsexperiment som visas i de tre följande figurerna försöker visa att cellens öde bestäms av cytoplasmatiska bestämningsfaktorer som de förvärvar genom stereotypa klyvningar. En glasnål används för att separera B4.1 paret av blastomerer från resten av embryot. B4.1-blastomererna förvärvar normalt den gula krumma cytoplasman som korrelerar med muskelcellens öde.
Experimentella manipulationer krävs för att testa regulativ kontra cellautonom bestämning av cellens öde. De klassiska isoleringsexperiment som visas i de tre följande figurerna försöker visa att cellens öde bestäms av cytoplasmatiska bestämningsfaktorer som de förvärvar genom stereotypa klyvningar. En glasnål används för att separera B4.1 paret av blastomerer från resten av embryot. B4.1-blastomererna förvärvar normalt den gula krumma cytoplasman som korrelerar med muskelcellens öde.
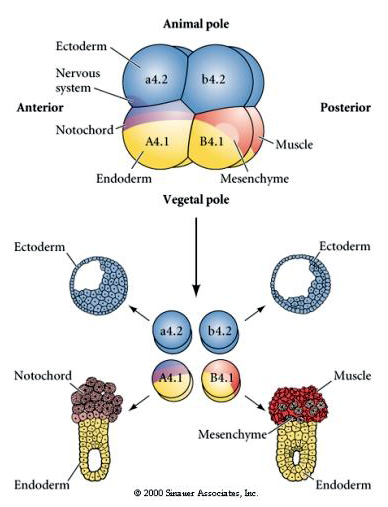
Här kan vi se resultaten av isoleringsexperimenten. I varje fall ger de isolerade blastomererna upphov till endast den undergrupp av cellfates som de normalt skulle producera i det intakta embryot. De isolerade blastomererna reglerar inte sitt öde för att kompensera för sina saknade grannar. Blastomerer från djurpolen, a4.2 och b4.2, ger endast upphov till ektodermala celler. A4.1 ger upphov till notochord och endodermala celler, medan B4.1 ger upphov till muskel- och endodermala celler. Ingen av de isolerade blastomererna kan ge upphov till alla cellkomponenter i ett normalt embryo.
I nästa experiment nedan används en nål för att manipulera det ekvatoriella klyvningsplanet så att det blir mer vegetabiliskt än normalt och nu får blastomererna från djurpolen, b4.2, en del av den ”gula halvmånen”-cytoplasman. När dessa blastomerer isoleras ger de nu upphov till några muskelceller. Detta visar på ett bra sätt att cytoplasman från den ”gula halvmånen” kan bestämma muskelcellernas öde och kan göra det på ett cellautonomt sätt. 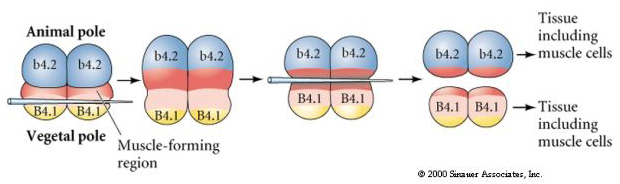
LOKALISERING OCH REGLERING I HAVET URKINÄGG
En gelékanal definierar djurpolens placering och återspeglar äggets tidiga polaritet. Det tidiga mönstret av klyvningar beror inte på platsen för spermiernas inträde, utan bestäms av äggets inneboende polaritet/asymmetri. Boveri (1901) beskrev ett subequatoriellt band av pigment som är anordnat ortongonalt i förhållande till axeln mellan djur och foster. Dessa granuler angav också var cytoplasman, som senare ingår i cellerna i archenteron, är placerad. Horstadius (1928) separerade djur- och växtblastomerer och visade att endast växtblastomeren skulle ge upphov till mikromerer, gastrulera och bilda ett skelett. Hans slutsats var att cytoplasmatiska faktorer som befinner sig i den vegetativa halvan är nödvändiga för att micromerer, gastrulation och archenteron fromation samt skelettbildning. Håll dig till mönstret av tidiga klyvningar. Mikromererna uppstår under den fjärde klyvningen (16-cellsstadiet) från en ojämlik ekvatorial delning av blastomererna från den vegetala polen.
Håll dig till mönstret av tidiga klyvningar. Mikromererna uppstår under den fjärde klyvningen (16-cellsstadiet) från en ojämlik ekvatorial delning av blastomererna från den vegetala polen.
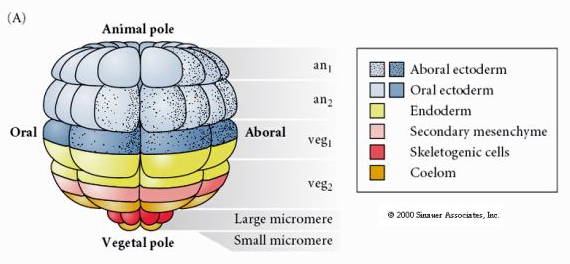 Detta visar ödeskartan för sjösjukeblastulan i 64-cellsstadiet. Lägg märke till att mikromererna är de primära mesenkymcellerna och ger upphov till larvskelettet (pluteusstadiet spicules).
Detta visar ödeskartan för sjösjukeblastulan i 64-cellsstadiet. Lägg märke till att mikromererna är de primära mesenkymcellerna och ger upphov till larvskelettet (pluteusstadiet spicules).
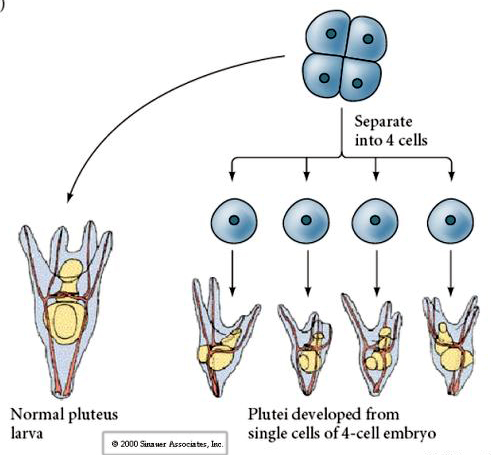 I fyracellsstadiet kan blastomererna, om de är isolerade från varandra, ”reglera” sitt öde och ge upphov till fyra små larver i pluteusstadiet.
I fyracellsstadiet kan blastomererna, om de är isolerade från varandra, ”reglera” sitt öde och ge upphov till fyra små larver i pluteusstadiet.
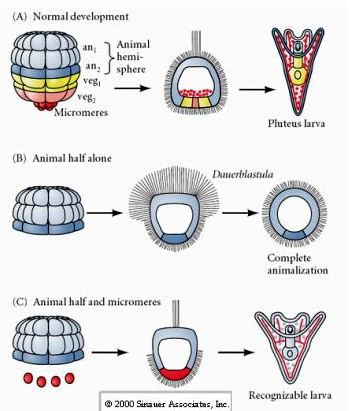 I senare stadier däremot, om man isolerar djurhalva blastomerer finner man att de endast ger upphov till en ”animaliserad” dauerblastula som inte uttrycker något mesodermalt eller endodermalt cellöde. Isolerade vegetala halva blastomerer ger upphov till larver som uttrycker ektodermala, mesodermala och endodermala cellfates, vilket visar att dessa cellers öde kan regleras. Isolerade mikromerer (primärt mesenkym) genomgår rätt antal celldelningar och ger ALLTID upphov till spikuler enligt schemat. Mikromerer är således definitivt specificerade som föregångare till de skeletogena mesenkymcellerna när de först uppträder i 16-cellsstadiet. De viktigaste experimenten bestod i att sätta ihop mikromerer med blastomerer från djurpolen och visa att även om mikromerernas öde var ”fastställt eller bestämt” vid tidpunkten för deras födelse, kunde mikromerer ”framkalla” nya cellöden i blastomerer från djurpolen. Mikromererna kunde framkalla endodermala och mesodermala öden i djurpolens blastomerer! Det sena experimentet i ”C” visar alltså att när mikromerer tillsätts till en djurhalv blastula kan man nu inducera bildandet av en igenkännbar larv som uttrycker endodermala, mesodermala och ektodermala öden.
I senare stadier däremot, om man isolerar djurhalva blastomerer finner man att de endast ger upphov till en ”animaliserad” dauerblastula som inte uttrycker något mesodermalt eller endodermalt cellöde. Isolerade vegetala halva blastomerer ger upphov till larver som uttrycker ektodermala, mesodermala och endodermala cellfates, vilket visar att dessa cellers öde kan regleras. Isolerade mikromerer (primärt mesenkym) genomgår rätt antal celldelningar och ger ALLTID upphov till spikuler enligt schemat. Mikromerer är således definitivt specificerade som föregångare till de skeletogena mesenkymcellerna när de först uppträder i 16-cellsstadiet. De viktigaste experimenten bestod i att sätta ihop mikromerer med blastomerer från djurpolen och visa att även om mikromerernas öde var ”fastställt eller bestämt” vid tidpunkten för deras födelse, kunde mikromerer ”framkalla” nya cellöden i blastomerer från djurpolen. Mikromererna kunde framkalla endodermala och mesodermala öden i djurpolens blastomerer! Det sena experimentet i ”C” visar alltså att när mikromerer tillsätts till en djurhalv blastula kan man nu inducera bildandet av en igenkännbar larv som uttrycker endodermala, mesodermala och ektodermala öden.
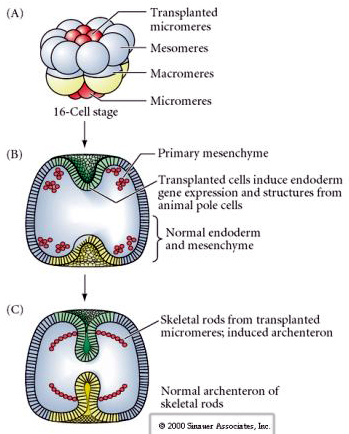 Den sista uppsättningen experiment visar att även i ett normalt embryo kan man, om man transplanterar mikromerer till djurhalvblastulan, inducera ett sekundärt arketteron och förändra den normala axiella mönstringen. Detta talar återigen för att mikromererna får en cytoplasmatisk derminant som specificerar deras cellöde och att de ger den induktiva signal som mönstrar de axiella strukturerna hos sjöpungens embryo. Mikromerernas öde kan inte ändras, men signaler från mikromererna kan ändra ödet för alla andra blastomerer.
Den sista uppsättningen experiment visar att även i ett normalt embryo kan man, om man transplanterar mikromerer till djurhalvblastulan, inducera ett sekundärt arketteron och förändra den normala axiella mönstringen. Detta talar återigen för att mikromererna får en cytoplasmatisk derminant som specificerar deras cellöde och att de ger den induktiva signal som mönstrar de axiella strukturerna hos sjöpungens embryo. Mikromerernas öde kan inte ändras, men signaler från mikromererna kan ändra ödet för alla andra blastomerer.
Horstadius: (1928, 1935) visade experimentellt att i ett embryo i 16-cellsstadiet kommer alla nivåer av blastomerer utom mikromererna att anta olika öden när de transplanteras till olika positioner i chimära embryon. Archenteron kommer att utvecklas från veg 1-blastomerer om veg 2-cellerna avlägsnas och mikromererna placeras i kontakt med veg 1-skiktet. I avsaknad av mikromerer ger veg 2-blastomerer upphov till archenteron och skelettstrukturer. Klassiskt har man åberopat en duell djur-vegetalt gradient för att förklara dessa resultat. Dessa resultat tyder dock endast på att avgörande induktiva interaktioner sker mellan intilliggande blastomerlager.
Implanterade enskilda mikromerer nära djurpolen hämmar apikal tuftbildning och inducerar i vissa fall en ny embryonal axel. Veg 2-blastomerer inducerar också förändringar som liknar mikromerer när de transplanteras intill blastomerer från djurpolen.
GENERALT RESULTAT AV TRANSPLANTATIONER: Ödet för en viss blastomerer påverkas alltid av hur olika grannceller som gränsar till dem i normala embryon placeras på varandra.
HYPOTESER: Lokaliserade maternella cytoplasmatiska bestämningsfaktorer specificerar vissa celler i det normala embryot, i synnerhet mikromererna och archenteronförstadierna nära den vegetativa polen. Dessa celler bestämmer sedan induktivt ödet för angränsande blastomerer, som i sin tur interagerar med sina grannar. Många av blastomererna behåller andra potentialer än de som de normalt uttrycker, och under en tid är dessa blastomerer endast reversibelt specificerade, vilket krävs för ett utvecklingssystem som i stor utsträckning är beroende av induktion.