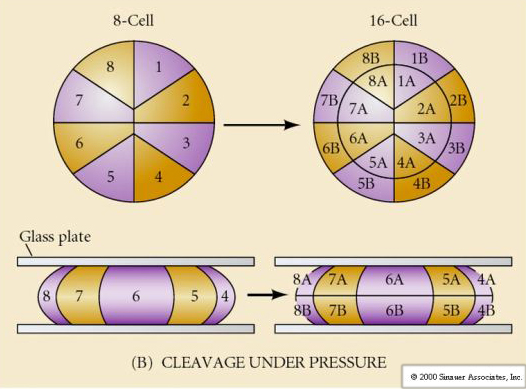
Klejenie odnosi się do stereotypowego wzorca wczesnych podziałów mitotycznych, które dzielą dużą objętość cytoplazmy jaja. Wczesna zygota jest wyjątkowa, ponieważ jest tak duża. Większość komórek przechodzi okres wzrostu pomiędzy cyklami mitozy, ale nie dotyczy to wczesnych blastomerów w stadium cleavage. Z każdym podziałem komórki stają się mniejsze. Ten szybki wzór podziału komórek bez równoczesnego wzrostu gwałtownie zatrzymuje się na etapie zwanym przejściem mid-blastula, gdzie jądro zygotyczne przejmuje kontrolę nad cyklem komórkowym.
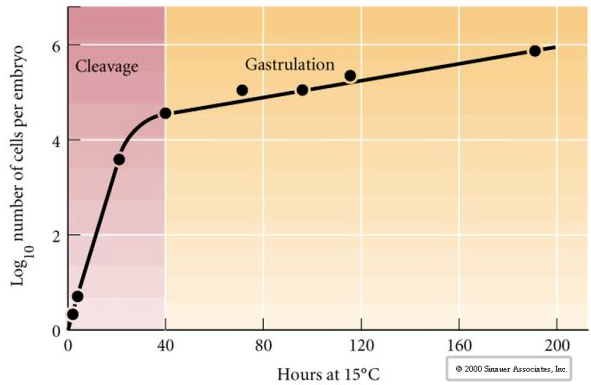 Istnieją pewne dowody na to, że czynnik matczyny, być może regulator transkrypcji, jest odpowiedzialny za ten wczesny szybki wzór podziałów rozszczepienia. Poprzez sztuczne zmienianie stosunku cytoplazmatycznego do jądrowego DNA można zmienić czas przejścia midblastuli. Przejście midblastuli odnosi się do czasu, w którym następuje główne przełączenie z ekspresji genów matczynych na zygotyczne.
Istnieją pewne dowody na to, że czynnik matczyny, być może regulator transkrypcji, jest odpowiedzialny za ten wczesny szybki wzór podziałów rozszczepienia. Poprzez sztuczne zmienianie stosunku cytoplazmatycznego do jądrowego DNA można zmienić czas przejścia midblastuli. Przejście midblastuli odnosi się do czasu, w którym następuje główne przełączenie z ekspresji genów matczynych na zygotyczne.
Płodnienie u niektórych gatunków prowadzi do radykalnych ruchów cytoplazmatycznych, które są niezbędne do zapewnienia, że determinanty cytoplazmatyczne znajdują się w prawidłowych pozycjach względem kolejnych zdarzeń rozszczepienia.
PATTERNS OF EMBRYONIC CLEAVAGE
Pattern of embryonic cleavage is determined both by the position of the mitotic spindles and by the amount and distribution of yolk. Żółtko ma tendencję do hamowania rozszczepiania. Spowalnia je lub wręcz uniemożliwia całkowite rozszczepienie. Żółtko jest adaptacją tych zwierząt, które przechodzą przez większą lub mniejszą część embriogenezy odizolowane od jakiegokolwiek pożywienia. Niektóre zwierzęta, takie jak jeżowce, mają stosunkowo mało żółtka, ponieważ szybko rozwijają się w swobodnie pływającą formę larwalną, która pozyskuje składniki odżywcze z otoczenia. Inne zwierzęta, takie jak torbacze, rodzą się przedwcześnie, ale są odżywiane w woreczku rodzicielskim. Ssaki łożyskowe rozwijają wyspecjalizowany narząd, przez który zarodek jest odżywiany przez cały okres rozwoju i dlatego również mają mało żółtka.
Rodzaje jaj oparte na cechach żółtka są opisane jako:
Isolecithal: skąpe równomiernie rozmieszczone żółtko, np. jeżowiec, mysz
Mesolecthal: umiarkowana ilość żółtka, często nierównomiernie rozmieszczonego, np, żaba
Telolecithal: gęste żółtko skupione na jednym końcu, np. ptak, gad
Centrolecithal: żółtko skupione w środku jaja, np. mucha
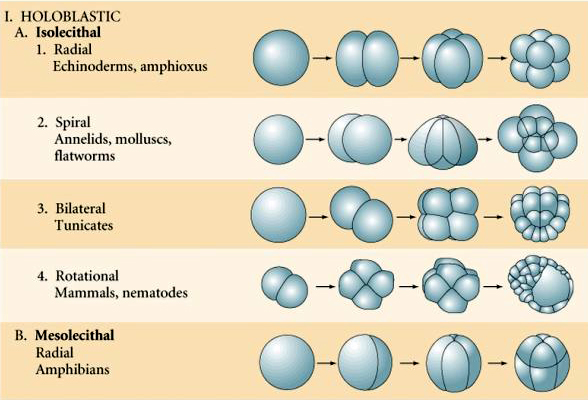
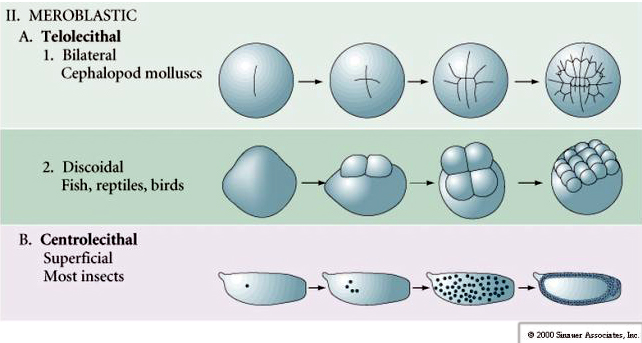
Wiele jaj jest spolaryzowanych z biegunem bogatym w żółtko, zwanym biegunem wegetatywnym i biegunem ubogim w żółtko, zwanym biegunem zwierzęcym, np. żaba. Jądro zygotyczne jest na ogół przesunięte w kierunku bieguna zwierzęcego. Zygota ze stosunkowo małą ilością żółtka (izolecytalna i mezolecytalna) rozszczepia się HOLOBLASTYCZNIE. Bruzda cięcia rozciąga się na całej długości jaja. Natomiast zygoty teloelecytarne i centrolecytarne ulegają rozszczepieniu MEROBLASTYCZNEMU, gdzie płaszczyzna rozszczepienia sięga tylko do nagromadzonego żółtka. W jajach centrocytalnych (wiele jaj owadów) rozszczepienie jest meroblastyczne i powierzchowne, podczas gdy w jajach telocytalnych (ptaki i ryby) rozszczepienie jest dyskoidalne
W przyrodzie obserwuje się kilka typów symetrii rozszczepienia: promienistą (szkarłupnie, płazy), spiralną (mięczaki, pierścienice), dwustronną (płazińce, osłonice), rotacyjną (ssaki). Dwie poniższe ryciny pokazują przykłady symetrii rozszczepienia holoblastycznego i meroblastycznego.
RADIAL HOLOBLASTIC CLEAVAGE
Doskonały film rozszczepienia jeżowca z filmu Rachel Fink „A Dozen Eggs”.
Jeziora morskie mają również radialny holoblastyczny rozszczep, ale z kilkoma interesującymi różnicami. Pierwsze rozszczepienie jest meridialne.Drugie rozszczepienie jest meridialne. Czwarty podział jest meridialny, ale podczas gdy cztery komórki biegunów zwierzęcych dzielą się równo, dając początek ośmiu równej wielkości blastomerom zwierzęcym zwanym MESOMERES, komórki wegetatywne dzielą się asymetrycznie wzdłuż płaszczyzny równikowej, dając 4 duże MACROMERES i 4 znacznie mniejsze MICROMERES na biegunie wegetatywnym. Piąty podział MESOMERES dzielą się równikowo dając dwie warstwy po osiem komórek MESOMERES an1 i an2, MACROMERES dzielą się południkowo tworząc warstwę ośmiu komórek poniżej an2, MICROMERES dzielą się dając skupisko komórek poniżej warstwy veg1. Szóste podziały są wszystkie równikowe, dając warstwę veg2. Siódmy podział jest meridionalny, dając 128 komórkową blastulę.
Co decyduje o tych wzorcach rozszczepiania? Czy zależą one od poprzedniego rozszczepienia i są odtwarzane jak taśma, czy też są określane przez jakiś wewnętrzny zegar? W 1939 roku Horstadius zahamował jedno lub dwa z pierwszych trzech rozszczepień i stwierdził, że pojawienie się mikromer wystąpiło we właściwym czasie, niezależnie od historii rozszczepień
Wniosek z tych eksperymentów jest taki, że istnieje jakiś czynnik w biegunie wegetatywnym jaja, który determinuje powstawanie mikromer i dalej, że musi istnieć zegar molekularny, który zaczyna się w momencie aktywacji jaja. Zegar ten jest niezależny od rzeczywistego zdarzenia rozszczepienia.
Blastula 128 komórkowa jest raczej luźną kulą komórek otaczających puste blastocoel. Kula ma grubość jednej warstwy komórek, a wszystkie komórki są w kontakcie z zewnętrzną warstwą hialinową i wewnętrznym płynem blastocelu. Na tym etapie rozwoju komórki zaczynają tworzyć ścisłe połączenia charakterystyczne dla nabłonka. Centralne blastocoel jest teraz odizolowane od środowiska zewnętrznego. Blastomery nadal dzielą się, a ich oś jest równoległa do warstwy hialinowej, pozostając nabłonkiem o grubości jednej komórki. Blastocoel nadal się powiększa.
Dwie teorie próbują wyjaśnić schemat powiększania się blastocysty
1. Teoria osmotyczna sugeruje, że jony i białka są wydzielane do blastocelu przez blastomery, co powoduje wzrost ciśnienia spowodowany osmotycznym przepływem wody. To ciśnienie byłoby wtedy odpowiedzialne za wyrównanie osi mitozy blastomerów i powiększenie blastocelu.
2. Alternatywna teoria Wolperta i jego kolegów sugeruje, że tak naprawdę to interakcje adhezyjne między blastomerami i między blastomerami a warstwą hialinową wyrównują osie mitotyczne. Oznacza to, że adhezja do hialiny jest największa, adhezja do innych blastomerów jest następna, a w końcu interakcja ze ścianą blastocelu jest najmniejsza. Dominująca adhezja z warstwą hialinową wymusza ekspansję blastocysty i blastocelu.
Komórki blastuli porastają rzęski na swej zewnętrznej powierzchni, wydzielają enzym wylęgowy (hialinazę) i stają się swobodnie pływające.
KLEWIZNA PŁAZÓW
Kleawizacja u wielu płazów jest holoblastyczna z symetrią promienistą, jednak duża objętość żółtka (jego mezolecyty) przeszkadza w rozszczepianiu. Na biegunie zwierzęcym pierwsze rozszczepienie przebiega z prędkością około 1mm/min, podczas gdy przez biegun wegetatywny przebiega 50-100 razy wolniej (.02mm/min). Podczas gdy pierwsze rozszczepienie jest jeszcze niekompletne w żółtym, wegetatywnym regionie jaja, zaczyna się drugie, meridialne rozszczepienie.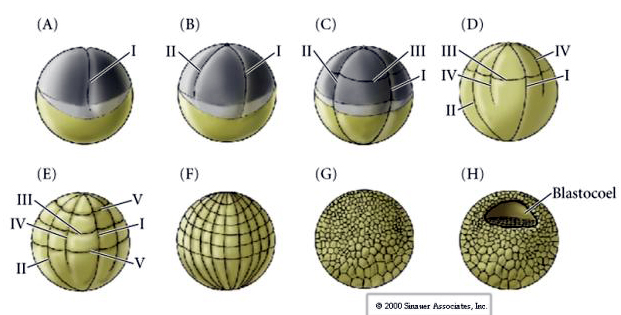
Trzecie rozszczepienie jest równikowe, ale ponieważ jądra i astry są przesunięte w kierunku zwierzęcym, płaszczyzna rozszczepienia, chociaż prostopadła do osi zwierzęco-wegetatywnej, jest również przesunięta w kierunku bieguna zwierzęcego i nie dzieli blastomerów jednakowo. W rezultacie powstają cztery mniejsze blastomery zwierzęce (zwane MICROMERES) i cztery duże blastomery bieguna wegetatywnego (zwane MACROMERES). To nierównomierne rozszczepienie holoblastyczne daje początek szybciej dzielącemu się biegunowi zwierzęcemu, składającemu się z mniejszych mikromerów i wolniej dzielącemu się biegunowi wegetatywnemu, składającemu się z makromerów. Biegun zwierzęcy wkrótce składa się z wielu małych mikromerów, a biegun wegetatywny z kilku dużych makromerów wypełnionych żółtkiem. Chociaż tworzenie blastocelu rozpoczyna się wraz z pierwszym rozszczepieniem, nie staje się ono oczywiste aż do stadium 128 komórek.
JAKĄ FUNKCJĘ SPEŁNIA BLASTOCEL?
Blastocel przestrzennie oddziela komórki tak, że nie stykają się one ze sobą. Komórki znajdujące się na dachu blastocelu normalnie stają się ektodermą. Jeśli przeszczepisz komórki z dachu blastocelu obok komórek żółtych u podstawy blastocelu, będą się one różnicować jako mezoderma. Pochodne mezodermy są zwykle produkowane z komórek sąsiadujących z prekursorami endodermalnymi. Jedną z możliwości, którą dokładnie zbadamy, jest to, że komórki wegetatywne indukują poprzez interakcje komórka-komórka sąsiednie komórki do przekształcenia się w mezodermę. W ten sposób powstanie blastocelu może być konieczne, aby zapobiec niewłaściwym „indukcyjnym” interakcjom pomiędzy wczesnymi komórkami blastocysty. Drugie oczywiste zapotrzebowanie na blastocel może być podczas kolejnego etapu rozwoju, GASTRULACJI, kiedy to komórki migrują do wnętrza blastocelu.
PIELĘGNACJA MAMMALIAN
Jajo ssaków jest uwalniane z jajnika do jajowodu, gdzie zostaje zapłodnione. Pierwsze rozszczepienie rozpoczyna się około dzień po zapłodnieniu w jajowodzie. W ostrym kontraście do większości zwierząt, rozszczepienie u ssaków może być bardzo powolne—1/dzień.
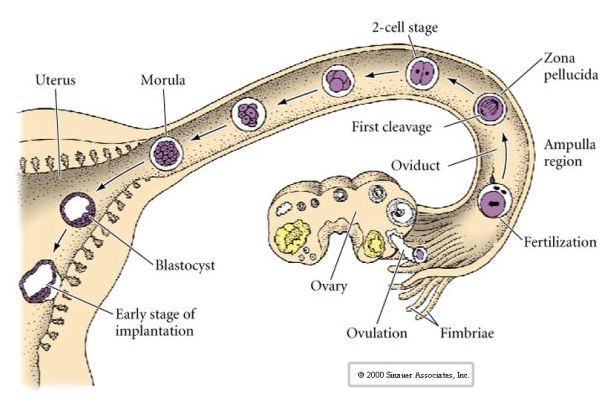
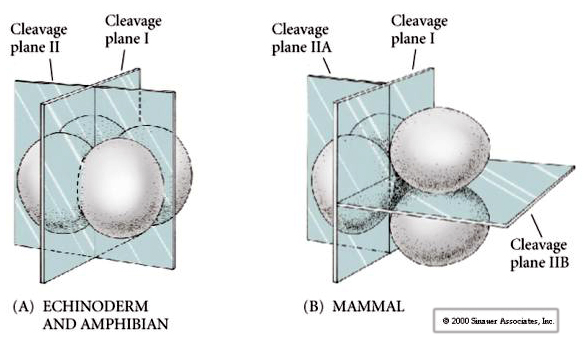 Dodatkowo, płaszczyzny rozszczepienia są nieco inne niż u innych zwierząt. Pierwszy rozszczep jest meridionalny tak jak u jeżowca i żaby. Jednak w drugim rozszczepieniu jeden z blastomerów dzieli się południkowo, a drugi równikowo! Ten typ rozszczepienia jest nazywany ROTACYJNYM ROZSZERZENIEM HOLOBLASTYCZNYM.
Dodatkowo, płaszczyzny rozszczepienia są nieco inne niż u innych zwierząt. Pierwszy rozszczep jest meridionalny tak jak u jeżowca i żaby. Jednak w drugim rozszczepieniu jeden z blastomerów dzieli się południkowo, a drugi równikowo! Ten typ rozszczepienia jest nazywany ROTACYJNYM ROZSZERZENIEM HOLOBLASTYCZNYM.
Inną unikalną cechą rozszczepienia ssaków jest to, że rozszczepienia blastomerów są asynchroniczne. (w porównaniu z synchronizacją u jeżowca i żaby aż do przejścia do midblastuli). Rozszczepienie zarodka ssaków jest regulowane przez jądro zyotyczne od samego początku.
Przez trzecie rozszczepienie blastomery tworzą kulę luźno powiązanych komórek, tak jak u innych zwierząt, które badaliśmy. Przed czwartym rozszczepieniem komórki blastuli dramatycznie zmieniają swoje zachowanie względem siebie. Szybko starają się zmaksymalizować swoje kontakty z innymi blastomerami i w ten sposób powodują zagęszczenie blastuli.

Ta KOMPAKTACJA wynika częściowo z produkcji nowej cząsteczki adhezyjnej UVOMORULIN (E-Cadherin) i jest stabilizowana przez tworzenie ścisłych połączeń między zewnętrznymi komórkami, które jak u jeżowca zamykają wnętrze blastuli od zewnątrz. Komórki tworzą również między sobą połączenia szczelinowe, które umożliwiają przepływ małych cząsteczek, takich jak jony i niektóre cząsteczki drugiego przekaźnika, takie jak Ca++ i C-AMP. Zwarta 16-komórkowa morula składa się z zewnętrznej skórki komórek i kilku komórek (1-2) całkowicie wewnętrznych. Większość komórek zewnętrznych daje początek KOMÓRKOM TROBLASTYCZNYM LUB TROPHECTODERMALNYM. Komórki te nie przyczyniają się do powstania zarodka właściwego, są natomiast niezbędne do implantacji zarodka w ścianie macicy i tworzą tkanki CHORIANU, niezbędnego składnika łożyska, o którym będziemy mówić później.
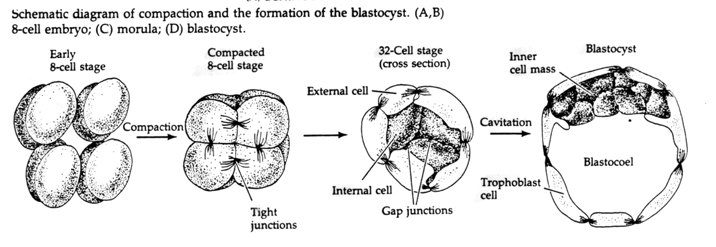
Komórki zarodka pochodzą z kilku wewnętrznych komórek 16-komórkowego stadium blastuli. Komórki te wytwarzają wewnętrzną masę komórkową, z której rozwija się cały zarodek. Do szóstego rozszczepienia, w stadium 64 komórkowym, wewnętrzna masa komórkowa i warstwa trofoblastyczna są całkowicie oddzielone. Trofoblasty wydzielają płyn do wewnątrz, tworząc blastocel. Zarodek jest teraz nazywany blastocystą.
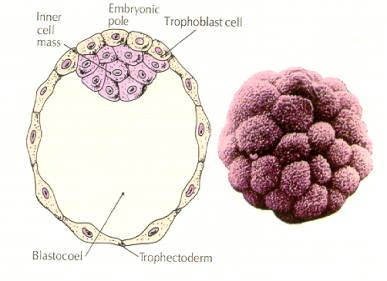 FORMACJA WEWNĘTRZNEJ MASY KOMÓRKOWEJ
FORMACJA WEWNĘTRZNEJ MASY KOMÓRKOWEJ
Jak powstają te wewnętrzne komórki masy komórkowej? Czy istnieją pewne blastomery, które są predestynowane przez czynniki wewnętrzne do stania się progenitorami wewnętrznej masy komórkowej? Wydaje się, że odpowiedź brzmi: nie. Wszystkie wczesne blastomery wydają się być totipotencjalne, a określenie, które komórki przyczynią się do powstania warstwy trofoblastycznej, a które do masy komórek wewnętrznych, jest po prostu kwestią przypadkowego położenia. Komórki z 4 komórkowego stadium zarodka, które normalnie dadzą początek zarówno wewnętrznej masie komórkowej, jak i komórkom trophektodermy, przeszczepione na zewnątrz 32 komórkowego stadium zarodka dają początek tylko trophektodermie. Nie przyczyniają się one do powstania zarodka właściwego. Pamiętajmy z wcześniejszego wykładu o klonowaniu, że fuzja dwóch zarodków mysich w stadium 8 komórkowym daje w efekcie normalny zarodek, co sugeruje, że wszystkie komórki w tym stadium są totipotencjalne.
KLEJENIE MEROBLASTYCZNE
W jajach telolecithal i centrolecithal duże gęste żółtko zapobiega rozszczepieniu. Jaja telolecytalne są charakterystyczne dla ptaków, ryb i gadów, natomiast jaja centrolecjalne są charakterystyczne dla owadów. W jajach telolecytowych dochodzi do meroblastycznego, dyskoidalnego rozszczepienia. Rozszczepienie jest ograniczone do blastodysku na zwierzęcym biegunie jaja. Przy wczesnych rozszczepieniach, ponieważ rozszczepienie nie może przebiegać przez żółtko, blastomery są ciągłe na ich wegetatywnych brzegach.
Ten film o rozwoju zebrafisha autorstwa Rolfa Karlstroma jest doskonały. (Film autorstwa Paula Myersa)
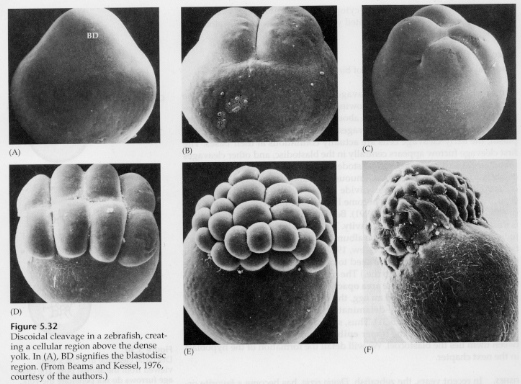 Dopiero przy rozszczepieniach równikowych komórki blastodermy oddzielają się od żółtka. Dalsze rozszczepienia równikowe tworzą wielowarstwową blastodermę o grubości trzech lub czterech komórek.
Dopiero przy rozszczepieniach równikowych komórki blastodermy oddzielają się od żółtka. Dalsze rozszczepienia równikowe tworzą wielowarstwową blastodermę o grubości trzech lub czterech komórek.
W ptakach między blastodermą a żółtkiem tworzy się przestrzeń zwana jamą PODGÓRNĄ. W wyniku 16 podziału (60 000 komórek) komórki blastodermy wędrują do jamy podskórnej, tworząc drugą warstwę. Te dwie warstwy nazywane są zewnętrzną EPIBLAST i wewnętrzną HYPOBLAST, pomiędzy którymi znajduje się blastocel. Bardziej szczegółowo zajmiemy się tym w późniejszym czasie, kiedy będziemy omawiać gastrulację ptaków i ssaków
Centrolecitalne jaja stawonogów przechodzą KLAUZULĘ NADRZĘDNĄ. Duża centralna masa żółtka ogranicza rozszczepienie do cytoplazmatycznego brzegu jaja.
Ciekawa i pouczająca odmiana występuje u owadów. Jądra zygotyczne dzielą się bez rozszczepienia. To jest jądra przechodzą kariokinezę—-mitotyczny podział jądra— bez cytokinezy–podział komórki. Te nagie jądra nazywane są ENERGIDAMI. Jądra dzielą się w zadziwiającym tempie— co 8 minut (cała embriogeneza trwa tylko 22 godz.).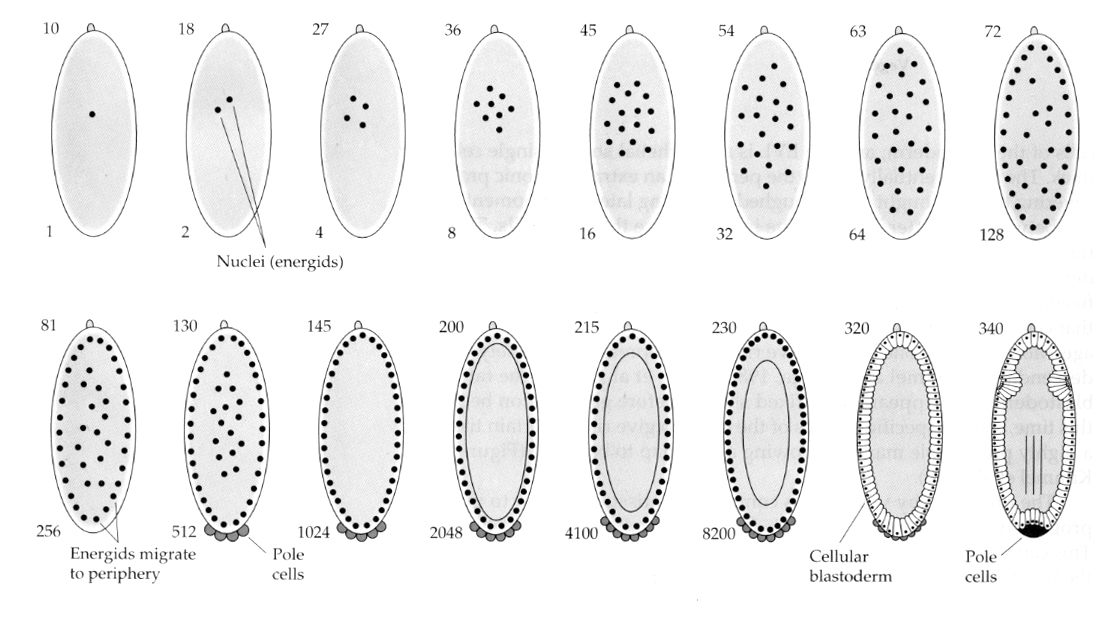
 Po kilku rundach kariokinezy nagie jądra migrują na obrzeża jaja. Na tym etapie jest ono nazywane BLASTODERMĄ SYNCYTALNĄ, ponieważ wszystkie jądra mają wspólną cytoplazmę. Komórkowanie następuje około 14. podziału jądrowego, tworząc BLASTODERMĘ KOMÓRKOWĄ. Po tym czasie komórki dzielą się asynchronicznie. Odpowiada to przejściu midblastuli u żab i jeżowców. (przejście od ekspresji genów matczynych do głównie zygotycznych) Pamiętajmy, że przejście midblastuli było uważane za wywołane przez stosunek chromatyny do cytoplazmy. Dowody na istnienie tego mechanizmu u muszki można znaleźć badając zmutowane haploidalne zarodki. Embriony te przechodzą przemianę midblastuli i komórkowanie o jeden podział później. Ponadto można przyspieszyć komórkowanie, podwi±zuj±c jajo i zmniejszaj±c objęto¶ć cytoplazmy. Chociaż stadium blastodermy syncytialnej sugeruje, że wszystkie jądra są ekwipotencjalne, ponieważ nie wydają się istnieć bariery dyfuzyjne dla determinantów cytoplazmatycznych, w rzeczywistości cytoplazma jest bardzo zregionalizowana, a jądra mają wokół siebie wysoce zorganizowane domeny cytoplazmatyczne.
Po kilku rundach kariokinezy nagie jądra migrują na obrzeża jaja. Na tym etapie jest ono nazywane BLASTODERMĄ SYNCYTALNĄ, ponieważ wszystkie jądra mają wspólną cytoplazmę. Komórkowanie następuje około 14. podziału jądrowego, tworząc BLASTODERMĘ KOMÓRKOWĄ. Po tym czasie komórki dzielą się asynchronicznie. Odpowiada to przejściu midblastuli u żab i jeżowców. (przejście od ekspresji genów matczynych do głównie zygotycznych) Pamiętajmy, że przejście midblastuli było uważane za wywołane przez stosunek chromatyny do cytoplazmy. Dowody na istnienie tego mechanizmu u muszki można znaleźć badając zmutowane haploidalne zarodki. Embriony te przechodzą przemianę midblastuli i komórkowanie o jeden podział później. Ponadto można przyspieszyć komórkowanie, podwi±zuj±c jajo i zmniejszaj±c objęto¶ć cytoplazmy. Chociaż stadium blastodermy syncytialnej sugeruje, że wszystkie jądra są ekwipotencjalne, ponieważ nie wydają się istnieć bariery dyfuzyjne dla determinantów cytoplazmatycznych, w rzeczywistości cytoplazma jest bardzo zregionalizowana, a jądra mają wokół siebie wysoce zorganizowane domeny cytoplazmatyczne.
MECHANIZMY KLAWITACJI
Cykl komórkowy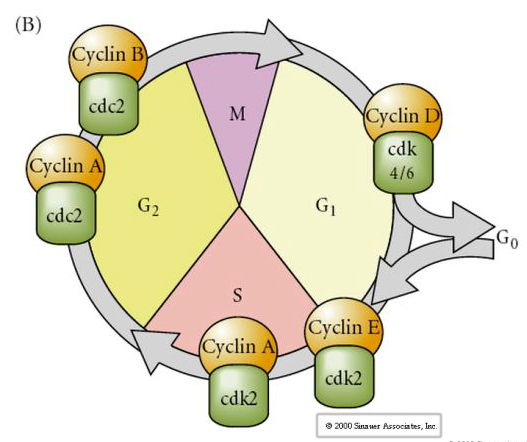
M-mitoza
G1- przerwa przedreplikacyjna
S- synteza DNA
G2- przerwa prepitotyczna
W zarodkach w stadium klawitacji, takich jak żaby i muchy, blastomery przechodzą bezpośrednio z M do S bez interwencji etapów G1 lub G2. Po przejściu midblastuli komórki u obu zwierząt mają fazy G1 i G2. Eleganckie eksperymenty transplantacyjne wykazały, że to cytoplazma reguluje zarówno kariokinezę, jak i cytokinezę. Jeśli jądra z dzielących się komórek zostaną przeszczepione do oocytu, natychmiast przestają się dzielić.
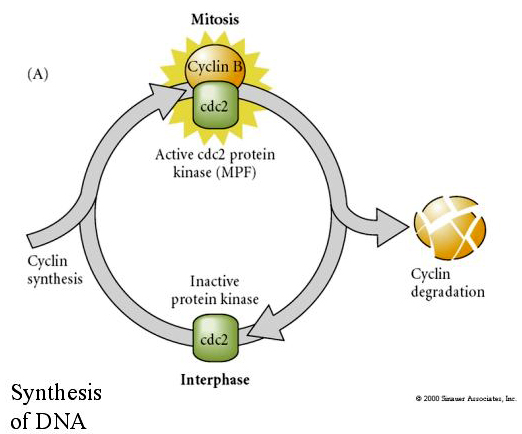 Odwrotnie, jeśli jądra z nie dzielących się komórek zostaną umieszczone w zapłodnionych enukleowanych jajach, zaczynają się dzielić. Sztucznie aktywowane enukleowane jaja bez centrioli będą ulegać skurczom korowym przypominającym rozszczepienie. Niektóre z cytoplazmatycznych czynników regulujących podziały komórkowe we wczesnym zarodku zostały zidentyfikowane.
Odwrotnie, jeśli jądra z nie dzielących się komórek zostaną umieszczone w zapłodnionych enukleowanych jajach, zaczynają się dzielić. Sztucznie aktywowane enukleowane jaja bez centrioli będą ulegać skurczom korowym przypominającym rozszczepienie. Niektóre z cytoplazmatycznych czynników regulujących podziały komórkowe we wczesnym zarodku zostały zidentyfikowane.
FAKTOR CYTOSTATYCZNY (CSF) jest podwyższony po pierwszym podziale mejotycznym i zatrzymuje oocyt w drugiej metafazie mejotycznej. Po zapłodnieniu Ca inaktywuje CSF, mejoza zostaje zakończona, a pronuklei łączą się.
FAKTOR PROMUJĄCY MITOZĘ (MPF) powoduje wejście komórek w fazę M. Aktywacja MPF powoduje: 1. kondensację chromosomów przez fosforylację histonów H1, 2. rozpad otoczki jądrowej przez hiperfosforylację 3 lamin jądrowych, 3. hamowanie polimerazy RNA w celu wyłączenia transkrypcji, 4. fosforylację podjednostki regulatorowej miozyny w celu zahamowania cytokinezy.
Proponowany model cyklicznej regulacji cyklu komórkowego w fazach rozszczepienia zarodka. MPF indukuje komórkę do przejścia z S do M. CSF wiąże się z MPF i zapobiega jego inaktywacji. Komórka pozostaje w M. Ca wzrasta i powoduje inaktywację CSF, co z kolei prowadzi do inaktywacji MPF, a komórka przechodzi z M do S i cykl się powtarza. MPF składa się z dwóch podjednostek, cykliny B i cdc2. To właśnie cyklina B ulega specyficznej dla cyklu komórkowego syntezie i degradacji regulowanej przez jądro komórkowe w celu kontroli cyklu komórkowego w normalnych komórkach somatycznych. Jednak podczas oogenezy jajo jest obciążone „regulatorami” cykliny B i mRNA cykliny B tak, że jej synteza jest regulowana przez czynniki matczyne niezależnie od jądra zygotycznego. Tak więc nie jest do czasu matczyne składniki „zabraknie”, że jądro zygotyczne przejmuje i normalny cykl komórkowy (M, G1, S, G2) powraca.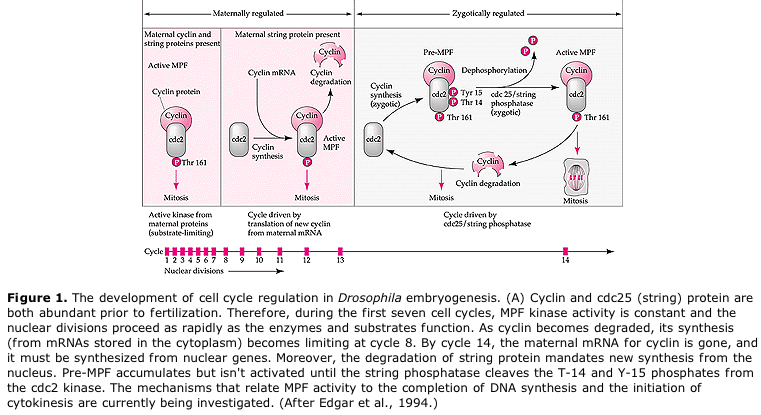
DETERMINACJA losu komórki
Lokalizacja cytoplazmatyczna DETERMINANTS jako ogólny i podstawowy mechanizm dla wczesnego patterningu (przykłady Tunicate i Sea Urchin). Jednym z głównych pytań biologii rozwojowej jest to, kiedy i jak losy komórek są określane podczas rozwoju. Jest to ściśle związane z pytaniem o to, jak przebiega formowanie wzorca podczas rozwoju. Embrion musi nie tylko wytworzyć odpowiednią liczbę i typ zróżnicowanych komórek, ale muszą one być zorganizowane w odpowiedni sposób w stosunku do wszystkich innych komórek embrionu, aby utworzyć funkcjonalne zwierzę. Przeanalizujemy dwie możliwości determinacji losu komórek i tworzenia wzorca: 1. Los komórek może być zdeterminowany przez wewnętrzne czynniki umieszczone w jaju podczas oogenezy, a następnie rozprowadzone do poszczególnych blastomerów podczas rozszczepienia, 2. Zewnętrzne sygnały dostarczane przez środowisko zarodka mogą dostarczyć informacji regulujących losy komórek. Jak zobaczymy, większość złożonych organizmów używa kombinacji wewnętrznych i zewnętrznych sygnałów do regulacji losu komórek i tworzenia wzoru embrionalnego.
Autonomiczna specyfikacja losu komórki przez cytoplazmatyczne determinanty sugeruje, że los komórki jest całkowicie zależny od jej linii, podczas gdy rozwój „regulacyjny” sugeruje, że los komórki jest określany przez zewnętrzne sygnały z innych komórek. Te dwa mechanizmy specyfikacji komórek można rozróżnić doświadczalnie poprzez eksperymenty izolacji, ablacji i transplantacji. Jeśli blastmere wyizolowana z embrionu różnicuje się normalnie (tak jakby nadal znajdowała się w swojej normalnej pozycji w embrionie), możemy powiedzieć, że musi mieć wewnętrzne determinanty, które określają jej los. Jeśli jednak różnicuje się nieprawidłowo, możemy powiedzieć, że los komórek jest zależny od sygnałów zewnętrznych. Jeśli usuniemy blastomer z embrionu, a embrion rozwija się nieprawidłowo, nie posiadając wszystkich komórek, które normalnie powstałyby z usuniętego blastomeru, powiemy, że rozwój jest autonomiczny i wewnętrznie określony. Jeśli jednak zarodek rozwija się normalnie, mówimy, że pozostałe blastomery mogą regulować swoje losy komórkowe, aby skompensować brakujące komórki. Jeśli przeszczepiona komórka zachowuje swój los komórkowy w oparciu o swoją pierwotną pozycję, mówimy, że jej los został określony, jeśli natomiast przyjmuje nowy los w oparciu o swoją nowo przeszczepioną pozycję, mówimy, że jej los jest regulowany przez zewnętrzne sygnały z pobliskich komórek.
CYTOPLASMIC LOCALIZATION AND REGULATION IN THE TUNICATE EGG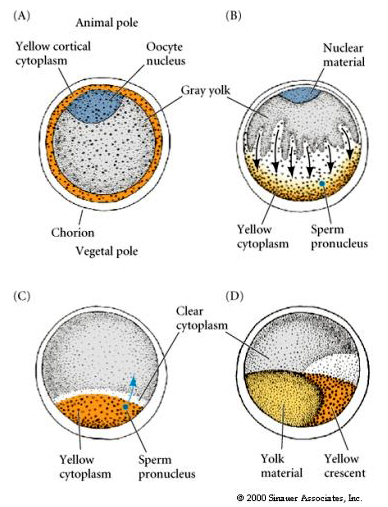
Na końcu oogenezy jajo tuńczyka ma wyraźnie wyodrębniony biegun zwierzęcy i wegetatywny. Żółta cytoplazma korowa otacza szarą, żółtawą cytoplazmę wewnętrzną. Jądro oocytu jest przesunięte w kierunku bieguna zwierzęcego. Wniknięcie plemnika do półkuli wegetatywnej zapładnia jajo i rozpoczyna rozwój. Dramatyczna rearanżacja cytoplazmy jaja następuje po zapłodnieniu, dając początek regionalnie kolorowym cytoplazmom, które wydają się korelować z kolejnymi losami blastomerów.
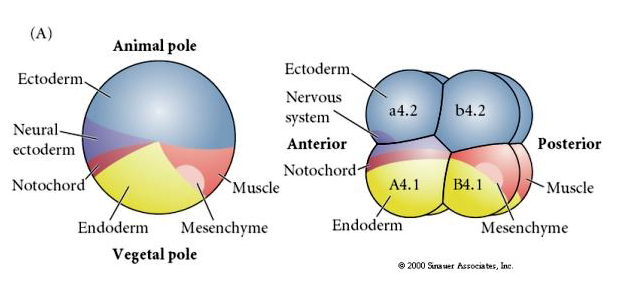 Zauważ, że mapa losów koreluje z różnymi kolorowymi cytoplazmami zarodka tuńczyka. Nie należy być zdezorientowanym przez różne kolory w dwóch figurach. Pomarańczowy” żółty półksiężyc cytoplazmy jest skorelowane z losów mięśni i Yolky (żółty) cytoplazmy jest skorelowane z losów endodermalnych. Szara (biała lub niebieskawo-fioletowa) cytoplazma powyżej żółtego półksiężyca jest skorelowana z ektodermą neuronalną.
Zauważ, że mapa losów koreluje z różnymi kolorowymi cytoplazmami zarodka tuńczyka. Nie należy być zdezorientowanym przez różne kolory w dwóch figurach. Pomarańczowy” żółty półksiężyc cytoplazmy jest skorelowane z losów mięśni i Yolky (żółty) cytoplazmy jest skorelowane z losów endodermalnych. Szara (biała lub niebieskawo-fioletowa) cytoplazma powyżej żółtego półksiężyca jest skorelowana z ektodermą neuronalną.
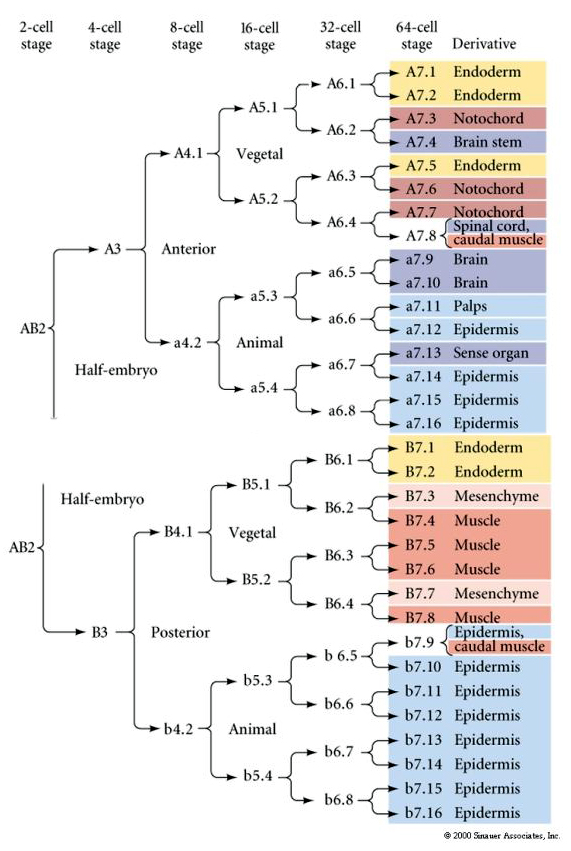 Ta mapa linii pokazuje niezmienną korelację linii z blastomerami parcelowanymi poszczególnymi kolorowymi cytoplazmami przez niezmienne rozszczepienia komórek. Jednakże, niezmienne rozszczepienia i linie nie muszą dowodzić autonomicznej specyfikacji komórek przez cytoplazmatyczne determinanty.
Ta mapa linii pokazuje niezmienną korelację linii z blastomerami parcelowanymi poszczególnymi kolorowymi cytoplazmami przez niezmienne rozszczepienia komórek. Jednakże, niezmienne rozszczepienia i linie nie muszą dowodzić autonomicznej specyfikacji komórek przez cytoplazmatyczne determinanty.
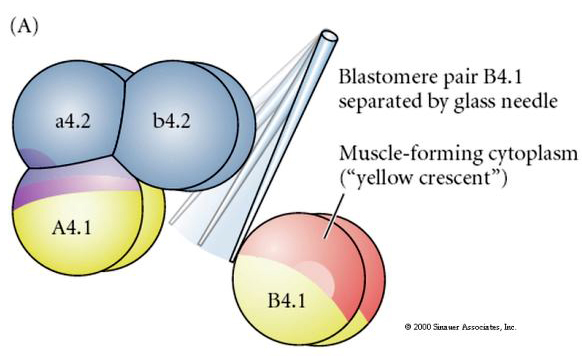 Manipulacje eksperymentalne są wymagane do testowania regulacyjnych versus autonomicznych determinacji losu komórkowego. Klasyczne eksperymenty izolacyjne przedstawione na kolejnych trzech rysunkach próbuj± wykazać, że los komórek jest determinowany przez determinanty cytoplazmatyczne, które nabywaj± one poprzez rozszczepienie stereotypu. Szklana igła służy do oddzielenia pary blastomerów B4.1 od reszty zarodka. Blastomery B4.1 normalnie nabywają żółtą krecentryczną cytoplazmę skorelowaną z losem komórek mięśniowych.
Manipulacje eksperymentalne są wymagane do testowania regulacyjnych versus autonomicznych determinacji losu komórkowego. Klasyczne eksperymenty izolacyjne przedstawione na kolejnych trzech rysunkach próbuj± wykazać, że los komórek jest determinowany przez determinanty cytoplazmatyczne, które nabywaj± one poprzez rozszczepienie stereotypu. Szklana igła służy do oddzielenia pary blastomerów B4.1 od reszty zarodka. Blastomery B4.1 normalnie nabywają żółtą krecentryczną cytoplazmę skorelowaną z losem komórek mięśniowych.
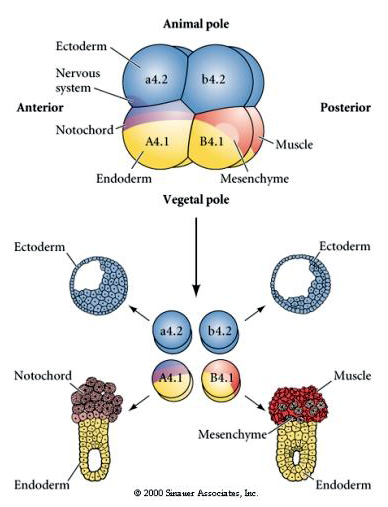
Tutaj możemy zobaczyć wyniki eksperymentów izolacyjnych. W każdym przypadku wyizolowane blastomery dają początek tylko temu podzbiorowi losów komórkowych, które normalnie wytworzyłyby w nienaruszonym zarodku. Odizolowane blastomery nie regulują swojego losu, by zrekompensować brak swoich sąsiadów. Blastomery bieguna zwierzęcego, a4.2 i b4.2, dają początek tylko komórkom ektodermalnym. A4.1 daje pocz±tek komórkom notochorda i endodermalnym, a B4.1 komórkom mię¶niowym i endodermalnym. Żaden z wyizolowanych blastomerów nie może dać początek wszystkim komórkom normalnego zarodka.
Kolejny eksperyment poniżej wykorzystuje igłę do manipulowania równikową płaszczyzną rozszczepienia tak, że jest ona bardziej roślinna niż normalna i teraz blastomery bieguna zwierzęcego, b4.2, nabywają część cytoplazmy „żółtego półksiężyca”. Kiedy te blastomery są izolowane, dają teraz początek komórkom mięśniowym. To ładnie pokazuje, że cytoplazma „żółtego półksiężyca” może decydować o losie komórek mięśniowych i może to robić w sposób autonomiczny dla komórek.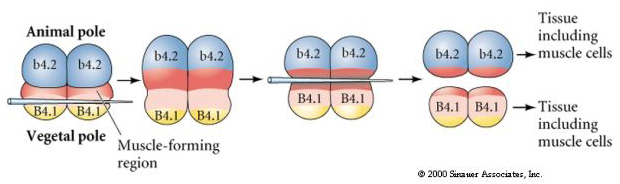
LOKALIZACJA I REGULACJA W JAJU URCHINY MORSKIEJ
Kanał galaretowaty określa lokalizację bieguna zwierzęcego i odzwierciedla wczesną biegunowość jaja. Wczesny wzór rozszczepień nie zależy od miejsca wniknięcia plemnika, ale jest określony przez wewnętrzną biegunowość/asymetrię jaja. Boveri (1901) opisał subequatorialne pasmo pigmentu ułożone ortongonalnie do osi zwierzęco-wegetatywnej. Granulki te wskazywały również na lokalizację cytoplazmy, która później wchodzi w skład komórek archenteronu. Horstadius (1928) rozdzielił blastomery zwierzęce i roślinne i wykazał, że tylko blastomery roślinne dadzą początek mikromerom, gastrulom i uformują szkielet. Jego wniosek był taki, że czynniki cytoplazmatyczne zlokalizowane w połówce wegetatywnej są niezbędne do powstania mikromerów, gastrulacji i archenteronu oraz formowania szkieletu. Pamiętajmy o schemacie wczesnych rozszczepień. Mikromery powstają podczas czwartego rozszczepienia (stadium 16 komórek) z nierównego równikowego podziału blastomerów bieguna wegetatywnego.
Pamiętajmy o schemacie wczesnych rozszczepień. Mikromery powstają podczas czwartego rozszczepienia (stadium 16 komórek) z nierównego równikowego podziału blastomerów bieguna wegetatywnego.
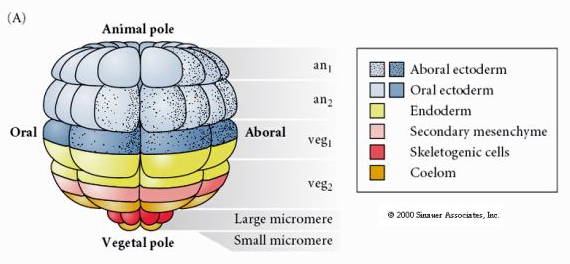 To pokazuje mapę losów 64 komórkowego stadium blastuli jeżowca. Zauważ, że mikromery są pierwotnymi komórkami mezenchymy i dają początek szkieletowi larwalnemu (spicule stadium pluteus).
To pokazuje mapę losów 64 komórkowego stadium blastuli jeżowca. Zauważ, że mikromery są pierwotnymi komórkami mezenchymy i dają początek szkieletowi larwalnemu (spicule stadium pluteus).
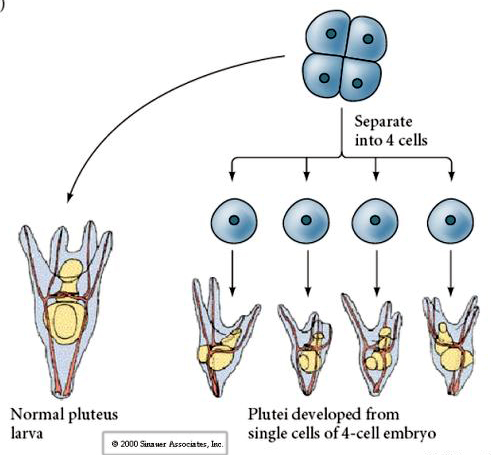 Na etapie czterech komórek, jeśli blastomery są odizolowane od siebie, są w stanie „regulować” swój los i dają początek 4 małym larwom stadium pluteus.
Na etapie czterech komórek, jeśli blastomery są odizolowane od siebie, są w stanie „regulować” swój los i dają początek 4 małym larwom stadium pluteus.
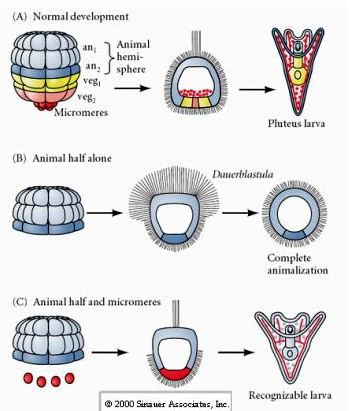 W przeciwieństwie do tego, na późniejszych etapach, jeśli izoluje się zwierzęce półblastomery, okazuje się, że produkują one tylko „animalizowaną” dauerblastulę, która nie wyraża żadnych losów komórek mezodermalnych lub endodermalnych. Izolowane wegetatywne półblastomery dają początek larwom, które wyrażają losy komórek ektodermalnych, mezodermalnych i endodermalnych, pokazując, że los tych komórek może być regulowany. Izolowane mikromery (pierwotna mezenchyma) przechodzą prawidłową liczbę podziałów komórkowych i ZAWSZE dają początek spikulom zgodnie z planem. W ten sposób mikromery s± definitywnie okre¶lone jako prekursorzy komórek mezenchymy szkieletowej, gdy pojawiaj± się po raz pierwszy w stadium 16 komórek. Kluczowym eksperymentem było umieszczenie mikromerów razem z blastomerami biegunów zwierzęcych i wykazanie, że chociaż los mikromerów był „ustalony lub zdeterminowany” w momencie ich narodzin, mikromery były w stanie „indukować” nowe losy komórek w blastomerach biegunów zwierzęcych. Mikromery były w stanie indukować endodermalne i mezodermalne losy w blastomerach biegunów zwierzęcych! Tak więc, późny eksperyment w „C” pokazuje, że kiedy mikromery są dodawane do połowy blastuli zwierzęcej, można teraz indukować tworzenie rozpoznawalnej larwy wyrażającej endodermalne, mezodermalne i ektodermalne losy.
W przeciwieństwie do tego, na późniejszych etapach, jeśli izoluje się zwierzęce półblastomery, okazuje się, że produkują one tylko „animalizowaną” dauerblastulę, która nie wyraża żadnych losów komórek mezodermalnych lub endodermalnych. Izolowane wegetatywne półblastomery dają początek larwom, które wyrażają losy komórek ektodermalnych, mezodermalnych i endodermalnych, pokazując, że los tych komórek może być regulowany. Izolowane mikromery (pierwotna mezenchyma) przechodzą prawidłową liczbę podziałów komórkowych i ZAWSZE dają początek spikulom zgodnie z planem. W ten sposób mikromery s± definitywnie okre¶lone jako prekursorzy komórek mezenchymy szkieletowej, gdy pojawiaj± się po raz pierwszy w stadium 16 komórek. Kluczowym eksperymentem było umieszczenie mikromerów razem z blastomerami biegunów zwierzęcych i wykazanie, że chociaż los mikromerów był „ustalony lub zdeterminowany” w momencie ich narodzin, mikromery były w stanie „indukować” nowe losy komórek w blastomerach biegunów zwierzęcych. Mikromery były w stanie indukować endodermalne i mezodermalne losy w blastomerach biegunów zwierzęcych! Tak więc, późny eksperyment w „C” pokazuje, że kiedy mikromery są dodawane do połowy blastuli zwierzęcej, można teraz indukować tworzenie rozpoznawalnej larwy wyrażającej endodermalne, mezodermalne i ektodermalne losy.
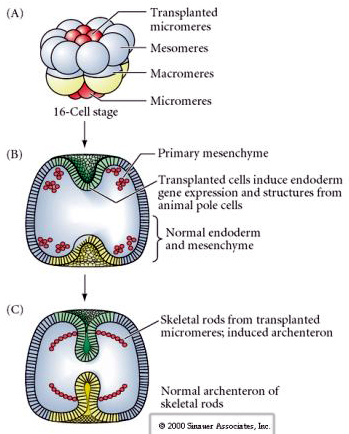 Ostatni zestaw eksperymentów pokazuje, że nawet w normalnym zarodku, jeśli przeszczepisz mikromery do czapeczki bieguna zwierzęcego, możesz wywołać wtórny archenteron i zmienić normalne osiowe ułożenie. To ponownie przemawia za tym, że mikromery nabywają cytoplazmatyczny derminant, który określa ich los komórkowy i że dostarczają one sygnału indukcyjnego, który kształtuje struktury osiowe zarodka uchowca morskiego. Los mikromeru nie może być zmieniony, ale sygnały z mikromeru mogą zmienić los wszystkich innych blastomerów.
Ostatni zestaw eksperymentów pokazuje, że nawet w normalnym zarodku, jeśli przeszczepisz mikromery do czapeczki bieguna zwierzęcego, możesz wywołać wtórny archenteron i zmienić normalne osiowe ułożenie. To ponownie przemawia za tym, że mikromery nabywają cytoplazmatyczny derminant, który określa ich los komórkowy i że dostarczają one sygnału indukcyjnego, który kształtuje struktury osiowe zarodka uchowca morskiego. Los mikromeru nie może być zmieniony, ale sygnały z mikromeru mogą zmienić los wszystkich innych blastomerów.
Horstadius: (1928, 1935) wykazał doświadczalnie, że w zarodku o stadium 16 komórek wszystkie warstwy blastomerów z wyjątkiem mikromerów przyjmą różne losy, gdy zostaną przeszczepione na różne pozycje w zarodkach chimerycznych. Archenteron rozwinie się z blastomerów veg 1, jeśli usunięte zostaną komórki veg 2, a mikromery zostaną umieszczone w kontakcie z warstwą veg 1. W przypadku braku mikromerów, blastomery veg 2 dają początek archenteronowi i strukturom szkieletowym. Klasycznie, aby wyjaśnić te wyniki, powoływano się na podwójny gradient zwierzęco-wegetatywny. Jednakże wyniki te wskazują jedynie, że decydujące interakcje indukcyjne zachodzą pomiędzy sąsiednimi warstwami blastomerów.
Implantowane pojedyncze mikromery w pobliżu bieguna zwierzęcego hamują tworzenie kępek apikalnych i w niektórych przypadkach indukują powstawanie nowych osi embrionalnych. Blastomery Veg 2 będą również wywoływać zmiany podobne do mikromerów, gdy zostaną przeszczepione obok blastomerów bieguna zwierzęcego.
GENERALNY WYNIK TRANSPLANTACJI: na losy danych blastomerów zawsze ma wpływ apozycja różnych sąsiadujących komórek, które przylegają do nich w normalnych embrionach.
HYPOTHESIS: Zlokalizowane matczyne determinanty cytoplazmatyczne określić niektóre komórki w normalnym zarodku, w szczególności micromeres i prekursorów archenteron w pobliżu bieguna wegetatywnego. Komórki te następnie indukcyjnie determinują losy sąsiednich blastomerów, które z kolei oddziałują na swoich sąsiadów. Wiele blastomerów zachowuje potencjały inne niż te, które normalnie wyrażają, i przez pewien czas blastomery te są tylko odwracalnie określone, co jest wymagane dla systemu rozwojowego, który w dużym stopniu zależy od indukcji.
.