Kleavage henviser til det stereotype mønster af tidlige mitotiske delinger, der opdeler den store mængde ægcytoplasma. Den tidlige zygote er unik ved at være så stor. De fleste celler gennemgår en periode med vækst mellem mitosecyklusser, men dette gælder ikke for blastomerer i det tidlige kløvningsstadium. Med hver deling bliver cellerne mindre. Dette hurtige mønster af celledeling uden samtidig vækst stopper brat på det stadie, der kaldes midt-blastomerne-overgangen, hvor den zygotiske kerne overtager kontrollen over cellecyklusen.
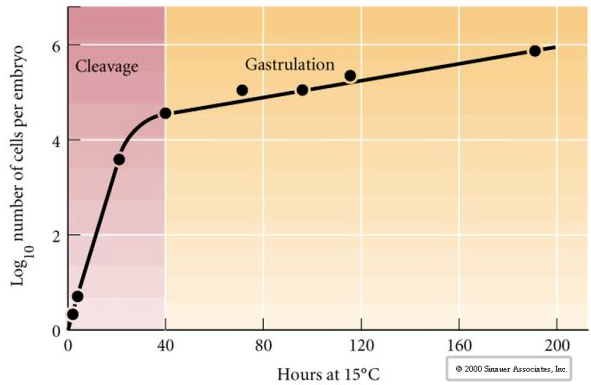 Der er noget, der tyder på, at en moderlig faktor, måske en transkriptionel regulator, er ansvarlig for dette tidlige hurtige mønster af kløvningsdelinger. Ved kunstigt at ændre forholdet mellem cytoplasmatisk og nukleært DNA kan man ændre tidspunktet for midblastula-overgangen. Midblastula-overgangen henviser til det tidspunkt, hvor det store skift fra ekspression af maternelle til zygotiske gener finder sted.
Der er noget, der tyder på, at en moderlig faktor, måske en transkriptionel regulator, er ansvarlig for dette tidlige hurtige mønster af kløvningsdelinger. Ved kunstigt at ændre forholdet mellem cytoplasmatisk og nukleært DNA kan man ændre tidspunktet for midblastula-overgangen. Midblastula-overgangen henviser til det tidspunkt, hvor det store skift fra ekspression af maternelle til zygotiske gener finder sted.
Fertilisationen fører hos nogle arter til radikale cytoplasmatiske bevægelser, der er afgørende for at sikre, at de cytoplasmatiske determinanter er placeret i de korrekte positioner i forhold til efterfølgende spaltningsbegivenheder.
PATTERNS AF EMBRYONISK KLIPPNING
Mønsteret for embryonal kløvning bestemmes både af mitotiske spindlers position og af mængden og fordelingen af æggeblomme. Gylle har en tendens til at hæmme spaltningen. Det forsinker den eller forhindrer faktisk fuldstændig spaltning. Yolk er en tilpasning hos de dyr, der gennemgår mere eller mindre af embryogenesen isoleret fra enhver fødetilførsel. Nogle dyr, som f.eks. søpindsvin, har relativt lidt æggeblomme, fordi de hurtigt udvikler sig til en fritsvømmende larveform, der optager næringsstoffer fra omgivelserne. Andre dyr, f.eks. pungdyr, fødes for tidligt, men får næring i en forældrepose. Placentale pattedyr udvikler et specialiseret organ, hvorigennem embryoet får næring under hele udviklingen, og har derfor også lidt æggeblomme.
Egtyperne af æg baseret på æggeblommens egenskaber beskrives som:
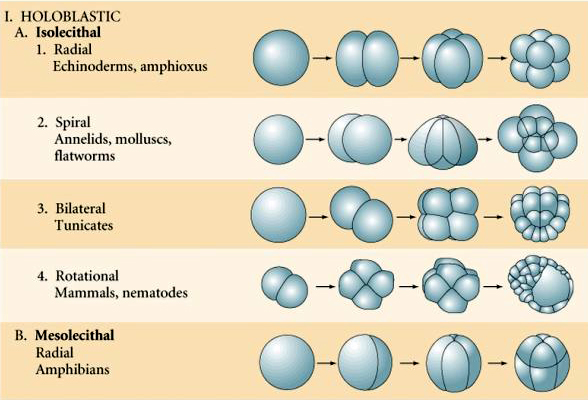
Isolecithal: sparsomt jævnt fordelt æggeblomme, f.eks. søpindsvin, mus
Mesolecithal: moderat mængde æggeblomme, ofte ujævnt fordelt, f.eks, frø
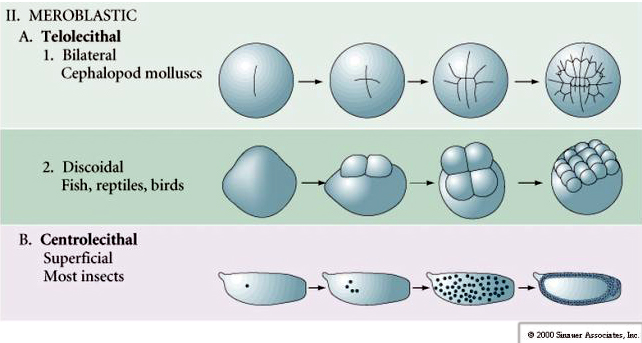
Telolecithal: tæt æggeblomme koncentreret i den ene ende, f.eks. fugl, krybdyr
Centrolecithal: æggeblomme koncentreret i midten af ægget, f.eks. flue
Mange æg er polariseret med en æggeblomme rig pol, kaldet den vegetabilske pol, og en æggeblomme fattig pol, kaldet den animalske pol, f.eks. frø. Den zygotiske kerne er generelt forskudt mod den animalske pol. Zygoter med relativt lidt æggeblomme (isolecithal og mesolecithal) spaltes HOLOBLASTISK. Spaltningsfuren strækker sig hele vejen gennem ægget. Mens telolecithale og centrolecithale zygoter gennemgår MEROBLASTISK spaltning, hvor spaltningsplanet kun strækker sig til den akkumulerede æggeblomme. I centrolecithale æg (mange insektæg) er spaltningen meroblastisk og overfladisk, mens spaltningen i telolecithale æg (fugle og fisk) er diskoidal
Der er flere typer af spaltningssymmetri, der ses i naturen: radial (pighuder, padder), spiralformet (bløddyr, annelider), bilateral (ascidier, tunikater), roterende (pattedyr). De to nedenstående figurer viser eksempler på holoblastisk og meroblastisk kløvningssymmetri.
RADIAL HOLOBLASTISK KLØVNING
Fremragende film om søpindsvinskløvning fra Rachel Finks “A Dozen Eggs”.
Søpindsvin har også radial holoblastisk kløvning, men med nogle interessante forskelle. Første kløvning er meridional. anden kløvning er meridional. Tredje spaltning er ækvatorial Fjerde spaltning er meridionalt, men mens de fire dyrepolceller deler sig ligeligt for at give anledning til otte lige store dyreblastomerer, kaldet MESOMERERER, deler de vegetale celler sig asymmetrisk langs ækvatorplanet for at give 4 store MACROMERERERER og 4 meget mindre MICROMERERER ved den vegetale pol. Ved femte deling deler MESOMERES sig ækvatorielt og giver to lag af otte MESOMERES an1 og an2 , MACROMERES deler sig meridionalt og danner et lag af otte celler under an2, MICROMERES deler sig og giver en klynge af celler under veg1-laget. De sjette delinger er alle ækvatoriale, hvilket giver et veg2-lag. Den syvende deling er alle meridionale, hvilket giver en blastula med 128 celler.
Hvad bestemmer disse spaltningsmønstre? Er de afhængige af den foregående kløvning og afspilles de som et bånd, eller er de bestemt af et eller andet iboende ur? I 1939 inhiberede Horstadius en eller to af de tre første spaltninger og fandt, at fremkomsten af mikromererne skete på det rigtige tidspunkt uanset spaltningshistorien
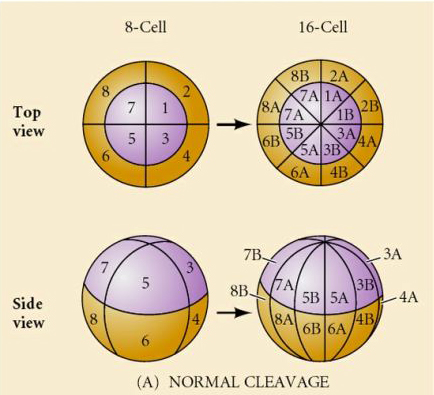
Konklusionen af disse eksperimenter er, at der er en eller anden faktor i ægets vegetative pol, der bestemmer dannelsen af mikromererne, og endvidere at der må være et molekylært ur, der starter ved aktivering af ægget. Uret er uafhængigt af selve spaltningsbegivenheden.
Den 128-cellede blastula er en ret løs kugle af celler, der omgiver en hul blastocoel. Kuglen er et cellelag tyk med alle celler i kontakt med det ydre hyalinlag og den indre væske i blastocoelen. På dette stadium i udviklingen begynder cellerne at danne de tætte forbindelser, der er karakteristiske for et epitel. Den centrale blastocoel er nu isoleret fra det ydre miljø. Blastomererne fortsætter med at dele sig med deres akse parallelt med det hyaline lag og forbliver et epitel med en celletykkelse. Blastocoelen fortsætter med at udvide sig.
To teorier forsøger at forklare mønsteret for blastocystens udvidelse
1. Den osmotiske teori antyder, at ioner og proteiner udskilles ind i blastocoelen af blastomererne, og at dette resulterer i en trykopbygning på grund af den osmotiske vandstrøm. Dette tryk ville så være ansvarlig for at justere blastomerernes mitoseakse og for udvidelsen af blastocoelen.
2. Den alternative teori af Wolpert og hans kolleger foreslår, at det i virkeligheden er de klæbende interaktioner mellem blastomererne indbyrdes og mellem blastomererne og det hyaline lag, der justerer mitoseakserne. Det vil sige, at adhæsionen til det hyaline lag er størst, adhæsionen til andre blastomerer er den næste, og endelig er interaktionen med blastocoelvæggen mindst. Den dominerende adhæsion med hyalinlaget tvinger blastocysten og blastocoelen til at udvide sig.
Cellerne i blastulaen får cilier på deres ydre overflade, udskiller et udklækningsenzym (hyalinase) og bliver fritsvømmende.
AMPHIBISK KLÆFTNING
Klækningen hos mange padder er holoblastisk med radial symmetri, men det store volumen af æggeblomme (dens mesolecithal) forstyrrer klækningen. Ved dyrepolen foregår den første spaltning med ca. 1 mm/min, mens den gennem plantepolen foregår 50-100 gange langsommere (.02 mm/min). Mens den første spaltning stadig er ufuldstændig i den yolky vegetale region af ægget, begynder den anden meridionale spaltning at finde sted.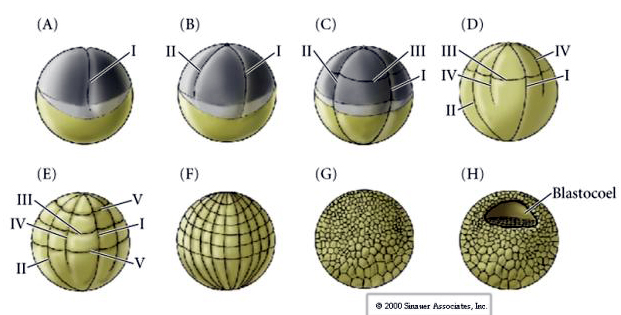
Den tredje spaltning er ækvatorial, men fordi kernerne og asterne er forskudt dyrisk mod dyret, er spaltningsplanet, selv om det er vinkelret på den animalske vegetale akse, også forskudt mod den animalske pol og deler ikke blastomererne lige meget. Resultatet er fire mindre animalske blastomerer (kaldet MICROMERES) og fire store blastomerer fra den vegetale pol (kaldet MACROMERES). Denne ulige holoblastiske spaltning giver anledning til en hurtigere deling af dyrepolen, der består af mindre mikromerer, og en langsommere deling af vegetabilske poler, der består af makromerer. Dyrepolen består snart af mange små mikromerer og plantepolen af nogle få æggeblommefyldte store makromerer. Selv om dannelsen af blastocoelen begynder med den første spaltning, bliver den ikke tydelig før 128-celle-stadiet.
Hvilken funktion har blastocoelen?
Blastocoelen adskiller cellerne rumligt, så de ikke rører hinanden. Cellerne på taget af blastocoelen bliver normalt til ektoderm. Hvis man transplanterer celler fra blastocoelens tag ved siden af de yolky celler i blastocoelens bund, vil de differentiere sig som mesoderm. Mesodermal derivater produceres normalt fra celler, der støder op til de endodermale forstadier. En mulighed, som vi vil undersøge grundigt, er, at de vegetale celler via celle-celle-interaktioner inducerer de tilstødende celler til at blive mesodermale. Dannelsen af blastocoelen kan således være nødvendig for at forhindre uhensigtsmæssige “induktive” interaktioner mellem de tidlige celler i blastocysten. Det andet indlysende behov for blastocoelen kan være under det efterfølgende udviklingsstadium, GASTRULERING, hvor cellerne migrerer ind i blastocoelens indre.
MAMMALSK CLEAVAGE
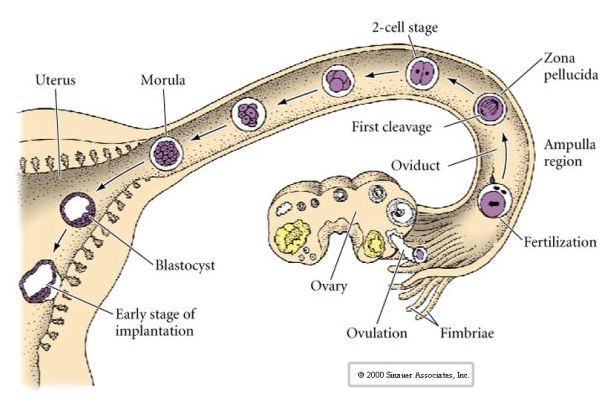
Pattedyrs ægget frigives fra æggestokken til æggelederen, hvor det befrugtes. Den første spaltning begynder ca. et døgn efter befrugtningen i æggelederen. I skarp kontrast til de fleste dyr kan spaltningen hos pattedyr være meget langsom—1/dag.
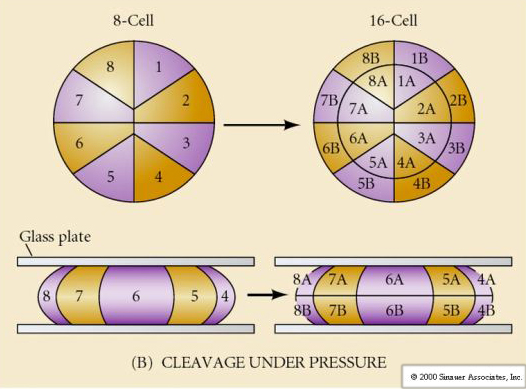
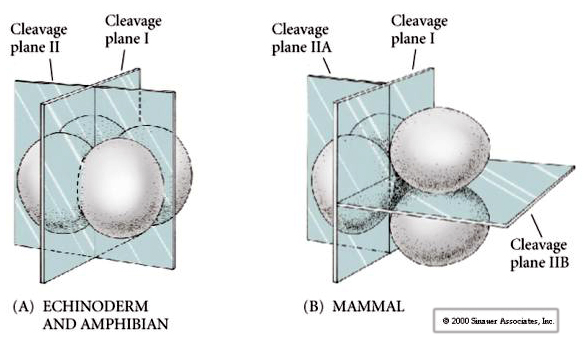 Dertil kommer, at spaltningsplanerne er noget anderledes end hos andre dyr. Første kløvning er meridionalt ligesom søpindsvin og frøer. Men ved anden kløvning deler den ene blastomer sig meridionalt og den anden ækvatorielt! Denne type spaltning kaldes ROTATIONAL HOLOBLASTIC CLEAVAGE.
Dertil kommer, at spaltningsplanerne er noget anderledes end hos andre dyr. Første kløvning er meridionalt ligesom søpindsvin og frøer. Men ved anden kløvning deler den ene blastomer sig meridionalt og den anden ækvatorielt! Denne type spaltning kaldes ROTATIONAL HOLOBLASTIC CLEAVAGE.
Et andet unikt træk ved pattedyrs spaltning er, at blastomerens spaltninger er asynkrone. (sammenlignet med synkroniteten hos søpindsvin og frøer op til midten af blastulaovergangen). Spaltningen af pattedyrsembryoet reguleres fra starten af den zyotiske kerne.
Gennem den tredje spaltning danner blastomererne en kugle af løst forbundne celler ligesom de andre dyr, vi har studeret. Før den fjerde spaltning ændrer blastomeres celler dramatisk deres adfærd over for hinanden. De forsøger hurtigt at maksimere deres kontakt med de andre blastomerer og får derved blastulaen til at komprimere sig.

Denne KOMPAKTION skyldes til dels produktionen af et nyt adhæsionsmolekyle UVOMORULIN (E-Cadherin) og stabiliseres af dannelsen af tætte forbindelser mellem de ydre celler, der ligesom hos søpindsvinet afskærmer blastulaens indre fra det ydre. Cellerne danner også indbyrdes spalteforbindelser, der tillader passage af små molekyler, såsom ioner og nogle sekundære budbringermolekyler såsom Ca++ og C-AMP. Den komprimerede 16-cellede morula består af en ydre svælg af celler og nogle få celler (1-2) helt indvendigt. De fleste af de ydre celler giver anledning til TROBLASTISKE ELLER TROPHECTODERMALE CELLER. Disse celler bidrager ikke til det egentlige embryon, men er i stedet nødvendige for embryonets implantation i livmodervæggen og danner vævene i CHORIAN, en væsentlig bestanddel af placentaen, som vi skal tale om senere.
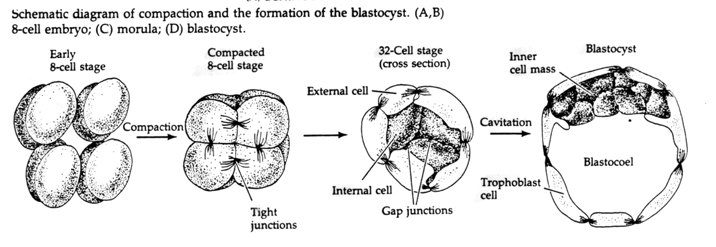
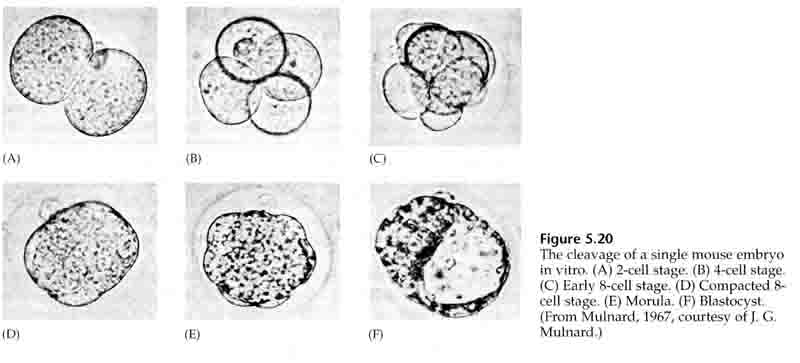
Embryonets celler stammer fra de få indre celler i blastulaen på 16-celle-stadiet. Disse celler danner den indre cellemasse af celler, hvorfra hele embryonet udvikles. Ved den 6. spaltning, 64-celle-stadiet, er den indre cellemasse og det trophoblastiske lag helt adskilt. Trophoblasterne udskiller væske indvendigt for at skabe blastocoelen. Embryoet kaldes nu for en blastocyst.
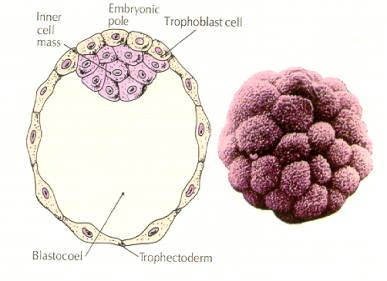 DANNELSE AF DEN INDRE CELLEMASSE
DANNELSE AF DEN INDRE CELLEMASSE
Hvordan skabes denne indre cellemassecelle? Er der visse blastomerer, der af iboende faktorer er bestemt til at blive progenitorer af indre cellemasse? Svaret synes at være nej. Alle de tidlige blastomerer synes at være totipotente, og fastlæggelsen af, hvilke celler der skal bidrage til det trophoblastiske lag og hvilke der skal bidrage til den indre cellemasse, er ganske enkelt et spørgsmål om tilfældig placering. Celler fra et embryon i 4-celle-stadiet, som normalt vil give anledning til både indre cellemasse og trophektodermceller, giver kun anledning til trophektoderm, hvis de transplanteres til ydersiden af et embryon i 32-celle-stadiet. De bidrager ikke til det egentlige embryo. Husk fra det tidligere foredrag om kloning, at fusion af to museembryoner på 8-cellestadiet giver et normalt embryo, hvilket tyder på, at alle cellerne på dette stadium er totipotente.
MEROBLASTISK KLIPPNING
I telolecithale og centrolecithale æg forhindrer den store tætte æggeblomme kløvningen. Telolecithale æg er karakteristiske for fugle, fisk og krybdyr, mens centrolecithale æg er karakteristiske for insekter. Telolecithale æg resulterer i meroblastisk discoidal spaltning. Spaltningen er begrænset til blastodisken ved æggets dyrepol. Ved tidlige spaltninger, fordi spaltningen ikke kan foregå gennem æggeblommen, er blastomererne sammenhængende ved deres vegetale rande.
Denne film om zebrafiskens udvikling afRolf Karlstrom er fremragende. (Film af Paul Myers)
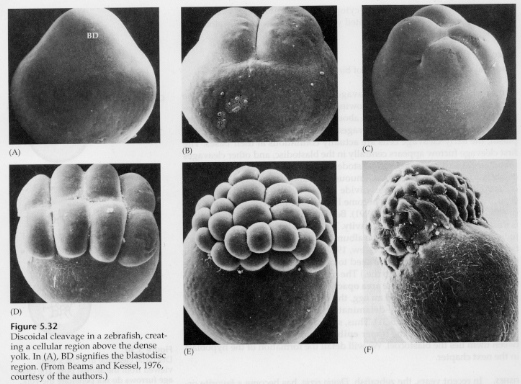 Det er først ved de ækvatoriale spaltninger, at blastodermens celler adskiller sig fra æggeblommen. Yderligere ækvatoriale spaltninger skaber en blastoderm i flere lag med en tykkelse på tre eller fire celler.
Det er først ved de ækvatoriale spaltninger, at blastodermens celler adskiller sig fra æggeblommen. Yderligere ækvatoriale spaltninger skaber en blastoderm i flere lag med en tykkelse på tre eller fire celler.
I fugle dannes der et rum mellem blastodermen og æggeblommen kaldet SUBGERMINAL hulrum. Ved den 16. deling (60.000 celler) vandrer celler fra blastodermen ind i det subgerminale hulrum for at danne et andet lag. De to lag kaldes det ydre EPIBLAST og det indre HYPOBLAST med blastocoel imellem. Vi vil studere dette mere detaljeret senere, når vi diskuterer fugle- og pattedyrsgastrulation
Centrolecital æg hos leddyr gennemgår en SUPERFICIAL CLEAVAGE. Den store centrale masse af æggeblomme begrænser spaltningerne til æggenes cytoplasmatiske rand.
En interessant og informativ variation ses hos insekter. De zygotiske kerner deler sig uden spaltning. Det vil sige, at kernerne gennemgår karyokinesis—-mitotisk deling af kernen— uden cytokinesis— deling af cellen. Disse nøgne kerner kaldes ENERGIDER. Kernerne deler sig med en utrolig hastighed—hver 8. minut (hele embryogenesen tager kun 22 timer).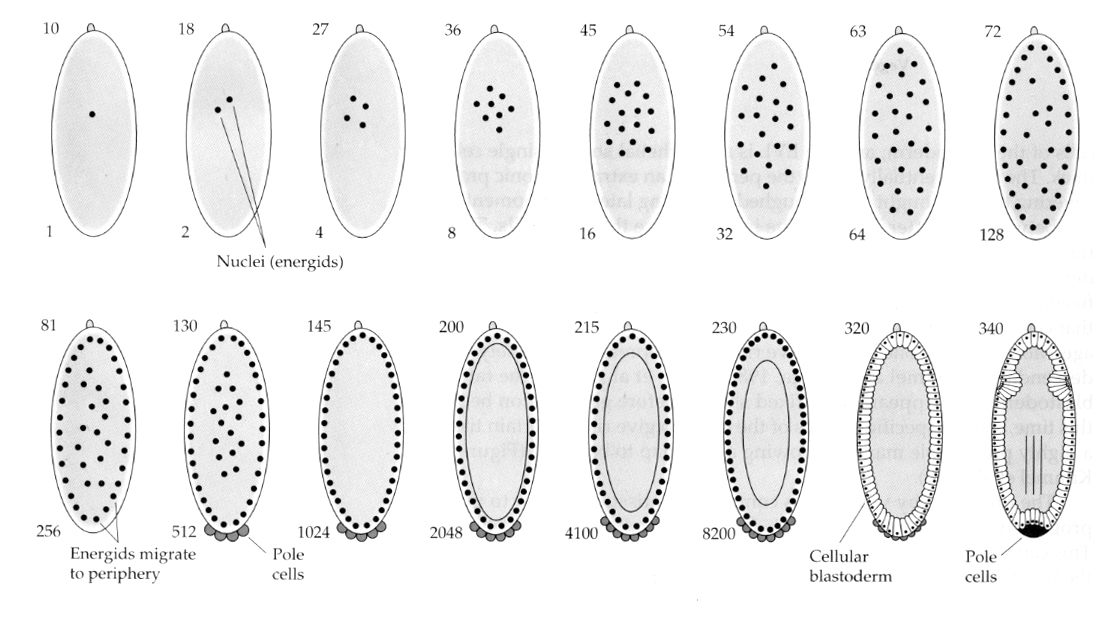
 Efter flere omgange karyokinese vandrer de nøgne kerner til æggets periferi. På dette stadium kaldes det SYNCYTIAL BLASTODERM, fordi alle kerner deler det samme cytoplasma. Cellulariseringen sker omkring den 14. kernedeling for at skabe den CELLULÆRE BLASTODERM. Efter dette tidspunkt deler cellerne sig asynkront. Dette svarer til midtblastula-overgangen hos frøer og søpindsvin. (overgang fra moderlig til primært zygotisk genudtryk) Husk, at man mente, at midblastula-overgangen blev udløst af forholdet mellem kromatin og cytoplasma. Bevis for denne mekanisme hos fluer ses ved at undersøge mutante haploide embryoner. Disse embryoner gennemgår midblastula-overgangen og cellulariseringen en division senere 15. Desuden kan man fremskynde cellulariseringen ved at ligaturere ægget og reducere mængden af cytoplasma. Selv om det syncytiale blastodermstadie antyder, at alle kerner er ligeværdige, idet der ikke synes at være spredningsbarrierer for cytoplasmatiske determinanter, er cytoplasmaet faktisk meget regionaliseret, og kernerne har meget organiserede cytoplasmatiske domæner omkring dem.
Efter flere omgange karyokinese vandrer de nøgne kerner til æggets periferi. På dette stadium kaldes det SYNCYTIAL BLASTODERM, fordi alle kerner deler det samme cytoplasma. Cellulariseringen sker omkring den 14. kernedeling for at skabe den CELLULÆRE BLASTODERM. Efter dette tidspunkt deler cellerne sig asynkront. Dette svarer til midtblastula-overgangen hos frøer og søpindsvin. (overgang fra moderlig til primært zygotisk genudtryk) Husk, at man mente, at midblastula-overgangen blev udløst af forholdet mellem kromatin og cytoplasma. Bevis for denne mekanisme hos fluer ses ved at undersøge mutante haploide embryoner. Disse embryoner gennemgår midblastula-overgangen og cellulariseringen en division senere 15. Desuden kan man fremskynde cellulariseringen ved at ligaturere ægget og reducere mængden af cytoplasma. Selv om det syncytiale blastodermstadie antyder, at alle kerner er ligeværdige, idet der ikke synes at være spredningsbarrierer for cytoplasmatiske determinanter, er cytoplasmaet faktisk meget regionaliseret, og kernerne har meget organiserede cytoplasmatiske domæner omkring dem.
MEKANISME AF KLIPPNING
Cellecyklus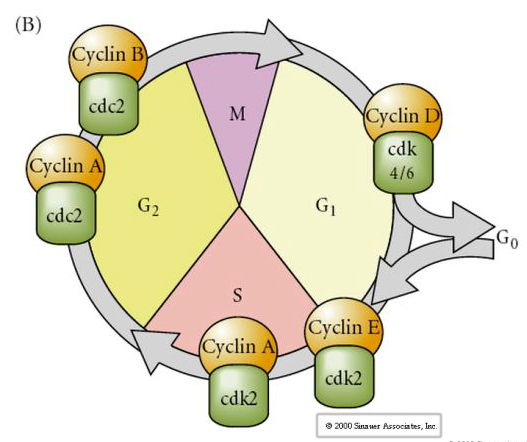
M-mitose
G1- præ-replikationsgab
S- DNA-syntese
G2-præmitosegab
I embryoner på kløvningsstadiet, såsom frøer og fluer, går blastomererne direkte fra M til S uden mellemliggende G1- eller G2-stadier. Efter midblastulaovergangen har cellerne i begge dyr et G1- og G2-stadie. Elegante transplantationsforsøg har vist, at det er cytoplasmaet, der regulerer både karyokinese og cytokinese. Hvis kerner fra celler, der deler sig, transplanteres i ægcelle, stopper de straks med at dele sig.
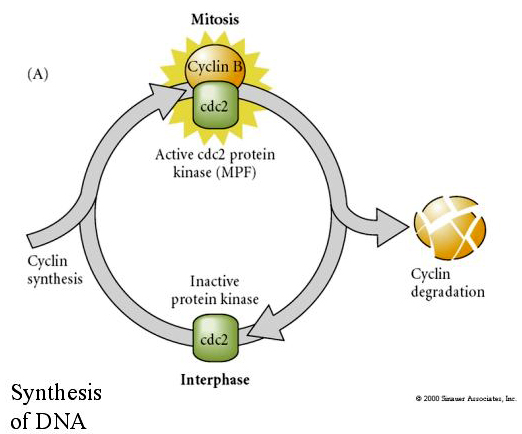 Omvendt, hvis kerner fra celler, der ikke deler sig, sættes i befrugtede enukleerede æg, begynder de at dele sig. Kunstigt aktiverede enucleerede æg uden centrioler vil underkaste sig kortikale sammentrækninger, der minder om spaltning. Nogle af de cytoplasmatiske faktorer, der regulerer celledelingen i det tidlige embryo, er blevet identificeret.
Omvendt, hvis kerner fra celler, der ikke deler sig, sættes i befrugtede enukleerede æg, begynder de at dele sig. Kunstigt aktiverede enucleerede æg uden centrioler vil underkaste sig kortikale sammentrækninger, der minder om spaltning. Nogle af de cytoplasmatiske faktorer, der regulerer celledelingen i det tidlige embryo, er blevet identificeret.
CYTOSTATIC FACTOR (CSF) er forhøjet efter den første meiotiske deling og standser oocytten i den anden meiotiske metafase. Ved befrugtning inaktiverer Ca CSF, meiosen er afsluttet, og pronuklerne fusionerer.
MITOSIS PROMOTING FACTOR (MPF) får cellerne til at gå ind i M-fasen. MPF-aktivering medfører: 1. kromosomkondensering ved H1-histonfosforylering, 2. nedbrydning af kernekuvertet ved hyperfosforylering af 3 nukleare laminer, 3. RNA-polymerasehæmning for at lukke ned for transkriptionen, 4. fosforylering af myosinregulerende underenheder for at forhindre cytokinesis.
Foreslået model for cyklisk regulering af cellecyklus under spaltningsstadier af embrogenese. MPF inducerer cellen til at gå fra S til M. CSF binder sig til MPF og forhindrer dens inaktivering. Cellen forbliver i M. Ca stiger og forårsager inaktivering af CSF, hvilket igen fører til inaktivering af MPF, og cellen går fra M til S, hvorefter cyklusen gentages. MPF består af to underenheder, Cyclin B og cdc2. Det er cyklin B, der gennemgår en cellecyklusspecifik syntese og nedbrydning, som reguleres af cellekernen for at kontrollere cellecyklusen i normale somatiske celler. Under oogenese er ægget imidlertid fyldt med “regulatorer” af cyclin B og cyclin B mRNA, således at dets syntese reguleres af moderlige faktorer uafhængigt af den zygotiske kerne. Det er således først, når de maternelle komponenter “løber ud”, at den zygotiske kerne tager over, og en normal cellecyklus (M, G1, S, G2) vender tilbage.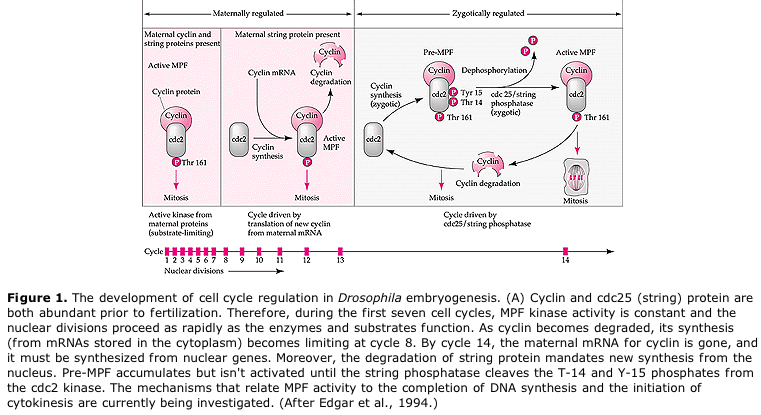
CELL FATE DETERMINATION
Cytoplasmatisk lokalisering af DETERMINANTER som en generel og grundlæggende mekanisme for tidlig mønsterdannelse (Eksempler: Tunicate og Sea Urchin). Et vigtigt spørgsmål inden for udviklingsbiologien er, hvornår og hvordan celleskæbner bestemmes i løbet af udviklingen. Dette er nært forbundet med spørgsmålet om, hvordan mønsterdannelse finder sted under udviklingen. Embryoet skal ikke blot generere det rigtige antal og den rigtige type differentierede celler, men de skal også være organiseret på den rigtige måde i forhold til alle de andre celler i embryoet for at danne et funktionelt dyr. Vi vil undersøge to muligheder for bestemmelse af celleskæbne og mønsterdannelse: 1. Celleskæbnen kan bestemmes af iboende faktorer, der placeres i ægget under oogenesen og derefter fordeles til specifikke blastomerer under spaltningen. 2. Eksterne signaler fra embryonets omgivelser kan give den mønsterdannende information til regulering af celleskæbnen. Som vi vil se, bruger de fleste komplekse organismer en kombination af intrinsiske og ekstrinsiske signaler til at regulere celleskæbne og embryonal mønsterdannelse.
Autonom celleskæbnespecifikation ved hjælp af cytoplasmatiske determinanter antyder, at en celles skæbne er helt afhængig af dens afstamning, hvorimod “regulativ” udvikling antyder, at en celles skæbne bestemmes af eksterne signaler fra andre celler. Der kan eksperimentelt skelnes mellem disse to mekanismer for cellespecifikation ved hjælp af isolations-, ablations- og transplantationsforsøg. Hvis en blastmere, der er isoleret fra et embryon, differentierer sig normalt (som om den stadig var i sin normale position i embryonet), kan vi sige, at den må have iboende determinanter, der specificerer dens skæbne. Hvis den derimod differentierer unormalt, kan vi sige, at dens celleskæbne er afhængig af eksterne signaler. Hvis vi fjerner en blastomer fra et embryo, og embryoet udvikler sig unormalt og mangler alle de celleskæbner, der normalt opstår fra den fjernede blastomer, siger vi, at udviklingen er celleautonom og intrinsisk specificeret. Hvis embryoet derimod udvikler sig normalt, siger vi, at de resterende blastomerer kan regulere deres celleskæbne for at kompensere for de manglende celler. Hvis en transplanteret celle bevarer sin celleskæbne baseret på sin oprindelige position, siger vi, at dens skæbne er bestemt, hvis den påtager sig en ny skæbne baseret på sin nyligt transplanterede position, siger vi, at dens skæbne reguleres af eksterne signaler fra nærliggende celler.
CYTOPLASMISK LOCALISERING OG REGULERING I TUNIKAT ÆGET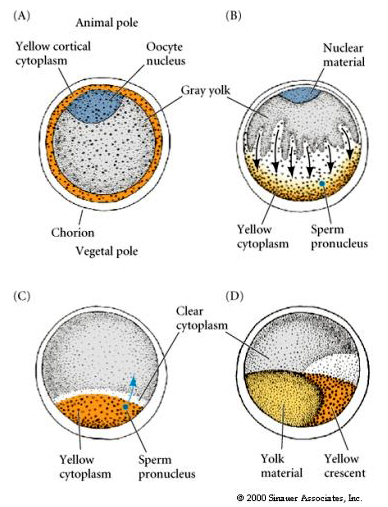
I slutningen af oogenesen har tunikatægget en klart adskilt dyrisk og vegetabilsk pol. Der er et gult kortikalt cytoplasma, som omgiver et gråt gulligt indre cytoplasma. Æggets kerne er forskudt mod den animalske pol. Sædceller, der trænger ind i den vegetale halvpol, befrugter ægget og sætter udviklingen i gang. Der sker en dramatisk omlægning af ægcytoplasmaet efter befrugtning, hvilket giver anledning til regionalt farvede cytoplasmer, der synes at korrelere med de efterfølgende blastomer-skæbner.
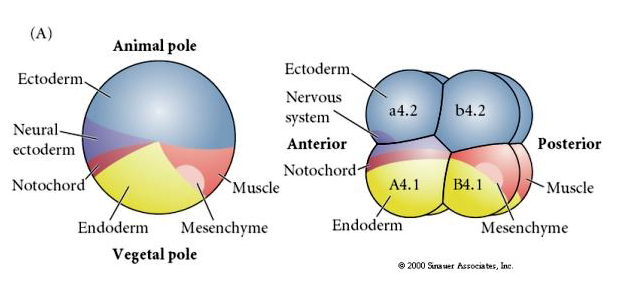 Bemærk, at skæbnekortet korrelerer med de forskellige farvede cytoplasmer i tunikatembryoet. Lad dig ikke forvirre af de forskellige farver i to figurer. Det “orange” gule halvmånecytoplasma korrelerer med muskelskæbner, og det Yolky (gule) cytoplasma korrelerer med endodermisk skæbne. Det grå (hvide eller blåviolette) cytoplasma over den gule halvmåne er korreleret med neural ektoderm.
Bemærk, at skæbnekortet korrelerer med de forskellige farvede cytoplasmer i tunikatembryoet. Lad dig ikke forvirre af de forskellige farver i to figurer. Det “orange” gule halvmånecytoplasma korrelerer med muskelskæbner, og det Yolky (gule) cytoplasma korrelerer med endodermisk skæbne. Det grå (hvide eller blåviolette) cytoplasma over den gule halvmåne er korreleret med neural ektoderm.
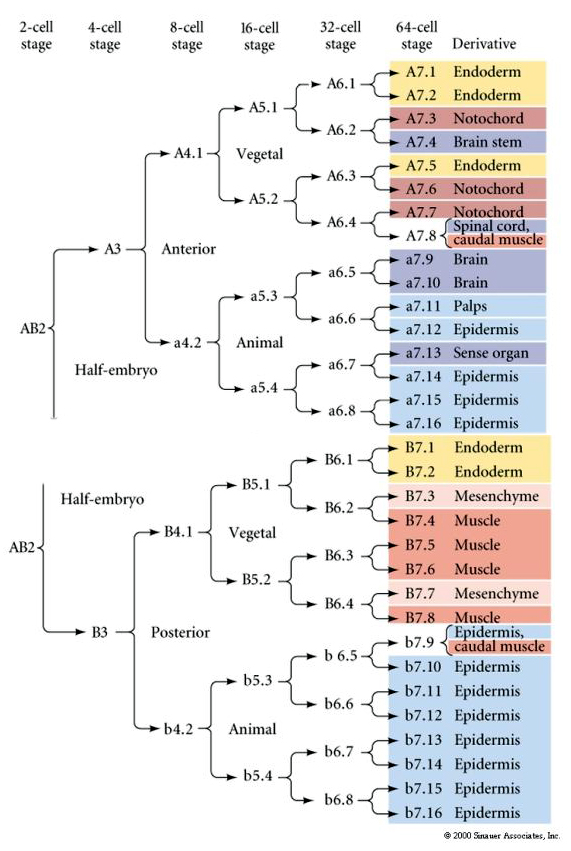 Dette afstamningskort viser den invariante afstamningskorrelation med blastomerer parceleret særlige farvede cytoplasmer ved de invariante cellekløvninger. Invariante spaltninger og linjeføringer beviser imidlertid ikke nødvendigvis autonom cellespecifikation ved cytoplasmatiske determinanter.
Dette afstamningskort viser den invariante afstamningskorrelation med blastomerer parceleret særlige farvede cytoplasmer ved de invariante cellekløvninger. Invariante spaltninger og linjeføringer beviser imidlertid ikke nødvendigvis autonom cellespecifikation ved cytoplasmatiske determinanter.
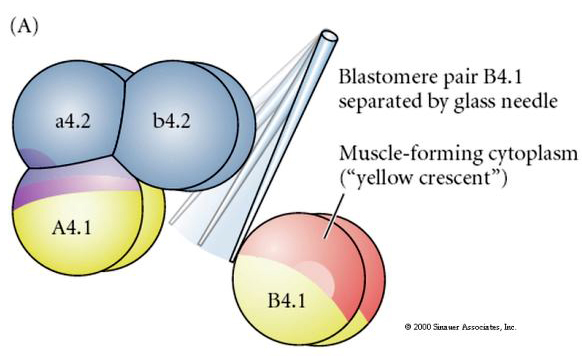 Eksperimentelle manipulationer er nødvendige for at teste regulativ versus celleautonom bestemmelse af cellens skæbne. De klassiske isolationseksperimenter, der er vist i de næste tre figurer, forsøger at vise, at celleskæbnen er bestemt af cytoplasmatiske determinanter, som de erhverver gennem stereotype spaltninger. Der anvendes en glasnål til at adskille B4.1-blastomerparret fra resten af embryonet. B4.1-blastomererne får normalt det gule crecent cytoplasma, der er korreleret med muskelcelleskæbne.
Eksperimentelle manipulationer er nødvendige for at teste regulativ versus celleautonom bestemmelse af cellens skæbne. De klassiske isolationseksperimenter, der er vist i de næste tre figurer, forsøger at vise, at celleskæbnen er bestemt af cytoplasmatiske determinanter, som de erhverver gennem stereotype spaltninger. Der anvendes en glasnål til at adskille B4.1-blastomerparret fra resten af embryonet. B4.1-blastomererne får normalt det gule crecent cytoplasma, der er korreleret med muskelcelleskæbne.
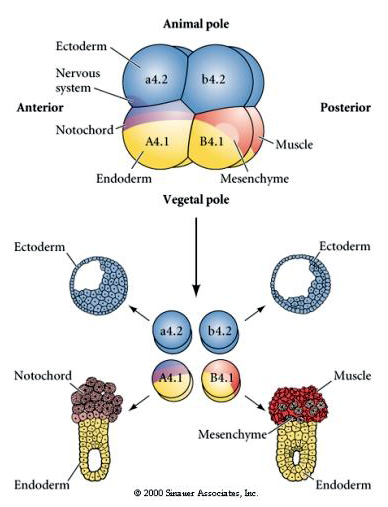
Her ses resultaterne af isolationsforsøgene. I hvert tilfælde giver de isolerede blastomerer kun anledning til den delmængde af celleskæbner, som de normalt ville producere i det intakte embryo. De isolerede blastomerer regulerer ikke deres skæbne for at kompensere for deres manglende naboer. Dyrepolens blastomerer, a4.2 og b4.2, giver kun anledning til ektodermale celler. A4.1 giver anledning til notokord- og endodermceller, mens B4.1 giver anledning til muskel- og endodermceller. Ingen af de isolerede blastomerer kan give anledning til alle cellekomponenterne i et normalt embryo.
I det næste forsøg nedenfor bruges en nål til at manipulere det ækvatoriale spaltningsplan, så det bliver mere vegetabilsk end normalt, og nu får blastomererne fra dyrepolen, b4.2, noget af den “gule halvmåne”-cytoplasmaet. Når disse blastomerer isoleres, giver de nu anledning til nogle muskelceller. Dette viser fint, at “gul halvmåne”-cytoplasmaet kan bestemme muskelcellens skæbne og kan gøre det på en celleautonom måde. 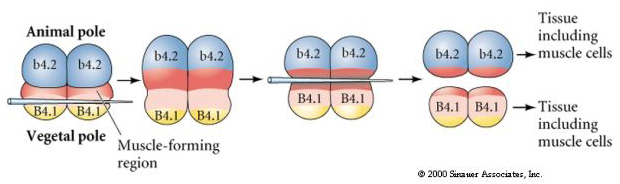
LOKALISERING OG REGULERING I HAVEMORKINEGET
En gelekanal definerer placeringen af dyrepolen og afspejler ægets tidlige polaritet. Det tidlige mønster af spaltninger afhænger ikke af det sted, hvor sædcellerne kommer ind, men er bestemt af ægets iboende polaritet/asymmetri. Boveri (1901) beskrev et subequatorielt bånd af pigment, der er anbragt ortongonalt i forhold til aksen mellem dyr og foster. Disse granula angav også placeringen af det cytoplasma, der senere indgår i cellerne i archenteronet. Horstadius (1928) adskilte animalske og vegetabilske blastomerer og viste, at kun de vegetabilske blastomerer ville give anledning til mikromerer, gastrulere og danne skelet. Hans konklusion var, at cytoplasmatiske faktorer, der befinder sig i den vegetale halvdel, er nødvendige for dannelse af mikromerer, gastrulation og archenteron samt dannelse af skelet. Husk mønsteret af tidlige kløvninger. Mikromererne opstår i løbet af den fjerde spaltning (16-celle-stadiet) fra en ulige ækvatorial deling af blastomererne fra den vegetale pol.
Husk mønsteret af tidlige kløvninger. Mikromererne opstår i løbet af den fjerde spaltning (16-celle-stadiet) fra en ulige ækvatorial deling af blastomererne fra den vegetale pol.
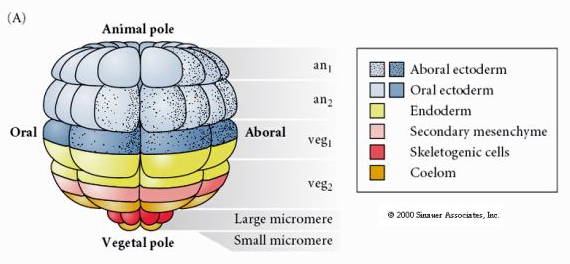 Dette viser skæbnekortet for søpindsvinets blastula på 64-celle-stadiet. Bemærk, at mikromererne er de primære mesenchymceller og giver anledning til larveskelettet (spiculae på pluteusstadiet).
Dette viser skæbnekortet for søpindsvinets blastula på 64-celle-stadiet. Bemærk, at mikromererne er de primære mesenchymceller og giver anledning til larveskelettet (spiculae på pluteusstadiet).
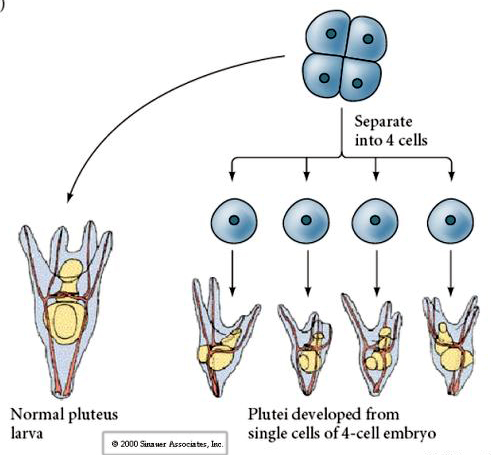 På firecellestadiet er blastomererne, hvis de er isoleret fra hinanden, i stand til at “regulere” deres skæbne og give anledning til 4 små larver på pluteusstadiet.
På firecellestadiet er blastomererne, hvis de er isoleret fra hinanden, i stand til at “regulere” deres skæbne og give anledning til 4 små larver på pluteusstadiet.
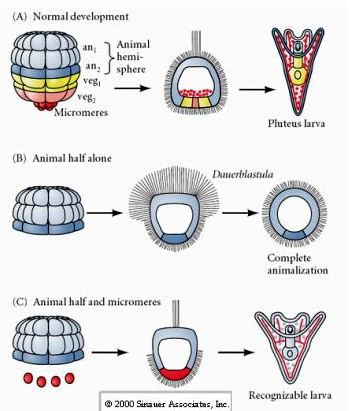 Hvis man derimod på senere stadier isolerer animalske halve blastomerer, finder man, at de kun producerer en “animaliseret” dauerblastula, der ikke udtrykker nogen mesodermal eller endodermal celleskæbne. Isolerede vegetale halvblastomerer giver anledning til larver, der udtrykker ektodermiske, mesodermiske og endodermiske celleskæbner, hvilket viser, at disse cellers skæbne kan reguleres. Isolerede mikromerer (primær mesenchym) gennemgår det korrekte antal celledelinger og giver ALTID anledning til spicules efter planen. Således er mikromererne definitivt specificeret som forløbere for de skeletogene mesenchymceller, når de først optræder i 16-celle-stadiet. De vigtigste eksperimenter bestod i at sætte mikromere sammen med blastomerer fra dyrepolen og vise, at selv om mikromeres skæbne var “fastlagt eller bestemt” på det tidspunkt, hvor de blev født, var mikromere i stand til at “inducere” nye celleskæbner i blastomerer fra dyrepolen. Mikromererne var i stand til at fremkalde endodermisk og mesodermisk skæbne i blastomererne fra dyrepolen! Det sene eksperiment i “C” viser således, at når man tilføjer mikromerer til en dyrehalvblastula, kan man nu inducere dannelsen af en genkendelig larve, der udtrykker endodermiske, mesodermiske og ektodermiske skæbner.
Hvis man derimod på senere stadier isolerer animalske halve blastomerer, finder man, at de kun producerer en “animaliseret” dauerblastula, der ikke udtrykker nogen mesodermal eller endodermal celleskæbne. Isolerede vegetale halvblastomerer giver anledning til larver, der udtrykker ektodermiske, mesodermiske og endodermiske celleskæbner, hvilket viser, at disse cellers skæbne kan reguleres. Isolerede mikromerer (primær mesenchym) gennemgår det korrekte antal celledelinger og giver ALTID anledning til spicules efter planen. Således er mikromererne definitivt specificeret som forløbere for de skeletogene mesenchymceller, når de først optræder i 16-celle-stadiet. De vigtigste eksperimenter bestod i at sætte mikromere sammen med blastomerer fra dyrepolen og vise, at selv om mikromeres skæbne var “fastlagt eller bestemt” på det tidspunkt, hvor de blev født, var mikromere i stand til at “inducere” nye celleskæbner i blastomerer fra dyrepolen. Mikromererne var i stand til at fremkalde endodermisk og mesodermisk skæbne i blastomererne fra dyrepolen! Det sene eksperiment i “C” viser således, at når man tilføjer mikromerer til en dyrehalvblastula, kan man nu inducere dannelsen af en genkendelig larve, der udtrykker endodermiske, mesodermiske og ektodermiske skæbner.
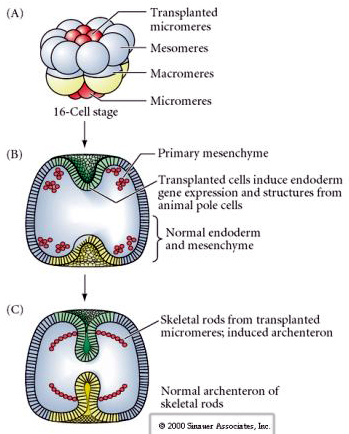 Det sidste sæt eksperimenter viser, at selv i et normalt embryo kan man, hvis man transplanterer mikromerer til dyrehalvblastulaen, inducere et sekundært archenteron og ændre den normale aksiale mønsterdannelse. Dette argumenterer igen for, at mikromererne får en cytoplasmatisk derminant, der specificerer deres celleskæbne, og at de leverer det induktive signal, der mønstrer de aksiale strukturer i søpungens embryo. Mikromeres skæbne kan ikke ændres, men signaler fra mikromererne kan ændre skæbnen for alle de andre blastomerer.
Det sidste sæt eksperimenter viser, at selv i et normalt embryo kan man, hvis man transplanterer mikromerer til dyrehalvblastulaen, inducere et sekundært archenteron og ændre den normale aksiale mønsterdannelse. Dette argumenterer igen for, at mikromererne får en cytoplasmatisk derminant, der specificerer deres celleskæbne, og at de leverer det induktive signal, der mønstrer de aksiale strukturer i søpungens embryo. Mikromeres skæbne kan ikke ændres, men signaler fra mikromererne kan ændre skæbnen for alle de andre blastomerer.
Horstadius: (1928, 1935) viste eksperimentelt, at i et embryo med 16 cellestadium vil alle lag af blastomerer undtagen mikromererne antage forskellige skæbner, når de transplanteres til forskellige positioner i chimære embryoner. Archenteronet vil udvikle sig fra veg 1-blastomerer, hvis veg 2-cellerne fjernes, og mikromererne placeres i kontakt med veg 1-laget. I mangel af mikromerer giver veg 2-blastomerer anledning til archenteron og skeletstrukturer. Klassisk har man påberåbt sig en duel dyr-vegetal gradient for at forklare disse resultater. Disse resultater viser imidlertid kun, at afgørende induktive interaktioner forekommer mellem tilstødende blastomerlag.
Implanterede individuelle mikromerer nær dyrepolen hæmmer den apikale tuftdannelse og inducerer i nogle tilfælde en ny embryonal akse. Veg 2-blastomerer vil også inducere ændringer svarende til mikromerer, når de transplanteres ved siden af blastomerer fra dyrepolen.
GENERALE RESULTATER AF TRANSPLANTATIONER: Det viser sig altid, at skæbnen for givne blastomerer påvirkes af appositionen af forskellige naboceller, der støder op til dem i normale embryoner.
HYPOTESER: Lokaliserede maternelle cytoplasmatiske determinanter specificerer visse celler i det normale embryo, navnlig mikromererne og archenteronforløberne nær den vegetale pol. Disse celler bestemmer så induktivt skæbnen for naboblastomererne, som på deres side interagerer med deres naboer. Mange af blastomererne bevarer andre potentialer end dem, de normalt udtrykker, og i nogen tid er disse blastomerer kun reversibelt specificeret, hvilket er nødvendigt for et udviklingssystem, der i høj grad er afhængigt af induktion.