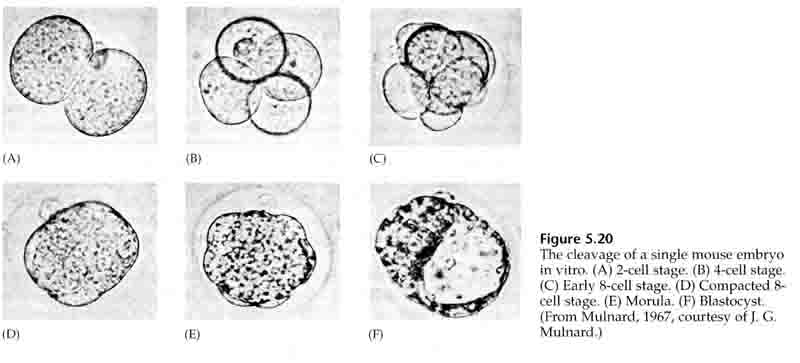
El clivaje se refiere al patrón estereotipado de las primeras divisiones mitóticas que dividen el citoplasma del huevo de gran volumen. El cigoto temprano es único por ser tan grande. La mayoría de las células pasan por un periodo de crecimiento entre los ciclos de mitosis, pero esto no ocurre con los blastómeros del estadio de clivaje temprano. Con cada división las células se hacen más pequeñas. Este rápido patrón de división celular sin crecimiento concomitante se detiene bruscamente en la etapa llamada transición de la blástula media, en la que el núcleo cigótico toma el control del ciclo celular.
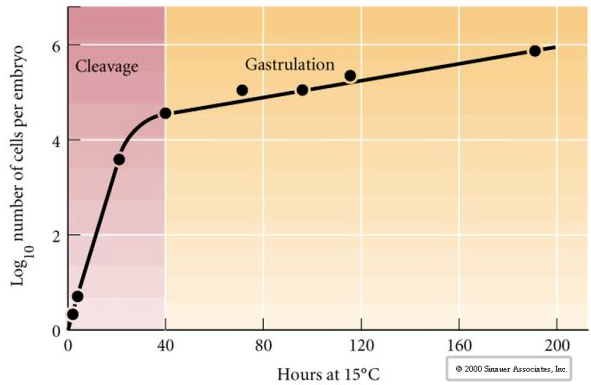 Hay algunas pruebas de que un factor materno, quizás un regulador transcripcional, es responsable de este rápido patrón temprano de divisiones de escisión. Alterando artificialmente la relación entre el ADN citoplásmico y el nuclear se puede cambiar el momento de la transición de la midblástula. La transición de la mitad de la blástula se refiere al momento en que se produce el cambio principal de la expresión de los genes maternos a los cigóticos.
Hay algunas pruebas de que un factor materno, quizás un regulador transcripcional, es responsable de este rápido patrón temprano de divisiones de escisión. Alterando artificialmente la relación entre el ADN citoplásmico y el nuclear se puede cambiar el momento de la transición de la midblástula. La transición de la mitad de la blástula se refiere al momento en que se produce el cambio principal de la expresión de los genes maternos a los cigóticos.
La fecundación en algunas especies da lugar a movimientos citoplásmicos radicales que son esenciales para asegurar que los determinantes citoplásmicos se sitúen en las posiciones correctas en relación con los eventos de escisión posteriores.
PATRONES DE ESCLUSIÓN EMBRIONARIA
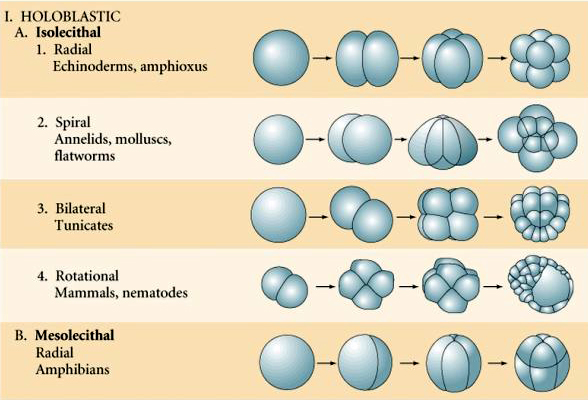
El patrón de escisión embrionaria está determinado tanto por la posición de los husos mitóticos como por la cantidad y distribución del vitelo. El vitelo tiende a inhibir la escisión. La ralentiza o incluso impide la escisión completa. El vitelo es una adaptación de aquellos animales que pasan más o menos por la embriogénesis aislados de cualquier suministro de alimentos. Algunos animales, como el erizo de mar, tienen relativamente poca yema porque se desarrollan rápidamente en una forma larvaria de natación libre que adquiere los nutrientes de su entorno. Otros animales, como los marsupiales, nacen prematuramente, pero se nutren en una bolsa parental. Los mamíferos placentarios desarrollan un órgano especializado a través del cual el embrión se nutre durante todo el desarrollo, por lo que también tienen poca yema.
Los tipos de huevos basados en las características de la yema se describen como:
Isolecitales: yema escasa distribuida uniformemente, p. ej., erizo de mar, ratón
Mesolecthal: cantidad moderada de yema, a menudo distribuida irregularmente, p. ej, rana
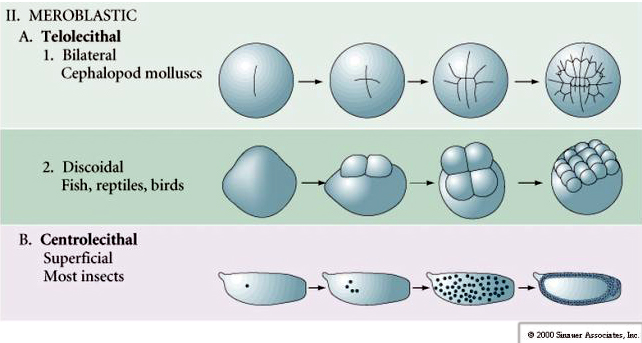
Telolecitario: yema densa concentrada en un extremo, p. ej., ave, reptil
Centrolecitario: yema concentrada en el centro del huevo, p. ej., mosca
Muchos huevos están polarizados con un polo rico en yema, denominado polo vegetal y un polo pobre en yema denominado polo animal, p. ej., rana. El núcleo cigótico está generalmente desplazado hacia el polo animal. Los cigotos con relativamente poco vitelo (isolecitales y mesolecitales) se escinden HOLOBLASTICAMENTE. El surco de clivaje se extiende a lo largo de todo el huevo. Mientras que los cigotos telolecitales y centrolecitales sufren una escisión MEROBLÁSTICA en la que el plano de escisión se extiende sólo hasta la yema acumulada. En los huevos centrolecitarios (muchos huevos de insectos) el clivaje es meroblástico y superficial, mientras que en los huevos telolecitarios (aves y peces) el clivaje es discoidal
Hay varios tipos de simetría de clivaje que se observan en la naturaleza: radial (equinodermos, anfibios), espiral (moluscos, anélidos), bilateral (ascidias, tunicados), rotacional (mamíferos). Las dos figuras siguientes muestran ejemplos de simetrías de clivaje holoblástico y meroblástico.
Clivaje holoblástico radial
Excelente película del clivaje del erizo de mar de «A Dozen Eggs» de Rachel Fink.
Los erizos de mar también tienen escisión holoblástica radial, pero con algunas diferencias interesantes. El primer clivaje es meridional. El segundo clivaje es meridional. La tercera división es ecuatorial La cuarta división es meridional, pero mientras las cuatro células del polo animal se dividen por igual para dar lugar a ocho blastómeros animales de igual tamaño denominados MESÓMEROS, las células vegetales se dividen asimétricamente a lo largo del plano ecuatorial para dar lugar a 4 grandes MACÓMEROS y 4 MICÓMEROS mucho más pequeños en el polo vegetal. En la quinta división, las MESOMERAS se dividen ecuatorialmente para dar dos niveles de ocho MESOMERAS an1 y an2, las MACROMERAS se dividen meridionalmente formando un nivel de ocho células por debajo de an2, las MICROMERAS se dividen para dar un grupo de células por debajo de la capa veg1. Las sextas divisiones son todas ecuatoriales, dando una capa veg2. Las séptimas divisiones son todas meridionales dando una blástula de 128 células.
¿Qué determina estos patrones de escisión? ¿Dependen de la división anterior y se reproducen como una cinta o están determinados por algún reloj intrínseco? En 1939 Horstadius inhibió uno o dos de los tres primeros clivajes y comprobó que la aparición de los micrómeros se producía en el momento adecuado independientemente del historial de clivajes
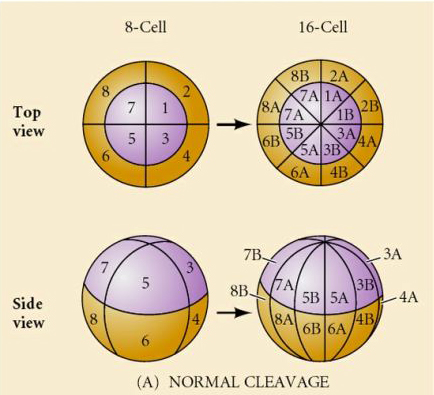
La conclusión de estos experimentos es que hay algún factor en el polo vegetal del óvulo que determina la formación de los micrómeros y, además, que debe existir un reloj molecular que comienza en la activación del óvulo. El reloj es independiente del acontecimiento real de escisión.
La blástula de 128 células es una bola bastante suelta de células que rodean una blastocélula hueca. La bola tiene una capa celular de espesor y todas las células están en contacto con la capa hialina externa y el líquido interno de la blastocélula. En esta fase del desarrollo, las células comienzan a formar las uniones estrechas características de un epitelio. La blastocélula central está ahora aislada del entorno externo. Los blastómeros continúan dividiéndose con su eje paralelo a la capa hialina, quedando un epitelio de una célula de espesor. La blastocélula continúa agrandándose.
Dos teorías intentan explicar el patrón de agrandamiento del blastocisto
1. La teoría osmótica sugiere que los blastómeros segregan iones y proteínas en el blastocele, lo que da lugar a un aumento de la presión debido al flujo osmótico de agua. Esta presión sería entonces la responsable de alinear el eje de mitosis de los blastómeros y del agrandamiento de la blastocélula.
2. La teoría alternativa de Wolpert y sus colegas sugiere que son realmente las interacciones adhesivas entre los blastómeros y entre los blastómeros y la capa hialina las que alinean los ejes mitóticos. Es decir, la adhesión a la hialina es mayor, la adhesión a otros blastómeros es la siguiente, y finalmente la interacción con la pared de la blastocélula es menor. La adhesión dominante con la capa hialina obliga a la expansión del blastocisto y de la blastocélula.
Las células de la blástula desarrollan cilios en su superficie externa, secretan una enzima de eclosión (hialinasa) y se convierten en nadadores libres.
Cleavage de los anfibios
El cleavage en muchos anfibios es holoblástico con simetría radial, sin embargo el gran volumen de vitelo (su mesolecitario) interfiere con el cleavage. En el polo animal la primera escisión procede a cerca de 1mm/min, mientras que en el polo vegetal procede 50-100 veces más lento (.02mm/min). Mientras el primer clivaje está todavía incompleto en la región vegetal yolky del huevo, comienza a producirse el segundo clivaje meridional.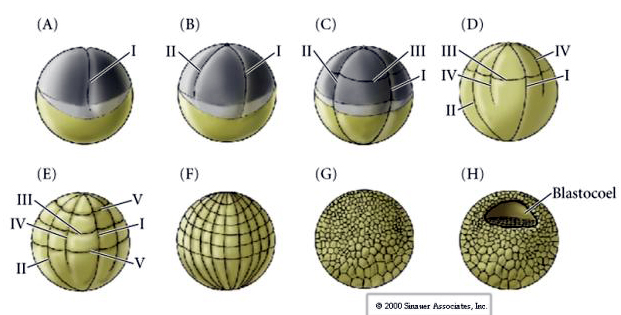
El tercer clivaje es ecuatorial, pero debido a que los núcleos y los ásteres están desplazados hacia el animal, el plano de clivaje, aunque perpendicular al eje vegetal animal, también está desplazado hacia el polo animal y no divide por igual los blastómeros. El resultado son cuatro blastómeros animales más pequeños (denominados MICROMERAS) y cuatro blastómeros de polo vegetal grandes (denominados MACROMERAS). Esta división holoblástica desigual da lugar a un polo animal que se divide más rápidamente y que está formado por micromeros más pequeños y a un polo vegetal que se divide más lentamente y que está formado por macromeros. El polo animal pronto se compone de muchos micromeros pequeños y el polo vegetal de unos pocos macromeros grandes llenos de vitelo. Aunque la formación de la blastocélula comienza con la primera división, no se hace evidente hasta el estadio de 128 células.
¿Qué función cumple la blastocélula?
La blastocélula separa espacialmente las células para que no se toquen entre sí. Las células del techo de la blastocélula normalmente se convierten en ectodermo. Si se trasplantan células del techo de la blastocélula junto a las células yólicas de la base de la blastocélula se diferenciarán como mesodermo. Los derivados mesodérmicos se producen normalmente a partir de células adyacentes a los precursores endodérmicos. Una posibilidad que exploraremos a fondo es que las células vegetales induzcan mediante interacciones célula-célula a las células adyacentes a convertirse en mesodérmicas. Así, la formación de la blastocélula puede ser necesaria para evitar interacciones «inductoras» inapropiadas entre las células tempranas del blastocisto. La segunda necesidad obvia de la blastocélula puede darse durante la etapa posterior del desarrollo, la GASTRULACIÓN, en la que las células migran al interior de la blastocélula.
CLAVADO DE LOS MAMÍFEROS
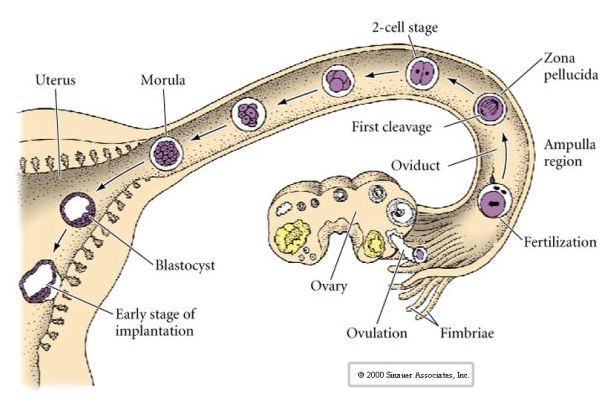
El óvulo de los mamíferos es liberado del ovario al oviducto donde es fecundado. La primera escisión comienza aproximadamente un día después de la fecundación dentro del oviducto. En claro contraste con la mayoría de los animales, la escisión en los mamíferos puede ser muy lenta: 1/día.
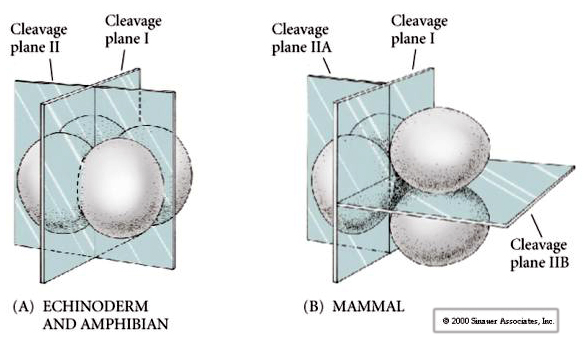 Además, los planos de escisión son algo diferentes a los de otros animales. La primera división es meridional al igual que el erizo de mar y la rana. Sin embargo, en la segunda división del clivaje uno de los blastómeros se divide meridionalmente y el otro ecuatorialmente. Este tipo de división se llama CLASIFICACION HOLOBLASTICA ROTACIONAL.
Además, los planos de escisión son algo diferentes a los de otros animales. La primera división es meridional al igual que el erizo de mar y la rana. Sin embargo, en la segunda división del clivaje uno de los blastómeros se divide meridionalmente y el otro ecuatorialmente. Este tipo de división se llama CLASIFICACION HOLOBLASTICA ROTACIONAL.
Otra característica única de la división de los mamíferos es que las divisiones de los blastómeros son asincrónicas. (comparado con la sincronía del erizo de mar y la rana hasta la transición de la mitad de la blástula). El clivaje del embrión de mamífero está regulado por el núcleo ziótico desde el principio.
Hasta el tercer clivaje los blastómeros forman una bola de células vagamente asociadas al igual que los otros animales que hemos estudiado. Antes de la cuarta división, las células de la blástula cambian drásticamente su comportamiento entre ellas. Rápidamente intentan maximizar sus contactos con los otros blastómeros y al hacerlo hacen que la blástula se compacte.

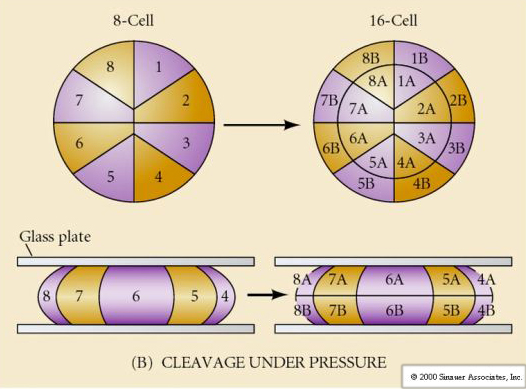
Esta COMPACTACIÓN resulta en parte de la producción de una nueva molécula de adhesión UVOMORULINA (E-Cadherina) y es estabilizada por la formación de uniones estrechas entre las células externas que como en el erizo de mar sella el interior de la blástula del exterior. Las células también forman uniones entre ellas que permiten el paso de pequeñas moléculas, como iones y algunas moléculas de segundo mensajero como Ca++ y C-AMP. La mórula compactada de 16 células está formada por una corteza exterior de células y unas pocas células (1-2) completamente internas. La mayoría de las células externas dan lugar a las Células TROBLÁSTICAS O TROFECTODERMALES. Estas células no contribuyen al embrión propiamente dicho, sino que son necesarias para la implantación del embrión en la pared uterina y forman los tejidos del CORIANO, un componente esencial de la placenta del que hablaremos más adelante.
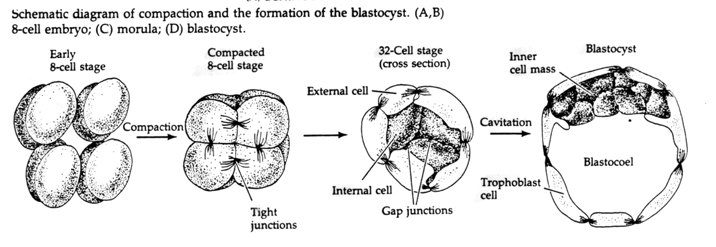
Las células del embrión derivan de las pocas células internas de la blástula en fase de 16 células. Estas células generan la masa celular interna a partir de la cual se desarrolla todo el embrión. En el sexto clivaje, el estadio de 64 células, la masa celular interna y la capa trofoblástica están completamente separadas. Los trofoblastos secretan líquido internamente para crear la blastocélula. El embrión se llama ahora blastocisto.
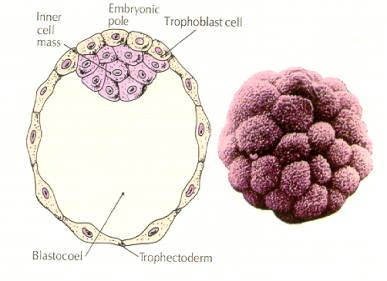 FORMACIÓN DE LA MASA CELULAR INTERNA
FORMACIÓN DE LA MASA CELULAR INTERNA
¿Cómo se crean estas células de la masa celular interna? ¿Hay ciertos blastómeros destinados por factores intrínsecos a convertirse en progenitores de la masa celular interna? La respuesta parece ser no. Todos los blastómeros tempranos parecen ser totipotentes y la determinación de qué células contribuirán a la capa trofoblástica y cuáles a la masa celular interna es simplemente una cuestión de posición de azar. Las células de un embrión en fase de 4 células, que normalmente dan lugar tanto a la masa celular interna como a las células del trofectodermo, trasplantadas al exterior de un embrión en fase de 32 células sólo dan lugar al trofectodermo. No contribuyen al embrión propiamente dicho. Recuerde de la conferencia anterior sobre la clonación que la fusión de dos embriones de ratón en fase de 8 células da lugar a un embrión normal, lo que sugiere que todas las células en esa fase son totipotentes.
Limpieza meroblástica
En los óvulos telolecitarios y centrolecitarios la gran densidad del vitelo impide la división. Los huevos telolecitales son característicos de las aves, los peces y los reptiles, mientras que los huevos centrolecitales son característicos de los insectos. Los huevos telolecitarios dan lugar a una escisión discoidal meroblástica. La división se limita al blastodisco en el polo animal del huevo. En las primeras escisiones, debido a que la escisión no puede proceder a través del vitelo, los blastómeros son continuos en sus márgenes vegetales.
Esta película del desarrollo del pez cebra porRolf Karlstrom es excelente. (Película de Paul Myers)
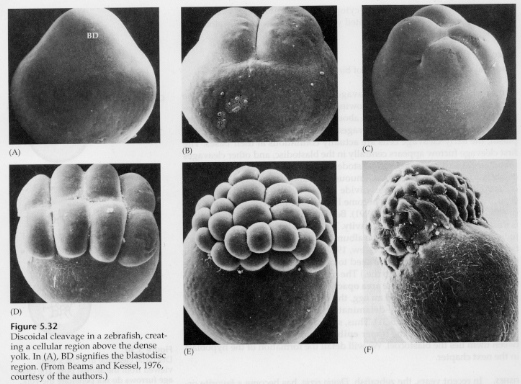 No es hasta las escisiones ecuatoriales que las células del blastodermo se separan del vitelo. Otras escisiones ecuatoriales crean un blastodermo multicapa de tres o cuatro células de grosor.
No es hasta las escisiones ecuatoriales que las células del blastodermo se separan del vitelo. Otras escisiones ecuatoriales crean un blastodermo multicapa de tres o cuatro células de grosor.
En las aves se forma un espacio entre el blastodermo y el vitelo llamado cavidad SUBGERMINAL. En la división 16 (60.000 células) las células del blastodermo migran a la cavidad subgerminal para formar una segunda capa. Las dos capas se denominan EPIBLAST exterior e HYPOBLAST interior con la blastocélula entre ellas. Estudiaremos esto con más detalle más adelante cuando hablemos de la gastrulación de las aves y los mamíferos
Los huevos centrolecitales de los artrópodos sufren una CLEAVACIÓN SUPERFICIAL. La gran masa central de vitelo confina los clivajes al borde citoplasmático del huevo.
Una variación interesante e informativa se observa en los insectos. Los núcleos cigóticos se dividen sin clivaje. Es decir, los núcleos experimentan la cariocinesis -la división mitótica del núcleo- sin la citocinesis -la división de la célula-. Estos núcleos desnudos se denominan ENERGIDOS. Los núcleos se dividen a una velocidad asombrosa – cada 8 minutos (toda la embriogénesis dura sólo 22 horas).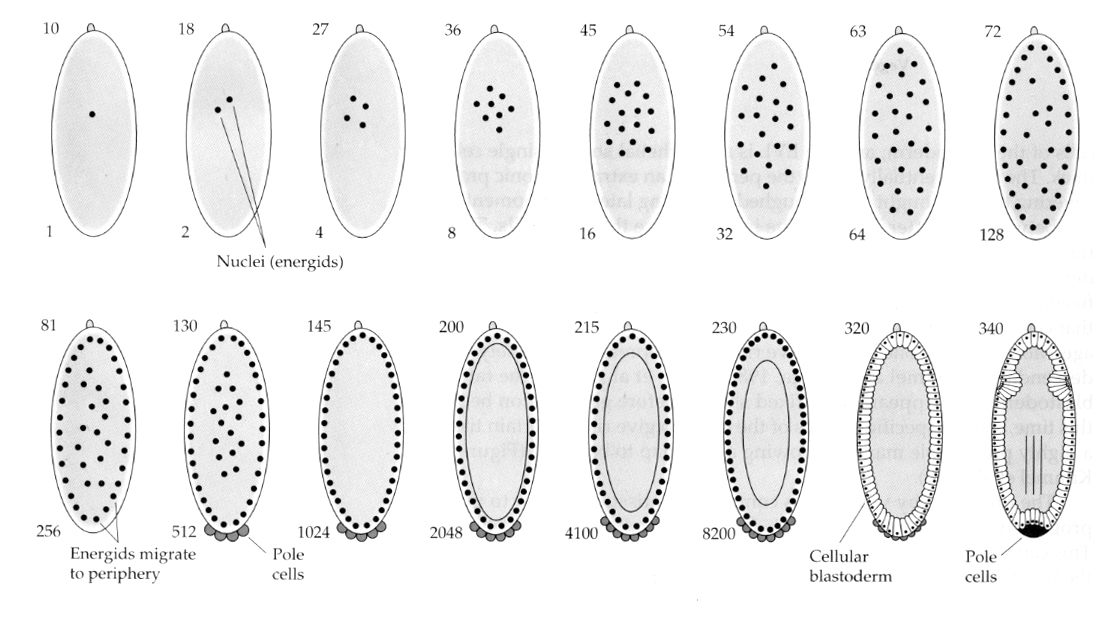
 Después de varias rondas de cariocinesis los núcleos desnudos migran a la periferia del huevo. En esta etapa se denomina BLASTODIA SINCITIAL porque todos los núcleos comparten el mismo citoplasma. La celularización se produce alrededor de la 14ª división nuclear para crear el BLASTODERMO CELULAR. Después de este momento las células se dividen de forma asíncrona. Esto corresponde a la transición de la blástula media de las ranas y los erizos de mar. (transición de la expresión génica materna a la principalmente cigótica) Recordemos que se pensaba que la transición de la midblástula se desencadenaba por la relación entre la cromatina y el citoplasma. Las pruebas de este mecanismo en las moscas se observan al examinar los embriones haploides mutantes. Estos embriones experimentan la transición de la blástula media y la celularización una división más tarde 15. Además, se puede acelerar la celularización ligando el huevo y reduciendo el volumen de citoplasma. Aunque el estadio de blastodermo sincitial sugiere que todos los núcleos son equipotentes en el sentido de que no parecen existir barreras difusoras de los determinantes citoplasmáticos, en realidad el citoplasma está muy regionalizado y los núcleos tienen dominios citoplasmáticos muy organizados a su alrededor.
Después de varias rondas de cariocinesis los núcleos desnudos migran a la periferia del huevo. En esta etapa se denomina BLASTODIA SINCITIAL porque todos los núcleos comparten el mismo citoplasma. La celularización se produce alrededor de la 14ª división nuclear para crear el BLASTODERMO CELULAR. Después de este momento las células se dividen de forma asíncrona. Esto corresponde a la transición de la blástula media de las ranas y los erizos de mar. (transición de la expresión génica materna a la principalmente cigótica) Recordemos que se pensaba que la transición de la midblástula se desencadenaba por la relación entre la cromatina y el citoplasma. Las pruebas de este mecanismo en las moscas se observan al examinar los embriones haploides mutantes. Estos embriones experimentan la transición de la blástula media y la celularización una división más tarde 15. Además, se puede acelerar la celularización ligando el huevo y reduciendo el volumen de citoplasma. Aunque el estadio de blastodermo sincitial sugiere que todos los núcleos son equipotentes en el sentido de que no parecen existir barreras difusoras de los determinantes citoplasmáticos, en realidad el citoplasma está muy regionalizado y los núcleos tienen dominios citoplasmáticos muy organizados a su alrededor.
MECANISMOS DE CLARIFICACIÓN
Ciclo celular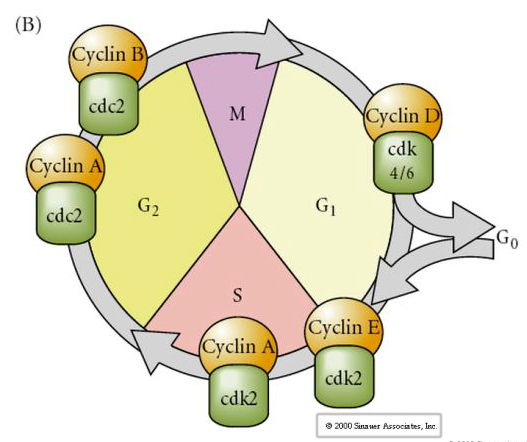
M-mitosis
G1- brecha de prerreplicación
S- síntesis de ADN
G2- brecha premitótica
En los embriones en fase de clivaje, como las ranas y las moscas, los blastómeros pasan directamente de M a S sin que intervengan las fases G1 o G2. Después de la transición de la blástula media, las células de ambos animales tienen un G1 y un G2. Los elegantes experimentos de trasplante han demostrado que es el citoplasma el que regula tanto la cariocinesis como la citocinesis. Si los núcleos de las células en división se trasplantan a los ovocitos, dejan de dividirse inmediatamente.
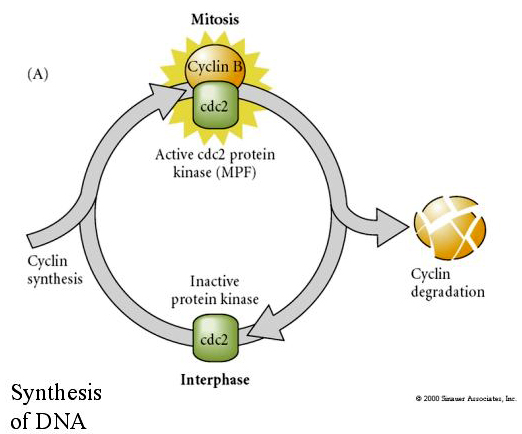 A la inversa, si los núcleos de las células que no se dividen se colocan en los ovocitos enucleados fecundados, comienzan a dividirse. Los óvulos enucleados activados artificialmente sin centríolos sufrirán contracciones corticales que recuerdan a la escisión. Se han identificado algunos de los factores citoplasmáticos que regulan la división celular en el embrión temprano.
A la inversa, si los núcleos de las células que no se dividen se colocan en los ovocitos enucleados fecundados, comienzan a dividirse. Los óvulos enucleados activados artificialmente sin centríolos sufrirán contracciones corticales que recuerdan a la escisión. Se han identificado algunos de los factores citoplasmáticos que regulan la división celular en el embrión temprano.
El FACTOR CITOSTÁTICO (CSF) se eleva después de la primera división meiótica y detiene al ovocito en la segunda metafase meiótica. Al producirse la fecundación, el Ca inactiva el CSF, la meiosis se completa y los pronúcleos se fusionan.
El FACTOR PROMOTOR DE LA MITOSIS (MPF) hace que las células entren en la fase M. La activación del MPF provoca: 1. condensación de cromosomas por fosforilación de histonas H1, 2. ruptura de la envoltura nuclear por hiperfosforilación de 3 láminas nucleares, 3. inhibición de la ARN polimerasa para detener la transcripción, 4. fosforilación de la subunidad reguladora de la miosina para inhibir la citocinesis.
Modelo sugerido para la regulación cíclica del ciclo celular durante las etapas de clivaje de la embriogénesis. MPF induce a la célula a pasar de S a M. CSF se une a MPF e impide su inactivación. La célula permanece en M. El Ca aumenta y provoca la inactivación del CSF, lo que a su vez lleva a la inactivación del MPF y la célula pasa de M a S y el ciclo se repite. El MPF está formado por dos subunidades, la ciclina B y la cdc2. Es la ciclina B la que experimenta una síntesis y degradación específica del ciclo celular regulada por el núcleo celular para controlar el ciclo celular en las células somáticas normales. Sin embargo, durante la oogénesis el óvulo está cargado de «reguladores» de ciclina B y de ARNm de ciclina B, de modo que su síntesis está regulada por factores maternos independientes del núcleo cigótico. Así, no es hasta que se «agotan» los componentes maternos que el núcleo cigótico toma el relevo y vuelve un ciclo celular normal (M, G1, S, G2).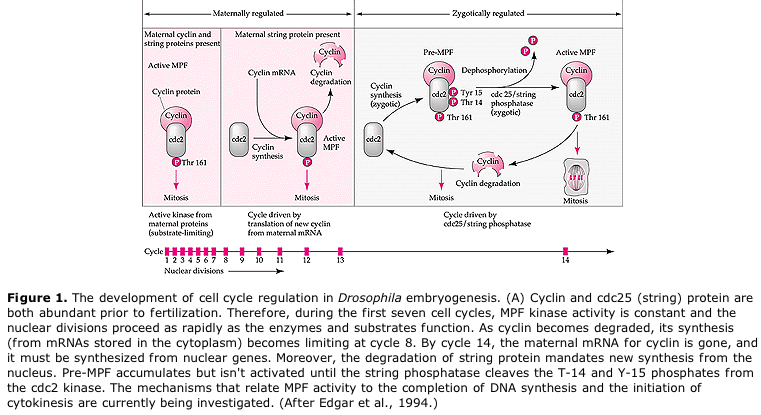
Determinación del destino celular
Localización citoplasmática de los DETERMINANTES como mecanismo general y básico para el patterning temprano (Ejemplos Tunicado y Erizo de mar). Una cuestión importante de la biología del desarrollo es cuándo y cómo se determinan los destinos celulares durante el desarrollo. Esto está íntimamente relacionado con la cuestión de cómo se produce la formación de patrones durante el desarrollo. El embrión no sólo debe generar el número y el tipo adecuados de células diferenciadas, sino que éstas deben organizarse de la manera correcta en relación con todas las demás células del embrión para formar un animal funcional. Examinaremos dos posibilidades de determinación del destino celular y de formación de patrones: 1. El destino de las células podría estar determinado por factores intrínsecos introducidos en el óvulo durante la oogénesis y luego repartidos en blastómeros específicos durante el clivaje, 2. Las señales extrínsecas proporcionadas por el entorno del embrión podrían proporcionar la información sobre el patrón para regular el destino de las células. Como veremos, la mayoría de los organismos complejos utilizan una combinación de señales intrínsecas y extrínsecas para regular el destino celular y la formación del patrón embrionario.
La especificación autónoma del destino celular mediante determinantes citoplasmáticos sugiere que el destino de una célula depende totalmente de su linaje, mientras que el desarrollo «regulador» sugiere que el destino de una célula está determinado por señales externas de otras células. Estos dos mecanismos de especificación celular pueden distinguirse experimentalmente mediante experimentos de aislamiento, ablación y trasplante. Si una blástula aislada de un embrión se diferencia normalmente (como si siguiera en su posición normal en el embrión) podemos decir que debe tener determinantes intrínsecos que especifican su destino. Sin embargo, si se diferencia de forma anormal, podemos decir que su destino celular depende de señales externas. Si ablacionamos un blastómero de un embrión y el embrión se desarrolla de forma anormal, perdiendo todos los destinos celulares que normalmente surgen del blastómero ablacionado, decimos que el desarrollo es autónomo de las células y está intrínsecamente especificado. Sin embargo, si el embrión se desarrolla normalmente, decimos que los blastómeros restantes pueden regular su destino celular para compensar las células que faltan. Si una célula trasplantada mantiene su destino celular basado en su posición original entonces decimos que su destino ha sido determinado, si adopta un nuevo destino basado en su nueva posición trasplantada decimos que su destino está regulado por señales externas de las células cercanas.
LOCALIZACIÓN Y REGULACIÓN CITOPLÁSMICA EN EL HUEVO TÚNICO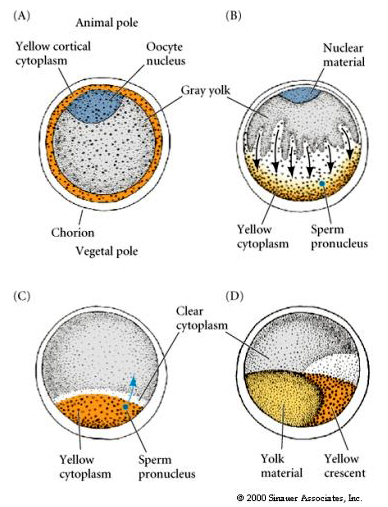
Al final de la oogénesis el huevo túnico tiene un polo animal y vegetal claramente diferenciados. Hay un citoplasma cortical amarillo que rodea un citoplasma interno gris yolky. El núcleo del ovocito está desplazado hacia el polo animal. La entrada del esperma en el hemisferio vegetal fecunda el óvulo e inicia el desarrollo. Después de la fecundación se produce una dramática reorganización del citoplasma del óvulo que da lugar a citoplasmas coloreados por regiones que parecen correlacionarse con los subsiguientes destinos de los blastómeros.
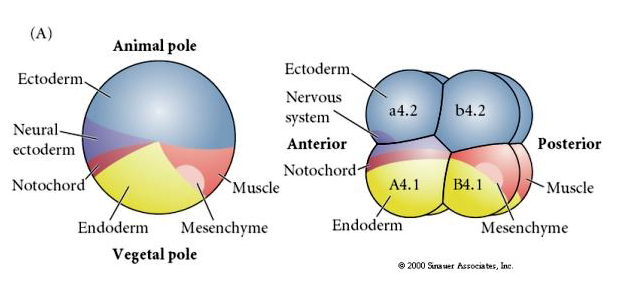 Nótese que el mapa de destinos se correlaciona con los diferentes citoplasmas coloreados del embrión tunicado. No se confunda por los diferentes colores en dos figuras. El citoplasma amarillo «naranja» se correlaciona con los destinos musculares y el citoplasma Yolky (amarillo) se correlaciona con los destinos endodérmicos. El citoplasma gris (blanco o púrpura azulado) por encima de la media luna amarilla se correlaciona con el ectodermo neural.
Nótese que el mapa de destinos se correlaciona con los diferentes citoplasmas coloreados del embrión tunicado. No se confunda por los diferentes colores en dos figuras. El citoplasma amarillo «naranja» se correlaciona con los destinos musculares y el citoplasma Yolky (amarillo) se correlaciona con los destinos endodérmicos. El citoplasma gris (blanco o púrpura azulado) por encima de la media luna amarilla se correlaciona con el ectodermo neural.
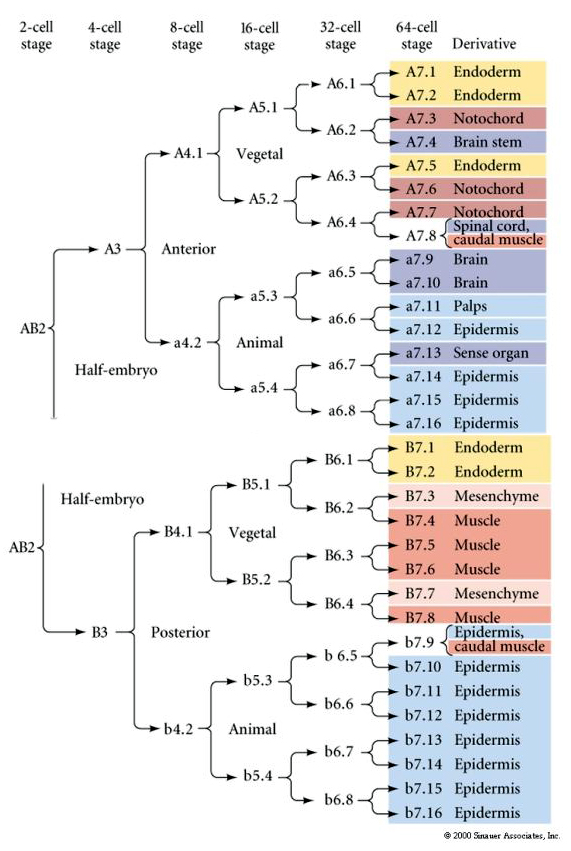 Este mapa de linaje muestra la correlación de linaje invariante con blastómeros parcelados citoplasmas de colores particulares por los clivajes celulares invariantes. Sin embargo, los clivajes y linajes invariantes no prueban necesariamente la especificación celular autónoma por determinantes citoplasmáticos.
Este mapa de linaje muestra la correlación de linaje invariante con blastómeros parcelados citoplasmas de colores particulares por los clivajes celulares invariantes. Sin embargo, los clivajes y linajes invariantes no prueban necesariamente la especificación celular autónoma por determinantes citoplasmáticos.
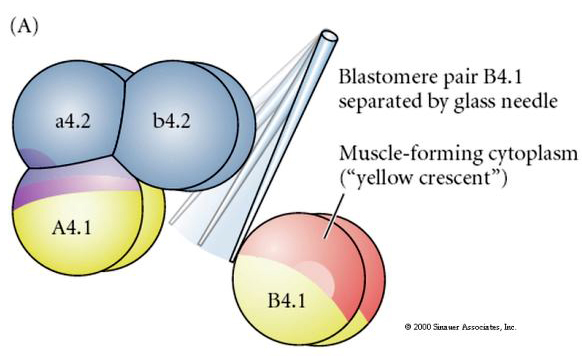 Se requieren manipulaciones experimentales para probar la determinación regulativa frente a la autónoma del destino celular. Los experimentos clásicos de aislamiento que se muestran en las tres figuras siguientes intentan demostrar que el destino celular está determinado por determinantes citoplasmáticos que adquieren a través de escisiones estereotipadas. Se utiliza una aguja de vidrio para separar el par de blastómeros B4.1 del resto del embrión. Los blastómeros B4.1 adquieren normalmente el citoplasma amarillo crecente correlacionado con el destino de las células musculares.
Se requieren manipulaciones experimentales para probar la determinación regulativa frente a la autónoma del destino celular. Los experimentos clásicos de aislamiento que se muestran en las tres figuras siguientes intentan demostrar que el destino celular está determinado por determinantes citoplasmáticos que adquieren a través de escisiones estereotipadas. Se utiliza una aguja de vidrio para separar el par de blastómeros B4.1 del resto del embrión. Los blastómeros B4.1 adquieren normalmente el citoplasma amarillo crecente correlacionado con el destino de las células musculares.
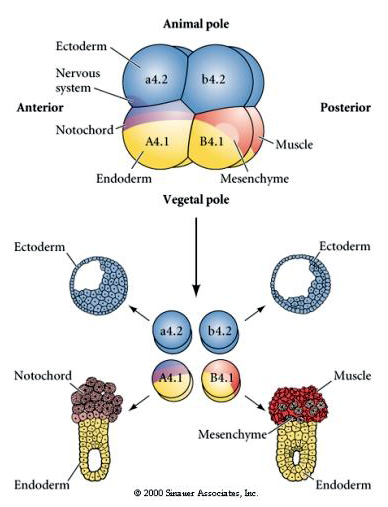
Aquí podemos ver los resultados de los experimentos de aislamiento. En cada caso, los blastómeros aislados dan lugar sólo al subconjunto de destinos celulares que normalmente producirían en el embrión intacto. Los blastómeros aislados no regulan su destino para compensar a sus vecinos ausentes. Los blastómeros del polo animal, a4.2 y b4.2, dan lugar únicamente a células ectodérmicas. El A4.1 da lugar a células de la notocorda y endodérmicas, mientras que el B4.1 da lugar a células musculares y endodérmicas. Ninguno de los blastómeros aislados puede dar lugar a todos los componentes celulares de un embrión normal.
En el siguiente experimento se utiliza una aguja para manipular el plano de clivaje ecuatorial de forma que sea más vegetal de lo normal y ahora los blastómeros del polo animal, b4.2, adquieren parte del citoplasma de la «media luna amarilla». Cuando estos blastómeros se aíslan, dan lugar a algunas células musculares. Esto demuestra muy bien que el citoplasma de la «media luna amarilla» puede determinar el destino de las células musculares y puede hacerlo de manera autónoma.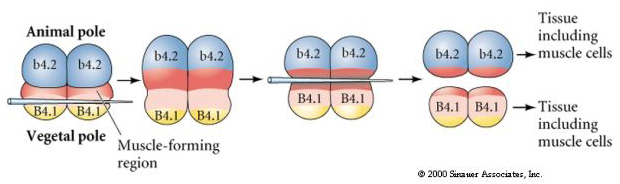
LOCALIZACIÓN Y REGULACIÓN EN EL HUEVO DE URCHINA DE MAR
Un canal gelatinoso define la localización del polo animal y refleja la polaridad temprana del huevo. El patrón temprano de clivaje no depende del sitio de entrada del esperma, sino que está determinado por la polaridad/asimetría intrínseca del óvulo. Boveri (1901) describió una banda subecuatorial de pigmento dispuesta ortogonalmente al eje animal-vegetal. Estos gránulos también indicaban la localización del citoplasma que posteriormente se incluye en las células del arquenterón. Horstadius (1928) separó los blastómeros animal y vegetal y demostró que sólo el blastómero vegetal daría lugar a micrómero, gastrularía y formaría el esqueleto. Su conclusión fue que los factores citoplasmáticos localizados en la mitad vegetal son necesarios para los micromeros, la gastrulación y la formación del arquenteron, y la formación del esqueleto. Recuerda el patrón de los primeros clivajes. Los micrómeros surgen durante el cuarto clivaje (etapa de 16 células) a partir de una división ecuatorial desigual de los blastómeros del polo vegetal.
Recuerda el patrón de los primeros clivajes. Los micrómeros surgen durante el cuarto clivaje (etapa de 16 células) a partir de una división ecuatorial desigual de los blastómeros del polo vegetal.
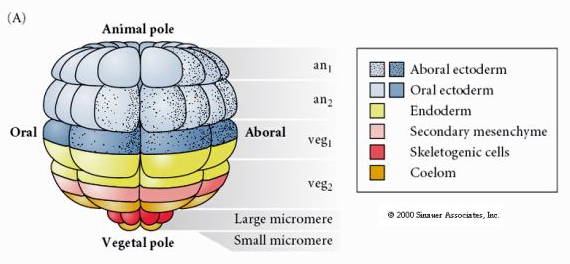 Esto muestra el mapa de destino de la blástula de erizo de mar en etapa de 64 células. Obsérvese que los micrómeros son las células primarias del mesénquima y dan lugar al esqueleto larvario (las espículas del estadio plúteo).
Esto muestra el mapa de destino de la blástula de erizo de mar en etapa de 64 células. Obsérvese que los micrómeros son las células primarias del mesénquima y dan lugar al esqueleto larvario (las espículas del estadio plúteo).
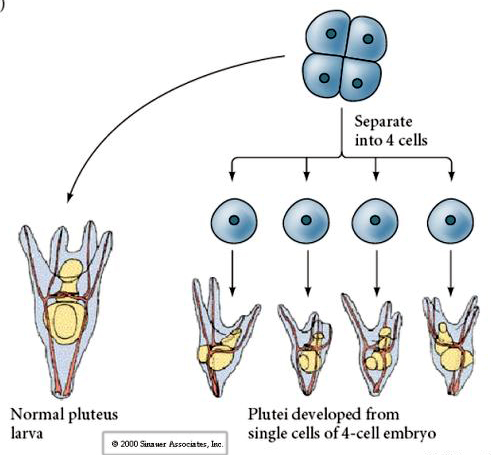 En el estadio de cuatro células, si los blastómeros están aislados unos de otros son capaces de «regular» su destino y dar lugar a 4 pequeñas larvas del estadio plúteo.
En el estadio de cuatro células, si los blastómeros están aislados unos de otros son capaces de «regular» su destino y dar lugar a 4 pequeñas larvas del estadio plúteo.
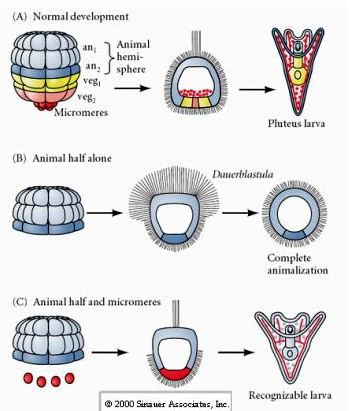 En cambio, en estadios posteriores, si se aíslan medios blastómeros animales, se encuentra que sólo producen una dauerblástula «animalizada» que no expresa ningún destino celular mesodérmico o endodérmico. Las medias blastómeras vegetales aisladas dan lugar a larvas que expresan destinos celulares ectodérmicos, mesodérmicos y endodérmicos, lo que demuestra que el destino de estas células puede ser regulado. Los microméros aislados (mesénquima primario) experimentan el número correcto de divisiones celulares y dan lugar SIEMPRE a espículas según lo previsto. Así, los microméros están definitivamente especificados como los precursores de las células del mesénquima esquelético cuando aparecen por primera vez en el estadio de 16 células. Los experimentos clave consistieron en juntar los micrómeros con los blastómeros del polo animal y demostrar que, aunque el destino de los micrómeros estaba «fijado o determinado» en el momento de su nacimiento, los micrómeros eran capaces de «inducir» nuevos destinos celulares en los blastómeros del polo animal. Los micrómeros fueron capaces de inducir destinos endodérmicos y mesodérmicos en los blastómeros del polo animal. Por lo tanto, el último experimento en «C» muestra que cuando se añaden micrómetros a una media blástula animal se puede inducir la formación de una larva reconocible que exprese destinos endodérmicos, mesodérmicos y ectodérmicos.
En cambio, en estadios posteriores, si se aíslan medios blastómeros animales, se encuentra que sólo producen una dauerblástula «animalizada» que no expresa ningún destino celular mesodérmico o endodérmico. Las medias blastómeras vegetales aisladas dan lugar a larvas que expresan destinos celulares ectodérmicos, mesodérmicos y endodérmicos, lo que demuestra que el destino de estas células puede ser regulado. Los microméros aislados (mesénquima primario) experimentan el número correcto de divisiones celulares y dan lugar SIEMPRE a espículas según lo previsto. Así, los microméros están definitivamente especificados como los precursores de las células del mesénquima esquelético cuando aparecen por primera vez en el estadio de 16 células. Los experimentos clave consistieron en juntar los micrómeros con los blastómeros del polo animal y demostrar que, aunque el destino de los micrómeros estaba «fijado o determinado» en el momento de su nacimiento, los micrómeros eran capaces de «inducir» nuevos destinos celulares en los blastómeros del polo animal. Los micrómeros fueron capaces de inducir destinos endodérmicos y mesodérmicos en los blastómeros del polo animal. Por lo tanto, el último experimento en «C» muestra que cuando se añaden micrómetros a una media blástula animal se puede inducir la formación de una larva reconocible que exprese destinos endodérmicos, mesodérmicos y ectodérmicos.
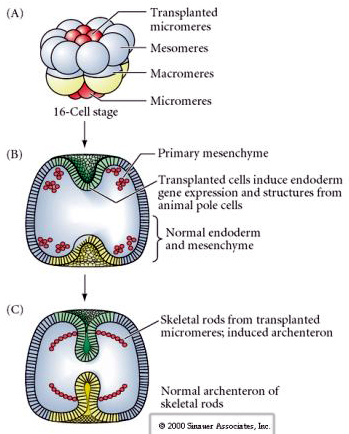 El conjunto final de experimentos demuestra que incluso en un embrión normal, si se trasplantan micrómetros a la tapa del polo animal se puede inducir un arquenteron secundario y alterar el patrón axial normal. Esto argumenta de nuevo que los micrómeros adquieren un derminante citoplasmático que especifica su destino celular y que proporcionan la señal inductora que modela las estructuras axiales del embrión de uchin. El destino de los micrómeros no puede ser alterado, pero las señales de los micrómeros pueden alterar el destino de todos los demás blastómeros.
El conjunto final de experimentos demuestra que incluso en un embrión normal, si se trasplantan micrómetros a la tapa del polo animal se puede inducir un arquenteron secundario y alterar el patrón axial normal. Esto argumenta de nuevo que los micrómeros adquieren un derminante citoplasmático que especifica su destino celular y que proporcionan la señal inductora que modela las estructuras axiales del embrión de uchin. El destino de los micrómeros no puede ser alterado, pero las señales de los micrómeros pueden alterar el destino de todos los demás blastómeros.
Horstadius (1928, 1935) demostró experimentalmente que en un embrión en fase de 16 células todos los niveles de blastómeros, excepto los micrómeros, adoptarán diferentes destinos cuando se trasplanten a diferentes posiciones en embriones quiméricos. El arquenteron se desarrollará a partir de los blastómeros de veg 1 si se eliminan las células de veg 2 y se colocan los micrómeros en contacto con la capa de veg 1. En ausencia de micrómero, los blastómeros veg 2 dan lugar al arquenteron y a las estructuras esqueléticas. Clásicamente, se ha invocado un gradiente animal-vegetal para explicar estos resultados. Sin embargo, estos resultados sólo indican que se producen interacciones inductoras decisivas entre niveles de blastómeros adyacentes.
Los micrómeros individuales implantados cerca del polo animal inhiben la formación del penacho apical y, en algunos casos, inducen un nuevo eje embrionario. Los blastómeros Veg 2 también inducirán cambios similares a los micrómeros cuando se trasplanten junto a los blastómeros del polo animal.
RESULTADO GENERAL DE LOS TRASPLANTES: el destino de determinados blastómeros siempre se ve afectado por la aposición de diferentes células vecinas que se adhieren a ellos en embriones normales.
HIPÓTESIS: Determinantes citoplasmáticos maternos localizados especifican ciertas células en el embrión normal, en particular los micrómeros y los precursores del arquenterón cerca del polo vegetal. Estas células determinan inductivamente el destino de los blastómeros vecinos, que interactúan a su vez con sus vecinos. Muchos de los blastómeros conservan potencialidades distintas de las que expresan normalmente, y durante algún tiempo estos blastómeros sólo se especifican de forma reversible, como requiere un sistema de desarrollo que depende en gran medida de la inducción.