Kleavage označuje stereotypní vzorec časných mitotických dělení, který rozděluje velký objem cytoplazmy vajíčka. Raná zygota je jedinečná tím, že je tak velká. Většina buněk prochází mezi cykly mitózy obdobím růstu, což však neplatí pro blastomery raného štěpného stadia. S každým dělením se buňky zmenšují. Tento rychlý průběh buněčného dělení bez současného růstu se náhle zastaví ve fázi zvané přechod do poloviny blastuly, kdy kontrolu nad buněčným cyklem přebírá zygotické jádro.
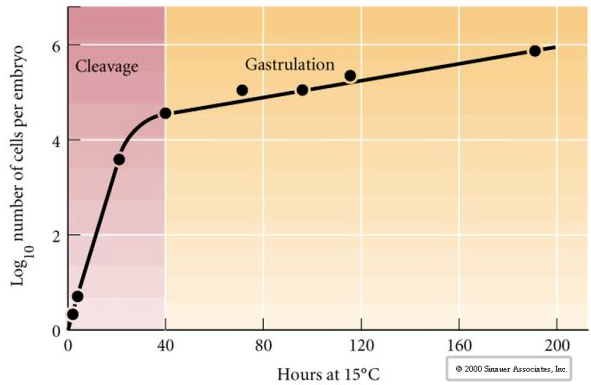 Existují určité důkazy, že za tento rychlý průběh dělení na počátku štěpení je zodpovědný mateřský faktor, možná transkripční regulátor. Umělou změnou poměru cytoplazmatické a jaderné DNA lze změnit dobu přechodu do střední fáze blastuly. Midblastula transition označuje dobu, kdy dochází k hlavnímu přechodu z exprese mateřských genů na zygotické.
Existují určité důkazy, že za tento rychlý průběh dělení na počátku štěpení je zodpovědný mateřský faktor, možná transkripční regulátor. Umělou změnou poměru cytoplazmatické a jaderné DNA lze změnit dobu přechodu do střední fáze blastuly. Midblastula transition označuje dobu, kdy dochází k hlavnímu přechodu z exprese mateřských genů na zygotické.
Oplodnění u některých druhů vede k radikálním cytoplazmatickým pohybům, které jsou nezbytné pro zajištění umístění cytoplazmatických determinant ve správných pozicích vzhledem k následným štěpným událostem.
PATTERNY EMBRYONICKÉHO ŠTĚPNUTÍ
Patterny embryonálního štěpení jsou určeny jak polohou mitotických vřetének, tak množstvím a rozložením žloutku. Žloutek má tendenci inhibovat štěpení. Zpomaluje ho nebo vlastně zabraňuje úplnému štěpení. Žloutek je adaptací těch živočichů, kteří procházejí větší či menší částí embryogeneze izolováni od jakéhokoli přísunu potravy. Někteří živočichové, jako například mořský ježek, mají relativně málo žloutku, protože se rychle vyvíjejí do volně plovoucí larvální formy, která získává živiny z prostředí. Jiní živočichové, například vačnatci, se rodí předčasně, ale výživu jim poskytuje rodičovský vak. U placentálních savců se vyvíjí specializovaný orgán, jehož prostřednictvím je embryo vyživováno po celou dobu vývoje, a proto mají také málo žloutku.
Typy vajec podle vlastností žloutku jsou popsány takto:
Isolektilní: řídký rovnoměrně rozložený žloutek, např. mořský ježek, myš
Mezolektilní: střední množství žloutku, často nerovnoměrně rozloženého, např, žába
Telolecitální: hustý žloutek soustředěný na jednom konci, např. pták, plaz
Centrolekitální: žloutek soustředěný uprostřed vejce, např. moucha
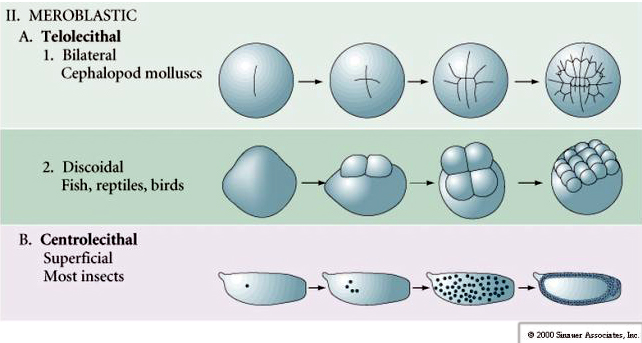
Mnoho vajec je polarizováno s pólem bohatým na žloutek, označovaným jako rostlinný pól, a pólem chudým na žloutek, označovaným jako živočišný pól, např. žába. Zygotické jádro je obvykle posunuto směrem k živočišnému pólu. Zygoty s relativně malým množstvím žloutku (izolecitální a mezolecitální) se štěpí HOLOBLASTICKY. Štěpná rýha se táhne celým vajíčkem. Zatímco u telolecitálních a centrolekitálních zygot dochází k MEROBLASTICKÉMU štěpení, kdy štěpná rýha zasahuje pouze k nahromaděnému žloutku. U centrolekitálních vajíček (mnohá vajíčka hmyzu) je štěpení meroblastické a povrchové, zatímco u telolecitálních vajíček (ptáci a ryby) je štěpení diskoidální
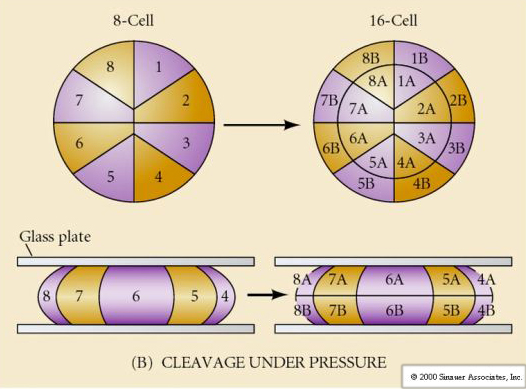
V přírodě se vyskytuje několik typů štěpné symetrie: radiální (ostnokožci, obojživelníci), spirální (měkkýši, annelidé), bilaterální (ascidie, pláštěnci), rotační (savci). Dva obrázky níže ukazují příklady holoblastické a meroblastické štěpné symetrie.
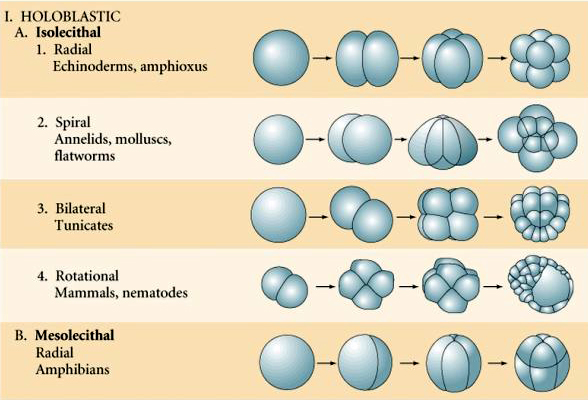
RADIÁLNÍ HOLOBLASTICKÁ ŠTĚPNOST
Vynikající film o štěpnosti mořských ježků z knihy Rachel Finkové „Tucet vajec“.
Mořští ježci mají také radiální holoblastickou štěpnost, ale s některými zajímavými rozdíly. První štěpení je meridionální. druhé štěpení je meridionální. Třetí štěpení je rovníkové Čtvrté štěpení je meridionální, ale zatímco čtyři buňky živočišného pólu se dělí rovnoměrně a dávají vzniknout osmi stejně velkým živočišným blastomerám označovaným jako MESOMERY, vegetativní buňky se dělí asymetricky podél rovníkové roviny a dávají vzniknout 4 velkým MACROMERÁM a 4 mnohem menším MICROMERÁM na vegetativním pólu. Při pátém dělení se MESOMERES rozdělí rovníkově a vzniknou dvě vrstvy po osmi MESOMERES an1 a an2 , MACROMERES se rozdělí meridionálně a vytvoří vrstvu osmi buněk pod an2, MICROMERES se rozdělí a vznikne shluk buněk pod vrstvou veg1. Šestá dělení jsou všechna ekvatoriální, čímž vzniká vrstva veg2. Sedmá dělení jsou všechna meridionální, čímž vzniká blastula o 128 buňkách.
Co určuje tyto vzory štěpení? Jsou závislé na předchozím štěpení a odehrávají se jako na běžícím pásu, nebo je určují nějaké vnitřní hodiny? V roce 1939 Horstadius inhiboval jedno nebo dvě z prvních tří štěpení a zjistil, že výskyt mikromer nastává ve správný čas bez ohledu na historii štěpení
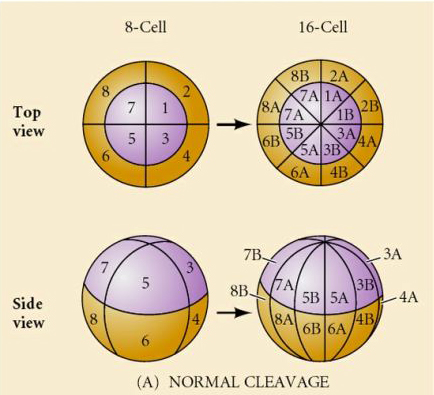
Z těchto pokusů vyplývá, že ve vegetativním pólu vajíčka existuje nějaký faktor, který určuje vznik mikromer, a dále že musí existovat molekulární hodiny, které začínají při aktivaci vajíčka. Tyto hodiny jsou nezávislé na vlastní události štěpení.
Blastula o 128 buňkách je poměrně volné klubko buněk obklopující dutou blastokélu. Kulička má tloušťku jedné buněčné vrstvy, přičemž všechny buňky jsou v kontaktu s vnější hyalinní vrstvou a vnitřní tekutinou blastocoelu. V této fázi vývoje začínají buňky vytvářet těsné spoje charakteristické pro epitel. Centrální blastocoel je nyní izolován od vnějšího prostředí. Blastomery se nadále dělí osou rovnoběžnou s hyalinní vrstvou a zůstávají epitelem o tloušťce jedné buňky. Blastocoel se nadále zvětšuje.
Dvě teorie se snaží vysvětlit způsob zvětšování blastocysty
1. Osmotická teorie předpokládá, že blastomery vylučují do blastocoelu ionty a bílkoviny, což vede k nárůstu tlaku v důsledku osmotického proudění vody. Tento tlak by pak byl zodpovědný za vyrovnání mitózní osy blastomer a zvětšení blastocoelu.
2. Alternativní teorie Wolperta a jeho kolegů předpokládá, že ve skutečnosti jsou to adhezní interakce mezi blastomerami a mezi blastomerami a hyalinní vrstvou, které vyrovnávají mitózní osy. To znamená, že adheze k hyalinu je největší, následuje adheze k ostatním blastomerám a nakonec interakce se stěnou blastocelu je nejmenší. Dominantní adheze s hyalinní vrstvou si vynucuje expanzi blastocysty a blastocoelu.
Buňkám blastuly vyrůstají na vnějším povrchu řasinky, vylučují hatchingový enzym (hyalinázu) a stávají se volně plovoucími.
Štěpení u mnoha obojživelníků je holoblastické s radiální symetrií, avšak velký objem žloutku (jeho mezolecithal) brání štěpení. Na živočišném pólu probíhá první štěpení rychlostí asi 1 mm/min, zatímco přes vegetativní pól probíhá 50-100krát pomaleji (,02 mm/min). Zatímco první štěpení je v žloutkové vegetativní oblasti vajíčka ještě neúplné, začíná probíhat druhé meridionální štěpení.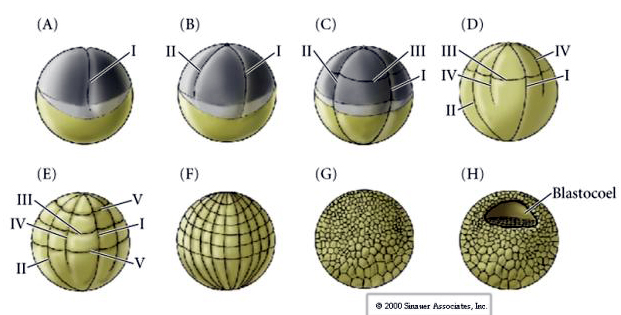
Třetí štěpení je rovníkové, ale protože jádra a astery jsou posunuty živočišnou stranou, rovina štěpení, ačkoli je kolmá na živočišnou vegetativní osu, je také posunuta směrem k živočišnému pólu a nerozděluje blastomery rovnoměrně. Výsledkem jsou čtyři menší živočišné blastomery (označované jako MICROMERES) a čtyři velké vegetativní pólové blastomery (označované jako MACROMERES). Tímto nerovnoměrným holoblastickým štěpením vzniká rychleji se dělící živočišný pól složený z menších mikromer a pomaleji se dělící vegetativní pól složený z makromer. Živočišný pól se brzy skládá z mnoha malých mikromer a vegetativní pól z několika velkých makromer naplněných žloutkem. Ačkoli tvorba blastocelu začíná s prvním štěpením, je zřejmá až ve stadiu 128 buněk.
JAKOU FUNKCI SLOUŽÍ BLASTOCEL?
Blastocel prostorově odděluje buňky tak, aby se vzájemně nedotýkaly. Buňky na střeše blastocelu se obvykle stávají ektodermem. Pokud transplantujete buňky ze střechy blastocelu vedle žlutých buněk na bázi blastocelu, budou se diferencovat jako mezoderm. Mezodermální deriváty normálně vznikají z buněk sousedících s endodermálními prekurzory. Jednou z možností, kterou budeme důkladně zkoumat, je, že vegetativní buňky indukují prostřednictvím buněčných interakcí sousední buňky, aby se staly mezodermálními. Vytvoření blastocoelu tak může být nezbytné, aby se zabránilo nevhodným „indukčním“ interakcím mezi ranými buňkami blastocysty. Druhá zřejmá potřeba blastocoelu může být během následujícího stádia vývoje, GASTRULACE, kdy buňky migrují do nitra blastocoelu.
SAMCOVSKÉ VEJCE
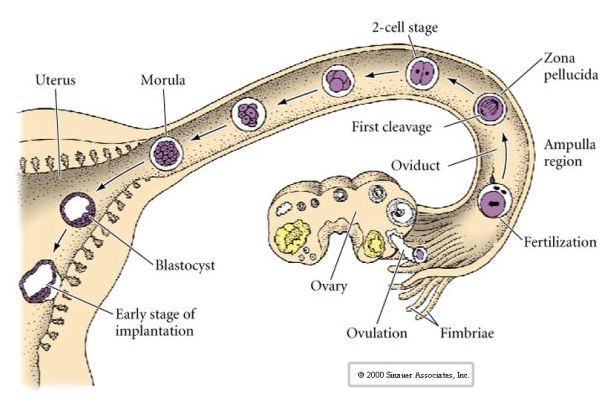
Vejce savců je uvolněno z vaječníku do vejcovodu, kde je oplodněno. První štěpení začíná asi den po oplození uvnitř vejcovodu. V ostrém kontrastu s většinou živočichů může být štěpení u savců velmi pomalé – 1 den.
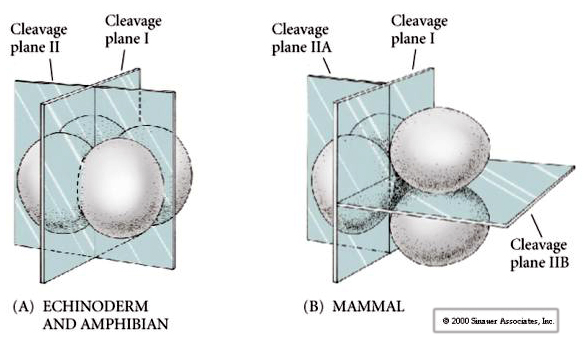 Díky tomu se roviny štěpení poněkud liší od ostatních živočichů. První štěpná rovina je meridionální stejně jako u mořských ježků a žab. Při druhém štěpení se však jedna z blastomer dělí meridionálně a druhá ekvatoriálně! Tento typ štěpení se nazývá ROTAČNÍ HOLOBLASTICKÉ ŠTĚPENÍ.
Díky tomu se roviny štěpení poněkud liší od ostatních živočichů. První štěpná rovina je meridionální stejně jako u mořských ježků a žab. Při druhém štěpení se však jedna z blastomer dělí meridionálně a druhá ekvatoriálně! Tento typ štěpení se nazývá ROTAČNÍ HOLOBLASTICKÉ ŠTĚPENÍ.
Dalším jedinečným rysem štěpení savců je, že štěpení blastomer probíhá asynchronně. (Ve srovnání se synchronním štěpením mořských ježků a žab až do přechodu do poloviny blastuly). Štěpení savčího embrya je od samého počátku regulováno zyotickým jádrem.
Přes třetí štěpení tvoří blastomery klubko volně spojených buněk stejně jako u ostatních studovaných živočichů. Před čtvrtým štěpením buňky blastuly dramaticky mění své chování vůči sobě navzájem. Rychle se snaží maximalizovat své kontakty s ostatními blastomerami, a tím způsobují kompaktnost blastuly.

Tato KOMPAKTNOST je částečně výsledkem produkce nové adhezivní molekuly UVOMORULIN (E-Cadherin) a je stabilizována tvorbou těsných spojů mezi vnějšími buňkami, které podobně jako u mořského ježka uzavírají vnitřek blastuly od vnějšího prostředí. Buňky mezi sebou také vytvářejí gap junctions, které umožňují průchod malých molekul, jako jsou ionty a některé molekuly druhého posla, například Ca++ a C-AMP. Kompaktní 16buněčná morula se skládá z vnější slupky buněk a několika buněk (1-2) zcela vnitřních. Z většiny vnějších buněk vznikají TROBLASTICKÉ NEBO TROFEKTODERMÁLNÍ BUŇKY. Tyto buňky se nepodílejí na vzniku vlastního embrya, ale jsou naopak nezbytné pro implantaci embrya do děložní stěny a tvoří tkáně CHORIÁNU, základní složky placenty, o které si povíme později.
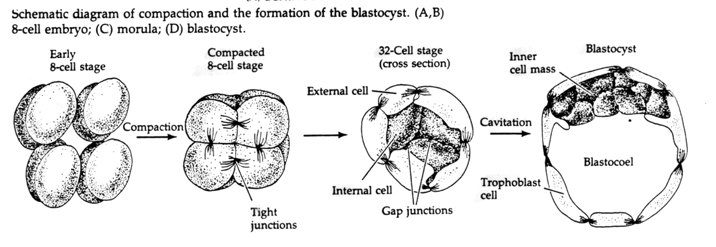
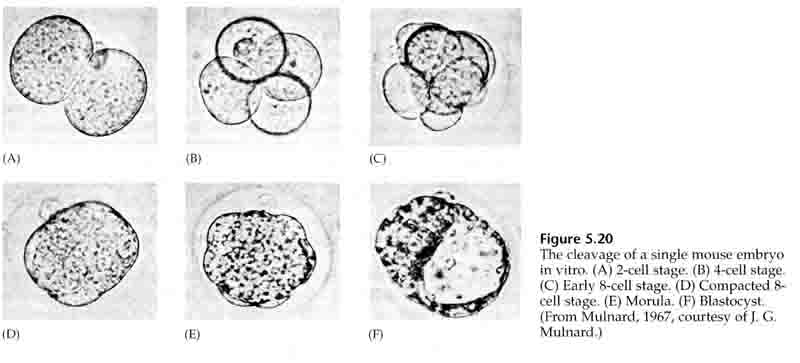
Buňky embrya pocházejí z několika vnitřních buněk 16buněčného stadia blastuly. Tyto buňky vytvářejí vnitřní buněčnou hmotu buňky, z níž se vyvíjí celé embryo. V 6. štěpení, 64buněčném stadiu, se vnitřní buněčná hmota a trofoblastická vrstva zcela oddělí. Trofoblasty vnitřně vylučují tekutinu, která vytváří blastocoel. Embryo se nyní nazývá blastocysta.
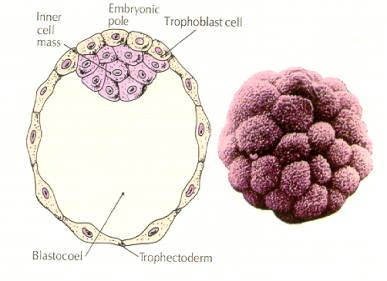 VZNIK VNITŘNÍ BUNĚČNÉ HMOTY
VZNIK VNITŘNÍ BUNĚČNÉ HMOTY
Jak tyto buňky vnitřní buněčné hmoty vznikají? Jsou některé blastomery předurčeny vnitřními faktory k tomu, aby se staly progenitory vnitřní buněčné hmoty? Odpověď se zdá být záporná. Zdá se, že všechny rané blastomery jsou totipotentní a určení, které buňky přispějí do trofoblastické vrstvy a které do vnitřní buněčné hmoty, je pouze otázkou náhodného postavení. Buňky ze čtyřbuněčného embrya, které za normálních okolností dávají vzniknout jak vnitřní buněčné hmotě, tak buňkám trofektodermu, transplantované na vnější stranu embrya ve stadiu 32 buněk dávají vzniknout pouze trofektodermu. Nepřispívají k vytvoření vlastního embrya. Vzpomeňte si z dřívější přednášky o klonování, že sloučením dvou myších embryí ve stádiu 8 buněk vznikne normální embryo, což naznačuje, že všechny buňky v tomto stádiu jsou totipotentní.
MEROBLASTICKÉ ŠTĚPENÍ
U telolecitálních a centrolekitálních vajíček brání štěpení velký hustý žloutek. Telolecitální vejce jsou charakteristická pro ptáky, ryby a plazy, zatímco centrolekitální vejce jsou charakteristická pro hmyz. U telolecitálních vajíček dochází k meroblastickému diskoidnímu štěpení. Štěpení je omezeno na blastodisc na živočišném pólu vajíčka. U časných štěpení, protože štěpení nemůže probíhat přes žloutek, jsou blastomery na svých vegetativních okrajích souvislé.
Tento film o vývoji zebřiček od Rolfa Karlstroma je vynikající. (Movie by Paul Myers)
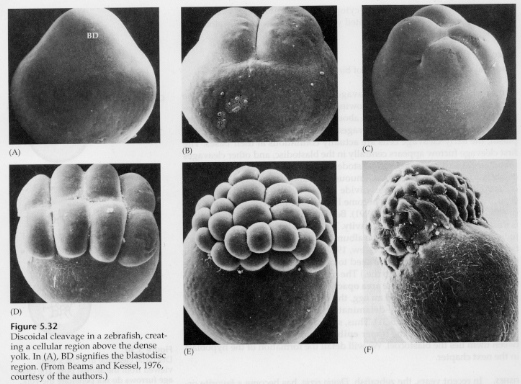 Teprve v rovníkových štěpeních se buňky blastodermy oddělují od žloutku. Další rovníkové štěpení vytváří vícevrstevný blastoderm o tloušťce tří až čtyř buněk.
Teprve v rovníkových štěpeních se buňky blastodermy oddělují od žloutku. Další rovníkové štěpení vytváří vícevrstevný blastoderm o tloušťce tří až čtyř buněk.
U ptáků vzniká mezi blastodermem a žloutkem prostor zvaný SUBGERMINÁLNÍ dutina. Při 16. dělení (60 000 buněk) migrují buňky blastodermy do subgerminální dutiny a vytvářejí druhou vrstvu. Tyto dvě vrstvy se nazývají vnější EPIBLAST a vnitřní HYPOBLAST, mezi nimiž je blastocoel. Podrobněji se tím budeme zabývat později, až budeme probírat gastrulaci ptáků a savců
Centrální vajíčka členovců procházejí SUPERFICIÁLNÍM KLOUBENÍM. Velká centrální hmota žloutku omezuje štěpení na cytoplazmatický okraj vajíčka.
Zajímavou a poučnou variantu vidíme u hmyzu. Zygotická jádra se dělí bez štěpení. To znamená, že jádra procházejí karyokinezí—-mitotickým dělením jádra— bez cytokineze–dělení buňky. Tato holá jádra se nazývají ENERGIDY. Jádra se dělí úžasnou rychlostí – každých 8 minut (celá embryogeneze trvá pouze 22 hodin).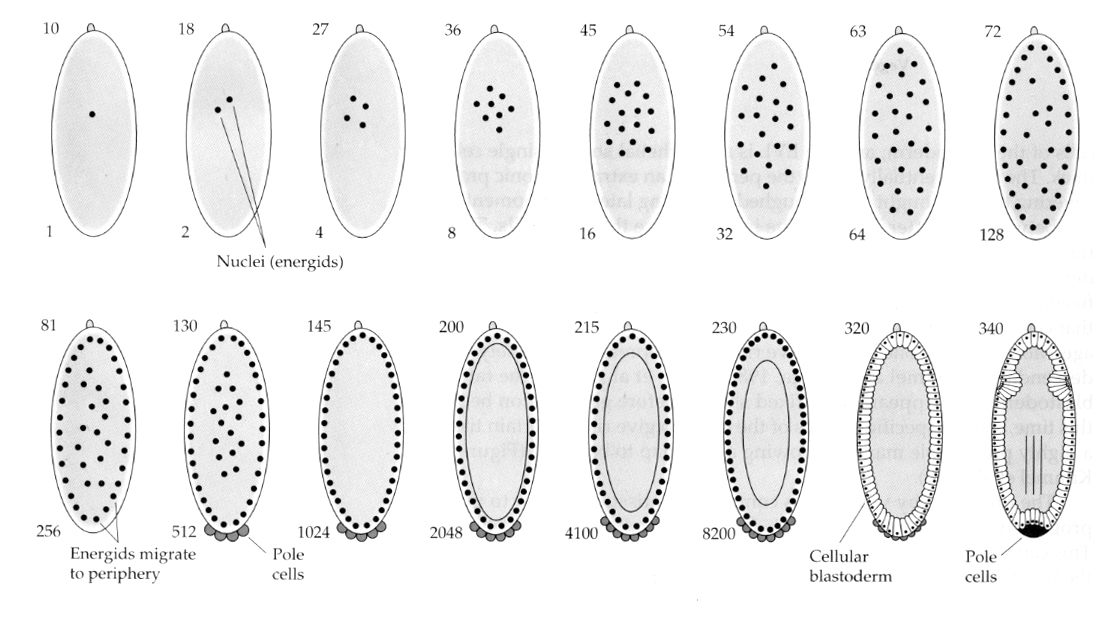
 Po několika kolech karyokineze nahá jádra migrují na periferii vajíčka. V této fázi se nazývá SYNKYTICKÝ BLASTODERM, protože všechna jádra sdílejí stejnou cytoplazmu. Přibližně při 14. jaderném dělení dochází k celulizaci, čímž vzniká BUNĚČNÝ BLASTODERM. Po této době se buňky dělí asynchronně. To odpovídá přechodu do střední blastuly u žab a mořských ježků. (přechod od mateřské k primárně zygotické genové expresi) Nezapomeňte, že se předpokládalo, že přechod midblastula je vyvolán poměrem chromatinu a cytoplazmy. Důkazem tohoto mechanismu u mušek je zkoumání mutantních haploidních embryí. Tato embrya procházejí přechodem midblastula a celulizací o jedno dělení později 15. Kromě toho lze urychlit celulizaci podvázáním vajíčka a zmenšením objemu cytoplazmy. Ačkoli stadium syncytiálního blastodermu naznačuje, že všechna jádra jsou ekvipotentní, protože se nezdá, že by existovaly difuzní bariéry pro cytoplazmatické determinanty, ve skutečnosti je cytoplazma velmi regionalizovaná a jádra mají kolem sebe vysoce organizované cytoplazmatické domény.
Po několika kolech karyokineze nahá jádra migrují na periferii vajíčka. V této fázi se nazývá SYNKYTICKÝ BLASTODERM, protože všechna jádra sdílejí stejnou cytoplazmu. Přibližně při 14. jaderném dělení dochází k celulizaci, čímž vzniká BUNĚČNÝ BLASTODERM. Po této době se buňky dělí asynchronně. To odpovídá přechodu do střední blastuly u žab a mořských ježků. (přechod od mateřské k primárně zygotické genové expresi) Nezapomeňte, že se předpokládalo, že přechod midblastula je vyvolán poměrem chromatinu a cytoplazmy. Důkazem tohoto mechanismu u mušek je zkoumání mutantních haploidních embryí. Tato embrya procházejí přechodem midblastula a celulizací o jedno dělení později 15. Kromě toho lze urychlit celulizaci podvázáním vajíčka a zmenšením objemu cytoplazmy. Ačkoli stadium syncytiálního blastodermu naznačuje, že všechna jádra jsou ekvipotentní, protože se nezdá, že by existovaly difuzní bariéry pro cytoplazmatické determinanty, ve skutečnosti je cytoplazma velmi regionalizovaná a jádra mají kolem sebe vysoce organizované cytoplazmatické domény.
MECHANISMY ŠTĚPENÍ
Buněčný cyklus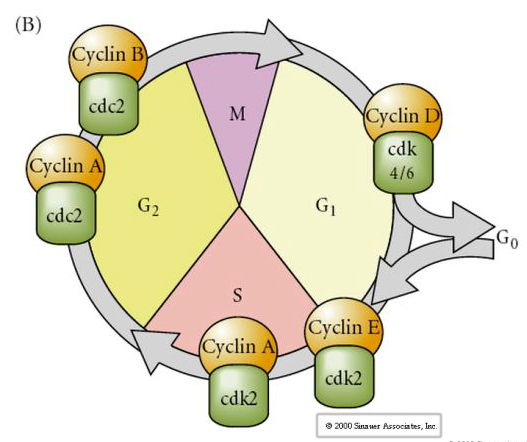
M-mitóza
G1- předreplikační mezera
S- syntéza DNA
G2-premitotická mezera
U embryí ve štěpném stadiu, jako jsou žáby a mouchy, přechází blastomery přímo z M do S bez mezistupně G1 nebo G2. Po přechodu do střední blastuly mají buňky u obou živočichů G1 a G2. Elegantní transplantační experimenty prokázaly, že je to cytoplazma, která reguluje karyokinezi i cytokinezi. Pokud jsou jádra z dělících se buněk transplantována do oocytu, okamžitě se přestanou dělit.
 Naopak pokud jsou jádra z nedělících se buněk vložena do oplozených enukleovaných vajíček, začnou se dělit. Uměle aktivovaná enukleovaná vajíčka bez centriol prodělají kortikální kontrakce připomínající štěpení. Byly identifikovány některé cytoplazmatické faktory regulující dělení buněk v raném embryu.
Naopak pokud jsou jádra z nedělících se buněk vložena do oplozených enukleovaných vajíček, začnou se dělit. Uměle aktivovaná enukleovaná vajíčka bez centriol prodělají kortikální kontrakce připomínající štěpení. Byly identifikovány některé cytoplazmatické faktory regulující dělení buněk v raném embryu.
CYTOSTATICKÝ FAKTOR (CSF) je zvýšen po prvním meiotickém dělení a zastavuje oocyt ve druhé meiotické metafázi. Po oplodnění Ca inaktivuje CSF, meióza je dokončena a pronuklea splynou.
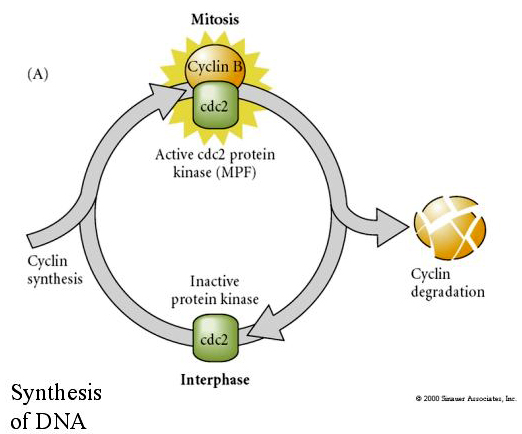
MITOSIS PROMOTING FACTOR (MPF) způsobí, že buňky vstoupí do M fáze. Aktivace MPF způsobuje: 1. kondenzaci chromozomů fosforylací histonu H1, 2. rozpad jaderného obalu hyperfosforylací 3 jaderných laminů, 3. inhibici RNA polymerázy k zastavení transkripce, 4. fosforylaci regulační podjednotky myozinu k inhibici cytokineze.
Navržený model cyklické regulace buněčného cyklu během štěpných fází embrogeneze. MPF indukuje buňku k postupu z S do M. CSF se váže na MPF a brání jeho inaktivaci. Buňka zůstává v M. Ca se zvyšuje a způsobuje inaktivaci CSF, což zase vede k inaktivaci MPF a buňka postupuje z M do S a cyklus se opakuje. MPF se skládá ze dvou podjednotek, cyklinu B a cdc2. Právě cyklin B prochází syntézou a degradací specifickou pro buněčný cyklus, která je regulována buněčným jádrem a řídí buněčný cyklus v normálních somatických buňkách. Během oogeneze je však vajíčko nabito „regulátory“ cyklinu B a mRNA cyklinu B, takže jeho syntéza je regulována mateřskými faktory nezávisle na zygotickém jádře. Proto teprve po „vyčerpání“ mateřských složek přebírá řízení zygotické jádro a vrací se normální buněčný cyklus (M, G1, S, G2).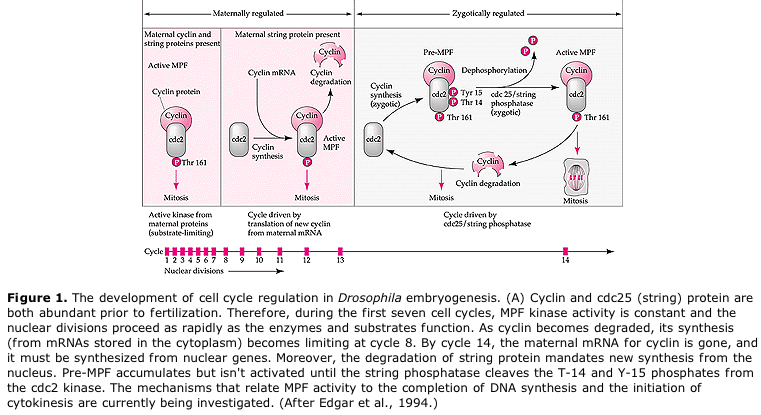
DETERMINACE BUNĚČNÉHO ÚDOLÍ
Cytoplazmatická lokalizace DETERMINANTŮ jako obecný a základní mechanismus časného vzorování (příklady Tunicate a Sea Urchin). Hlavní otázkou vývojové biologie je, kdy a jak se během vývoje určuje osud buněk. To úzce souvisí s otázkou, jak dochází k tvorbě vzorů během vývoje. Embryo musí nejen vytvořit správný počet a typ diferencovaných buněk, ale musí být také správně uspořádány vzhledem ke všem ostatním buňkám v embryu, aby vznikl funkční živočich. Budeme zkoumat dvě možnosti určování buněčného osudu a tvorby vzorů: 1. Osud buněk by mohl být určován vnitřními faktory, které se dostanou do vajíčka během oogeneze a pak se během štěpení rozdělí na konkrétní blastomery, 2. Vnější signály poskytované prostředím embrya by mohly poskytovat informace o vzoru, které regulují osud buněk. Jak uvidíme, většina složitých organismů používá kombinaci vnitřních a vnějších signálů k regulaci buněčného osudu a tvorby embryonálního vzoru.
Autonomní specifikace buněčného osudu pomocí cytoplazmatických determinantů naznačuje, že osud buňky je zcela závislý na její linii, zatímco „regulační“ vývoj naznačuje, že osud buňky je určován vnějšími signály z jiných buněk. Tyto dva mechanismy specifikace buněk lze experimentálně rozlišit pomocí izolačních, ablačních a transplantačních pokusů. Pokud se blastmera izolovaná z embrya normálně diferencuje (jako by byla stále na svém normálním místě v embryu), můžeme říci, že musí mít vnitřní determinanty, které určují její osud. Pokud se však diferencuje abnormálně, můžeme říci, že jeho osud závisí na vnějších signálech. Pokud z embrya ablokujeme blastomeru a embryo se vyvíjí abnormálně a chybí mu všechny buněčné osudy, které normálně vznikají z ablované blastomery, říkáme, že vývoj je buněčně autonomní a vnitřně specifikovaný. Pokud se však embryo vyvíjí normálně, říkáme, že zbývající blastomery mohou regulovat svůj buněčný osud, aby nahradily chybějící buňky. Pokud si transplantovaná buňka zachová svůj buněčný osud na základě své původní pozice, pak říkáme, že její osud byl určen, pokud na základě své nově transplantované pozice zaujme nový osud, říkáme, že její osud je regulován vnějšími signály z okolních buněk.
CYTOPLASMICKÁ LOKALIZACE A REGULACE V TUNICATE EGG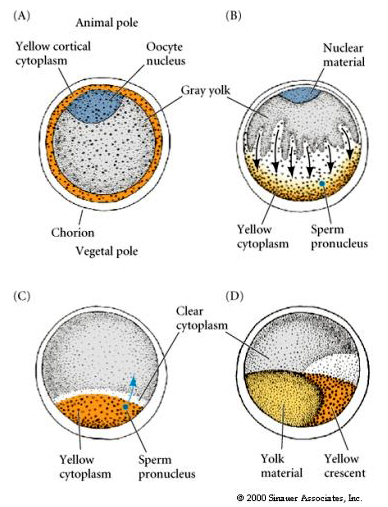
Na konci oogeneze má tunikátní vajíčko jasně odlišený živočišný a vegetativní pól. Je zde žlutá kortikální cytoplazma, která obklopuje šedou žlutavou vnitřní cytoplazmu. Jádro oocytu je posunuto směrem k živočišnému pólu. Spermie vstupující do vegetativní polokoule oplodní vajíčko a zahájí vývoj. Po oplození dochází k dramatickému přeskupení cytoplazmy vajíčka, což dává vzniknout regionálně zbarveným cytoplazmatům, které zřejmě korelují s následnými osudy blastomer.
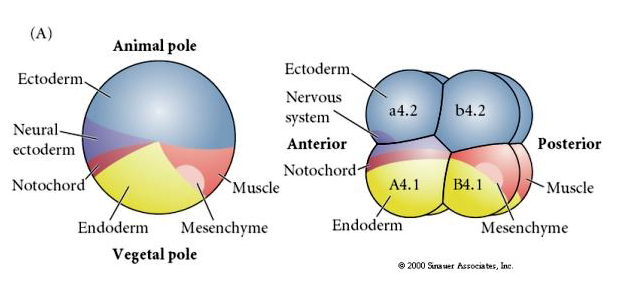 Všimněte si, že mapa osudů koreluje s různě zbarvenými cytoplazmami embrya tunikátu. Nenechte se zmást rozdílnými barvami na dvou obrázcích. „Oranžová“ žlutá půlměsíčitá cytoplazma koreluje s osudy svalů a žlutá (žlutá) cytoplazma koreluje s osudy endodermů. Šedá (bílá nebo modrofialová) cytoplazma nad žlutým půlměsícem koreluje s neurálním ektodermem.
Všimněte si, že mapa osudů koreluje s různě zbarvenými cytoplazmami embrya tunikátu. Nenechte se zmást rozdílnými barvami na dvou obrázcích. „Oranžová“ žlutá půlměsíčitá cytoplazma koreluje s osudy svalů a žlutá (žlutá) cytoplazma koreluje s osudy endodermů. Šedá (bílá nebo modrofialová) cytoplazma nad žlutým půlměsícem koreluje s neurálním ektodermem.
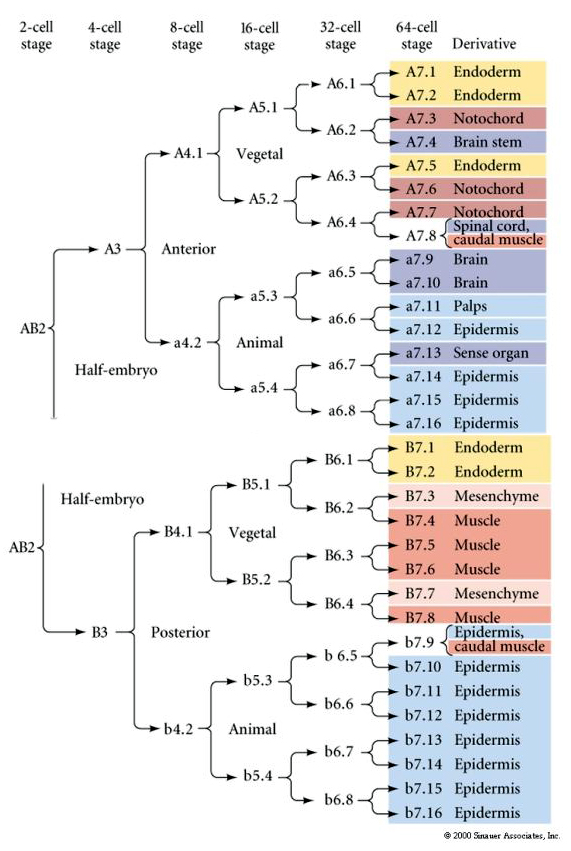 Tato mapa linií ukazuje korelaci invariantních linií s blastomerami parcelovanými jednotlivými barevnými cytoplazmami podle invariantních buněčných štěpů. Invariantní štěpení a linie však nutně nedokazují autonomní buněčnou specifikaci pomocí cytoplazmatických determinant.
Tato mapa linií ukazuje korelaci invariantních linií s blastomerami parcelovanými jednotlivými barevnými cytoplazmami podle invariantních buněčných štěpů. Invariantní štěpení a linie však nutně nedokazují autonomní buněčnou specifikaci pomocí cytoplazmatických determinant.
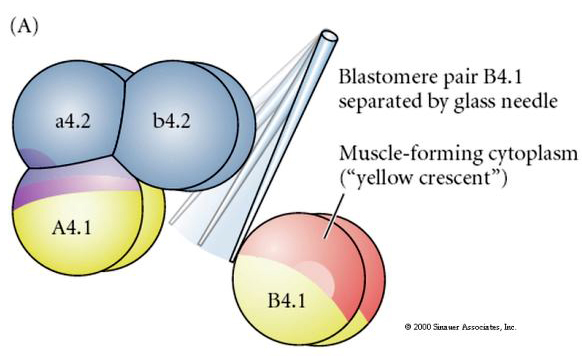 K testování regulační versus autonomní determinace buněčného osudu jsou nutné experimentální manipulace. Klasické izolační experimenty uvedené na následujících třech obrázcích se snaží prokázat, že osud buněk je určen cytoplazmatickými determinantami, které získávají prostřednictvím stereotypních štěpení. K oddělení páru blastomer B4.1 od zbytku embrya se používá skleněná jehla. Blastomery B4.1 obvykle získávají žlutou krecentní cytoplazmu, která koreluje s osudem svalových buněk.
K testování regulační versus autonomní determinace buněčného osudu jsou nutné experimentální manipulace. Klasické izolační experimenty uvedené na následujících třech obrázcích se snaží prokázat, že osud buněk je určen cytoplazmatickými determinantami, které získávají prostřednictvím stereotypních štěpení. K oddělení páru blastomer B4.1 od zbytku embrya se používá skleněná jehla. Blastomery B4.1 obvykle získávají žlutou krecentní cytoplazmu, která koreluje s osudem svalových buněk.
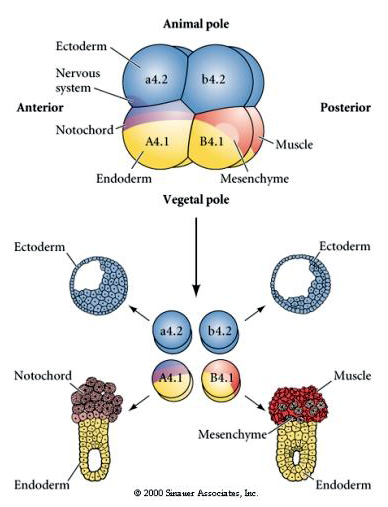
Tady vidíme výsledky izolačních pokusů. V každém případě dávají izolované blastomery vzniknout pouze té podmnožině buněčných osudů, které by normálně vznikly v intaktním embryu. Izolované blastomery neregulují svůj osud tak, aby kompenzovaly chybějící sousedy. Blastomery živočišného pólu, a4.2 a b4.2, dávají vznik pouze ektodermálním buňkám. A4.1 dává vzniknout notochordu a endodermálním buňkám, zatímco B4.1 dává vzniknout svalovým a endodermálním buňkám. Žádná z izolovaných blastomer nemůže dát vzniknout všem buněčným složkám normálního embrya.
V dalším experimentu níže se pomocí jehly manipuluje s rovinou rovníkového štěpení tak, že je více vegetativní než normálně a nyní blastomery živočišného pólu, b4.2, získávají část cytoplazmy „žlutého půlměsíce“. Když jsou tyto blastomery izolovány, dávají nyní vzniknout některým svalovým buňkám. To pěkně ukazuje, že cytoplazma „žlutého půlměsíce“ může určovat osud svalových buněk a může tak činit buněčně autonomním způsobem.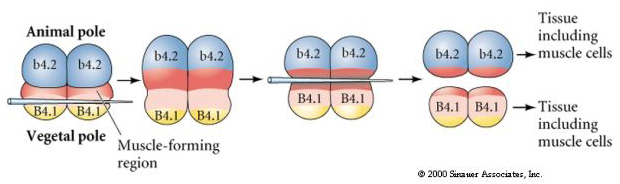
LOKALIZACE A REGULACE V MOŘSKÉM URČINSKÉM VEJCE
Želatinový kanálek určuje polohu živočišného pólu a odráží ranou polaritu vajíčka. Raný vzorec štěpení nezávisí na místě vstupu spermie, ale jsou určeny vnitřní polaritou/asymetrií vajíčka. Boveri (1901) popsal subekvatoriální pruh pigmentu uspořádaný ortongonálně k ose živočich-větev. Tato granula také naznačovala umístění cytoplazmy, která je později zahrnuta do buněk archenteronu. Horstadius (1928) oddělil živočišné a vegetativní blastomery a ukázal, že pouze vegetativní blastomery dávají vznik mikromerám, gastrulují a tvoří kostru. Jeho závěr byl, že cytoplazmatické faktory nacházející se ve vegetální polovině jsou nezbytné pro vznik mikromer, gastrulace a archenteronu a tvorbu skeletu. Pamatujte si vzor časných štěpení. Mikromery vznikají během čtvrtého štěpení (16buněčné stadium) z nerovnoměrného rovnostranného dělení blastomer vegetativního pólu.
Pamatujte si vzor časných štěpení. Mikromery vznikají během čtvrtého štěpení (16buněčné stadium) z nerovnoměrného rovnostranného dělení blastomer vegetativního pólu.
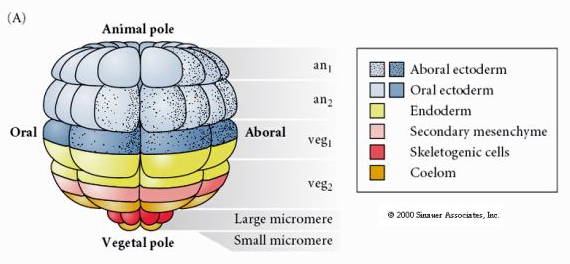 Toto ukazuje mapu osudu blastuly mořského ježka ve stadiu 64 buněk. Všimněte si, že mikromery jsou primárními buňkami mezenchymu a dávají vzniknout larvální kostře (spikulám pluteálního stadia).
Toto ukazuje mapu osudu blastuly mořského ježka ve stadiu 64 buněk. Všimněte si, že mikromery jsou primárními buňkami mezenchymu a dávají vzniknout larvální kostře (spikulám pluteálního stadia).
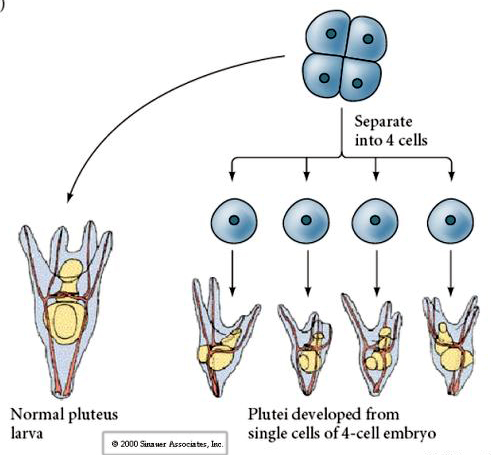 Ve čtyřbuněčném stadiu, pokud jsou blastomery od sebe izolovány, jsou schopny „regulovat“ svůj osud a dát vzniknout 4 malým larvám pluteálního stadia.
Ve čtyřbuněčném stadiu, pokud jsou blastomery od sebe izolovány, jsou schopny „regulovat“ svůj osud a dát vzniknout 4 malým larvám pluteálního stadia.
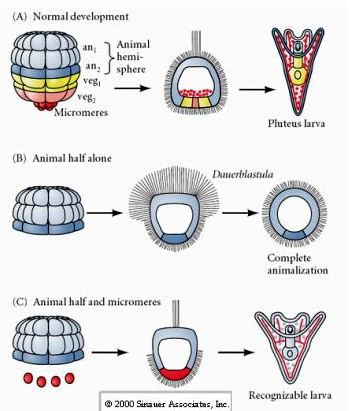 Naproti tomu v pozdějších stadiích, pokud izolujete živočišné poloviny blastomer, zjistíte, že z nich vzniká pouze „animalizovaná“ dauerblastula, která nevyjadřuje žádný osud mezodermálních nebo endodermálních buněk. Z izolovaných vegetativních poloblastomer vznikají larvy, které exprimují osudy ektodermálních, mezodermálních a endodermálních buněk, což ukazuje, že osud těchto buněk lze regulovat. Izolované mikromery (primární mezenchym) procházejí správným počtem buněčných dělení a VŽDY dávají vznik spikulím podle plánu. Mikromery jsou tedy definitivně specifikovány jako prekurzory buněk skeletogenního mezenchymu, když se poprvé objeví ve stadiu 16 buněk. Klíčovými experimenty bylo spojení mikromer s blastomerami živočišného pólu a prokázání, že ačkoli byl osud mikromer „pevně určen“ v době jejich zrodu, mikromery byly schopny „indukovat“ nové buněčné osudy v blastomerách živočišného pólu. Mikromery byly schopny indukovat endodermální a mezodermální osudy v blastomerách živočišného pólu! Pozdní experiment v části „C“ tedy ukazuje, že když se mikromery přidají do zvířecí poloblastuly, můžete nyní vyvolat vznik rozpoznatelné larvy vyjadřující endodermální, mezodermální a ektodermální osudy.
Naproti tomu v pozdějších stadiích, pokud izolujete živočišné poloviny blastomer, zjistíte, že z nich vzniká pouze „animalizovaná“ dauerblastula, která nevyjadřuje žádný osud mezodermálních nebo endodermálních buněk. Z izolovaných vegetativních poloblastomer vznikají larvy, které exprimují osudy ektodermálních, mezodermálních a endodermálních buněk, což ukazuje, že osud těchto buněk lze regulovat. Izolované mikromery (primární mezenchym) procházejí správným počtem buněčných dělení a VŽDY dávají vznik spikulím podle plánu. Mikromery jsou tedy definitivně specifikovány jako prekurzory buněk skeletogenního mezenchymu, když se poprvé objeví ve stadiu 16 buněk. Klíčovými experimenty bylo spojení mikromer s blastomerami živočišného pólu a prokázání, že ačkoli byl osud mikromer „pevně určen“ v době jejich zrodu, mikromery byly schopny „indukovat“ nové buněčné osudy v blastomerách živočišného pólu. Mikromery byly schopny indukovat endodermální a mezodermální osudy v blastomerách živočišného pólu! Pozdní experiment v části „C“ tedy ukazuje, že když se mikromery přidají do zvířecí poloblastuly, můžete nyní vyvolat vznik rozpoznatelné larvy vyjadřující endodermální, mezodermální a ektodermální osudy.
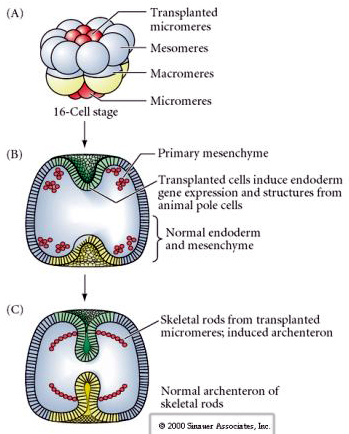 Poslední sada experimentů ukazuje, že i u normálního embrya, pokud transplantujete mikromery do čepičky zvířecího pólu, můžete vyvolat sekundární archenteron a změnit normální osové vzorování. To opět svědčí o tom, že mikromery získávají cytoplazmatický derminant, který specifikuje jejich buněčný osud, a že poskytují indukční signál, který modeluje axiální struktury embrya mořského ucháče. Osud mikromer nelze změnit, ale signály z mikromer mohou změnit osud všech ostatních blastomer.
Poslední sada experimentů ukazuje, že i u normálního embrya, pokud transplantujete mikromery do čepičky zvířecího pólu, můžete vyvolat sekundární archenteron a změnit normální osové vzorování. To opět svědčí o tom, že mikromery získávají cytoplazmatický derminant, který specifikuje jejich buněčný osud, a že poskytují indukční signál, který modeluje axiální struktury embrya mořského ucháče. Osud mikromer nelze změnit, ale signály z mikromer mohou změnit osud všech ostatních blastomer.
Horstadius: (1928, 1935) experimentálně prokázal, že u embrya v 16buněčném stádiu všechny úrovně blastomer kromě mikromer nabývají různého osudu, když jsou transplantovány do různých pozic v chimérických embryích. Archenteron se vyvine z blastomer veg 1, pokud se odstraní buňky veg 2 a mikromery se umístí do kontaktu s vrstvou veg 1. V případě, že se odstraní buňky veg 2 a mikromery se umístí do kontaktu s vrstvou veg 1, vyvine se archenteron. Při absenci mikromer vzniká z blastomer veg 2 archenteron a kosterní struktury. Klasicky se pro vysvětlení těchto výsledků uvádí duální živočišně-rostlinný gradient. Tyto výsledky však pouze naznačují, že k rozhodujícím indukčním interakcím dochází mezi sousedními vrstvami blastomer.
Implantované jednotlivé mikromery v blízkosti živočišného pólu inhibují tvorbu apikálních chomáčků a v některých případech indukují nové embryonální osy. Blastomery Veg 2 rovněž vyvolávají podobné změny jako mikromery, jsou-li transplantovány vedle blastomer živočišného pólu.
Všeobecný výsledek transplantací: Ukazuje se, že osud daných blastomer je u normálních embryí vždy ovlivněn přiložením různých sousedních buněk, které k nim přiléhají.
HYPOTÉZA: Lokalizované mateřské cytoplazmatické determinanty specifikují určité buňky v normálním embryu, zejména mikromery a prekurzory archenteronu v blízkosti vegetativního pólu. Tyto buňky pak induktivně určují osudy sousedních blastomer, které zase interagují se svými sousedy. Mnohé z blastomer si zachovávají jiné potenciály než ty, které normálně vyjadřují, a po určitou dobu jsou tyto blastomery pouze reverzibilně specifikovány, jak to vyžaduje vývojový systém, který do značné míry závisí na indukci.
.