Le clivage désigne le schéma stéréotypé des premières divisions mitotiques qui divise le cytoplasme de l’œuf de grand volume. Le zygote précoce est unique en ce qu’il est si grand. La plupart des cellules connaissent une période de croissance entre les cycles de mitose, mais ce n’est pas le cas des blastomères du stade précoce de clivage. À chaque division, les cellules deviennent plus petites. Ce schéma rapide de division cellulaire sans croissance concomitante s’arrête brusquement au stade appelé transition mi-blastomère où le noyau zygotique prend le contrôle du cycle cellulaire.
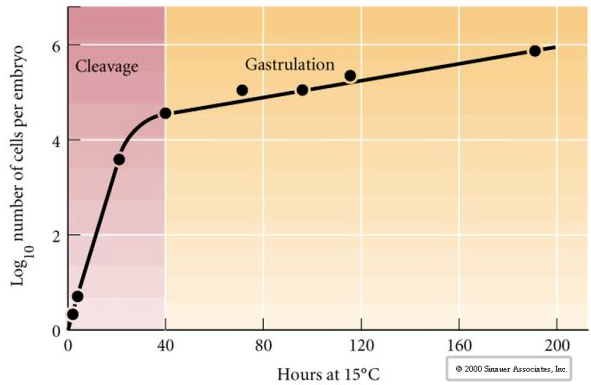 Il existe des preuves qu’un facteur maternel, peut-être un régulateur transcriptionnel, est responsable de ce schéma rapide précoce de divisions de clivage. En modifiant artificiellement le rapport entre l’ADN cytoplasmique et l’ADN nucléaire, on peut changer le moment de la transition midblastula. La transition midblastula se réfère au moment où le changement majeur de l’expression des gènes maternels vers les gènes zygotiques a lieu.
Il existe des preuves qu’un facteur maternel, peut-être un régulateur transcriptionnel, est responsable de ce schéma rapide précoce de divisions de clivage. En modifiant artificiellement le rapport entre l’ADN cytoplasmique et l’ADN nucléaire, on peut changer le moment de la transition midblastula. La transition midblastula se réfère au moment où le changement majeur de l’expression des gènes maternels vers les gènes zygotiques a lieu.
La fécondation chez certaines espèces conduit à des mouvements cytoplasmiques radicaux qui sont essentiels pour assurer que les déterminants cytoplasmiques sont situés dans les positions correctes par rapport aux événements de clivage ultérieurs.
PATERNITÉS DU CLIVAGE EMBRYONIQUE
Le modèle de clivage embryonnaire est déterminé à la fois par la position des fuseaux mitotiques et par la quantité et la distribution du vitellus. Le vitellus a tendance à inhiber le clivage. Il le ralentit ou empêche même le clivage complet. Le vitellus est une adaptation des animaux qui traversent plus ou moins l’embryogenèse en étant isolés de toute source de nourriture. Certains animaux, comme les oursins, ont relativement peu de vitellus parce qu’ils se développent rapidement en une forme larvaire nageant librement et acquérant des nutriments de leur environnement. D’autres animaux, comme les marsupiaux, naissent prématurément, mais sont nourris dans une poche parentale. Les mammifères placentaires développent un organe spécialisé par lequel l’embryon est nourri tout au long de son développement et ont donc également peu de vitellus.
Les types d’œufs basés sur les caractéristiques du vitellus sont décrits comme :
Isolecithal : vitellus clairsemé et uniformément réparti, par exemple, oursin, souris
Mesolecthal : quantité modérée de vitellus, souvent inégalement réparti, par exemple, grenouille
Télécithal : vitellus dense concentré à une extrémité, par exemple, oiseau, reptile
Centrolecithal : vitellus concentré au milieu de l’œuf, par exemple, mouche
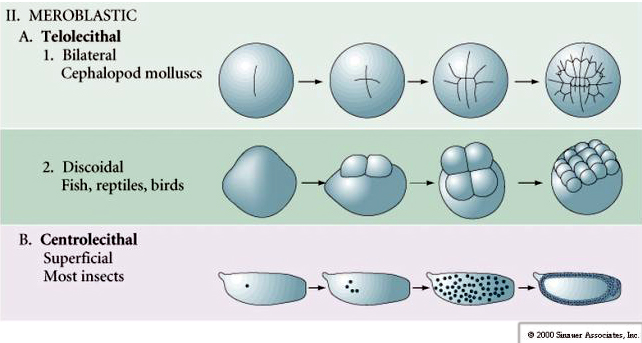
De nombreux œufs sont polarisés avec un pôle riche en vitellus, appelé pôle végétal et un pôle pauvre en vitellus appelé pôle animal, par exemple, grenouille. Le noyau zygotique est généralement déplacé vers le pôle animal. Les zygotes avec relativement peu de vitellus (isolecithal et mésolecithal) se clivent HOLOBLASTIQUEMENT. Le sillon de clivage s’étend sur toute la longueur de l’œuf. Alors que les zygotes télolécithaux et centrolecithaux subissent un clivage MEROBLASTIQUE où le plan de clivage ne s’étend que jusqu’au vitellus accumulé. Dans les œufs centrolecithal (de nombreux œufs d’insectes), le clivage est méroblastique et superficiel, tandis que dans les œufs telolecithal (oiseaux et poissons), le clivage est discoïdal
Il existe plusieurs types de symétrie de clivage observés dans la nature : radiale (échinodermes, amphibiens), spirale (mollusques, annélides), bilatérale (ascidies, tuniciers), rotationnelle (mammifères). Les deux figures ci-dessous montrent des exemples de symétries de clivage holoblastique et méroblastique.
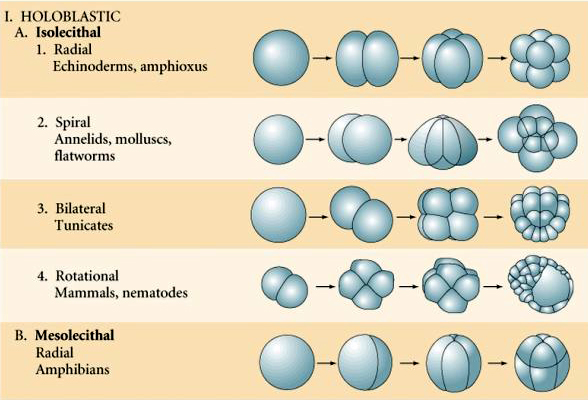
Clivage holoblastique radial
Excellent film de clivage d’oursins provenant de « A Dozen Eggs » de Rachel Fink.
Les oursins ont également un clivage holoblastique radial, mais avec quelques différences intéressantes. Le premier clivage est méridional.Le deuxième clivage est méridional. Le troisième clivage est équatorial Le quatrième clivage est méridional, mais alors que les quatre cellules du pôle animal se divisent de manière égale pour donner naissance à huit blastomères animaux de taille égale appelés MESOMÈRES, les cellules végétales se divisent de manière asymétrique le long du plan équatorial pour donner 4 grands MACROMÈRES et 4 MICROMÈRES beaucoup plus petits au pôle végétal. Cinquième division : les MESOMERES se divisent de façon équatoriale pour donner deux niveaux de huit MESOMERES an1 et an2, les MACROMERES se divisent de façon méridionale pour former un niveau de huit cellules sous an2, les MICROMERES se divisent pour donner un groupe de cellules sous la couche veg1. Les sixièmes divisions sont toutes équatoriales, donnant une couche veg2. Les septièmes divisions sont toutes méridionales, donnant une blastula de 128 cellules.
Qu’est-ce qui détermine ces schémas de clivage ? Dépendent-ils du clivage précédent et se déroulent-ils comme une bande ou sont-ils déterminés par une horloge intrinsèque ? En 1939, Horstadius a inhibé un ou deux des trois premiers clivages et a constaté que l’apparition des micromères se produisait au bon moment indépendamment de l’histoire des clivages
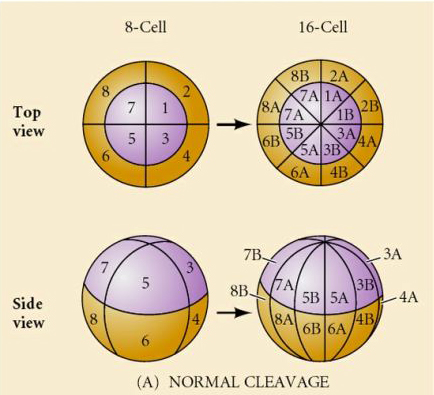
La conclusion de ces expériences est qu’il existe un facteur dans le pôle végétal de l’œuf qui détermine la formation des micromères et en outre qu’il doit y avoir une horloge moléculaire qui commence à l’activation de l’œuf. L’horloge est indépendante de l’événement de clivage réel.
La blastula de 128 cellules est une boule plutôt lâche de cellules entourant un blastocoel creux. La boule est épaisse d’une couche de cellules, toutes les cellules étant en contact avec la couche hyaline externe et le fluide interne du blastocèle. À ce stade du développement, les cellules commencent à former les jonctions serrées caractéristiques d’un épithélium. Le blastocoel central est maintenant isolé du milieu extérieur. Les blastomères continuent à se diviser avec leur axe parallèle à la couche hyaline, restant un épithélium d’une cellule d’épaisseur. Le blastocèle continue de s’agrandir.
Deux théories tentent de rendre compte du schéma d’agrandissement du blastocyste
1. La théorie osmotique suggère que des ions et des protéines sont sécrétés dans le blastocoel par les blastomères et que cela entraîne une augmentation de la pression due au flux osmotique de l’eau. Cette pression serait alors responsable de l’alignement de l’axe de mitose des blastomères et de l’élargissement du blastocoel.
2. L’autre théorie de Wolpert et de ses collègues suggère que ce sont vraiment les interactions adhésives entre les blastomères et entre les blastomères et la couche hyaline qui alignent les axes de mitose. En d’autres termes, l’adhésion à la couche hyaline est la plus forte, l’adhésion aux autres blastomères est la suivante, et enfin l’interaction avec la paroi du blastocoele est la plus faible. L’adhésion dominante avec la couche hyaline force l’expansion du blastocyste et du blastocoel.
Les cellules de la blastula développent des cils sur leur surface externe, sécrètent une enzyme d’éclosion (hyalinase) et deviennent libres de nager.
Clivage amphibien
Le clivage chez de nombreux amphibiens est holoblastique avec une symétrie radiale, cependant le grand volume de vitellus (son mésolécithal) interfère avec le clivage. Au niveau du pôle animal, le premier clivage se déroule à environ 1 mm/min, tandis qu’au niveau du pôle végétal, il se déroule 50 à 100 fois plus lentement (.02 mm/min). Alors que le premier clivage est encore incomplet dans la région végétale jaune de l’œuf, le deuxième clivage méridien commence à avoir lieu.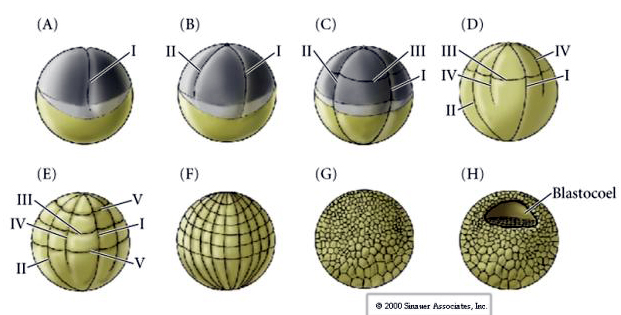
Le troisième clivage est équatorial, mais comme les noyaux et les astres sont déplacés vers l’animal, le plan de clivage bien que perpendiculaire à l’axe végétal animal est aussi déplacé vers le pôle animal et ne divise pas également les blastomères. Il en résulte quatre blastomères animaux plus petits (appelés MICROMÈRES) et quatre grands blastomères du pôle végétal (appelés MACROMÈRES). Ce clivage holoblastique inégal donne naissance à un pôle animal qui se divise plus rapidement, composé de micromères plus petits, et à un pôle végétal qui se divise plus lentement, composé de macromères. Le pôle animal est bientôt composé de nombreux petits micromères et le pôle végétal de quelques grands macromères remplis de vitellus. Bien que la formation du blastocèle commence avec le premier clivage, elle ne devient évidente qu’au stade de 128 cellules.
Quelle fonction remplit le blastocèle ?
Le blastocèle sépare spatialement les cellules afin qu’elles ne se touchent pas. Les cellules situées au toit du blastocœle deviennent normalement de l’ectoderme. Si vous transplantez des cellules du toit du blastocoel à côté des cellules jaunes de la base du blastocoel, elles se différencieront en mésoderme. Les dérivés mésodermiques sont normalement produits à partir de cellules adjacentes aux précurseurs endodermiques. Une possibilité que nous allons explorer en détail est que les cellules végétales induisent par des interactions cellule-cellule les cellules adjacentes à devenir mésodermiques. Ainsi, la formation du blastocoel peut être nécessaire pour empêcher des interactions « inductives » inappropriées entre les premières cellules du blastocyste. Le deuxième besoin évident pour le blastocoel peut être pendant le stade ultérieur du développement, la GASTRULATION, où les cellules migrent à l’intérieur du blastocoel.
CLIVAGE MAMMALIEN
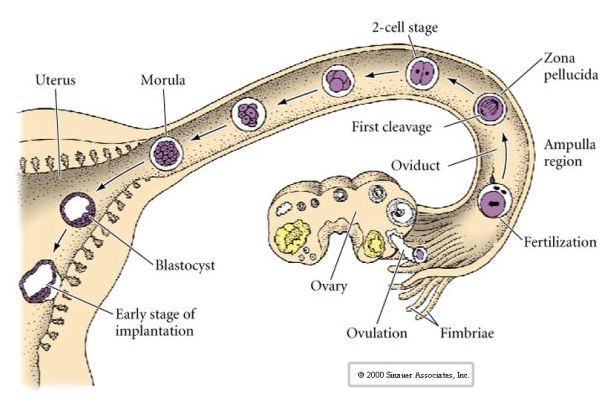
L’ovule de mammifère est libéré de l’ovaire dans l’oviducte où il est fécondé. Le premier clivage commence environ un jour après la fécondation dans l’oviducte. Contrairement à la plupart des animaux, le clivage chez les mammifères peut être très lent—1/jour.
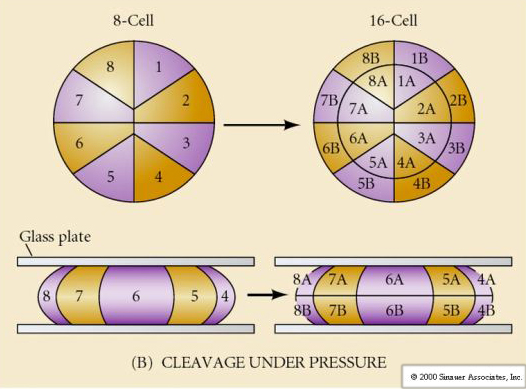
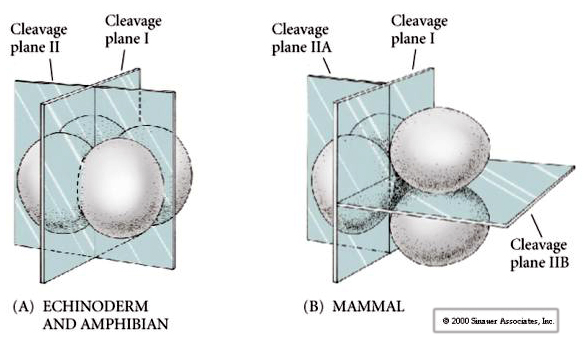 De plus, les plans de clivage sont quelque peu différents des autres animaux. Le premier clivage est méridional tout comme l’oursin et la grenouille. Cependant, la deuxième division de clivage voit l’un des blastomères se diviser méridiennement et l’autre équatorialement ! Ce type de clivage est appelé CLIVAGE HOLOBLASTIQUE ROTATIONNEL.
De plus, les plans de clivage sont quelque peu différents des autres animaux. Le premier clivage est méridional tout comme l’oursin et la grenouille. Cependant, la deuxième division de clivage voit l’un des blastomères se diviser méridiennement et l’autre équatorialement ! Ce type de clivage est appelé CLIVAGE HOLOBLASTIQUE ROTATIONNEL.
Une autre caractéristique unique du clivage des mammifères est que les clivages des blastomères sont asynchrones. (comparé à la synchronie de l’oursin et de la grenouille jusqu’à la transition midblastula). Le clivage de l’embryon de mammifère est régulé par le noyau zyotique dès le début.
Au cours du troisième clivage, les blastomères forment une boule de cellules vaguement associées, tout comme les autres animaux que nous avons étudiés. Avant le quatrième clivage, les cellules de la blastula changent radicalement leur comportement les unes envers les autres. Elles essaient rapidement de maximiser leurs contacts avec les autres blastomères et, ce faisant, provoquent la compaction de la blastula.

Cette COMPACTION résulte en partie de la production d’une nouvelle molécule d’adhésion, l’UVOMORULINE (E-Cadhérine), et est stabilisée par la formation de jonctions serrées entre les cellules externes qui, comme chez l’oursin, isolent l’intérieur de la blastula de l’extérieur. Les cellules forment également entre elles des jonctions lacunaires qui permettent le passage de petites molécules, comme les ions et certaines molécules de second messager comme le Ca++ et le C-AMP. La morula compacte de 16 cellules est constituée d’une croûte externe de cellules et de quelques cellules (1-2) complètement internes. La plupart des cellules externes donnent naissance aux CELLULES TROBLASTIQUES OU TROPHECTODERMALES. Ces cellules ne contribuent pas à l’embryon proprement dit, mais sont plutôt nécessaires à l’implantation de l’embryon dans la paroi utérine et forment les tissus du CHORIAN, un composant essentiel du placenta dont nous parlerons plus tard.
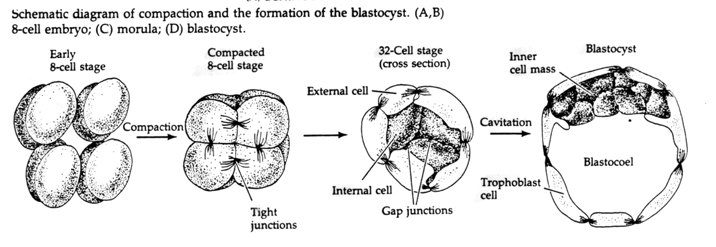
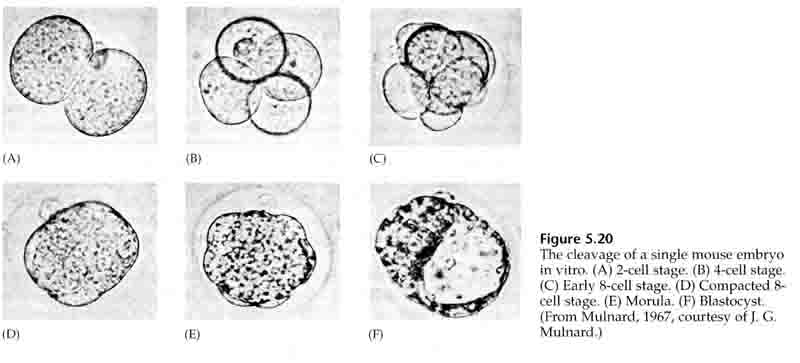
Les cellules de l’embryon sont dérivées des quelques cellules internes de la blastula au stade 16 cellules. Ces cellules génèrent la masse cellulaire interne à partir de laquelle l’embryon entier se développe. Au 6ème clivage, le stade 64 cellules, la masse cellulaire interne et la couche trophoblastique sont complètement séparées. Les trophoblastes sécrètent du liquide à l’intérieur pour créer le blastocœle. L’embryon est maintenant appelé un blastocyste.
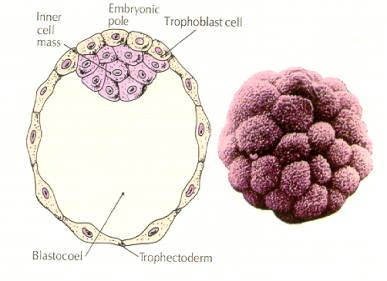 FORMATION DE LA MASSE cellulaire interne
FORMATION DE LA MASSE cellulaire interne
Comment sont créées ces cellules de la masse cellulaire interne ? Certains blastomères sont-ils destinés par des facteurs intrinsèques à devenir des progéniteurs de la masse cellulaire interne ? La réponse semble être non. Tous les blastomères précoces semblent être totipotents et la détermination des cellules qui contribueront à la couche trophoblastique et celles qui contribueront à la masse cellulaire interne est simplement une question de chance. Les cellules d’un embryon au stade 4 cellules, qui donneront normalement naissance à la fois à la masse cellulaire interne et aux cellules du trophectoderme, transplantées à l’extérieur d’un embryon au stade 32 cellules, ne donnent naissance qu’au trophectoderme. Elles ne contribuent pas à l’embryon proprement dit. Rappelez-vous, dans le cours précédent sur le clonage, que la fusion de deux embryons de souris de stade 8 cellules donne un embryon normal, ce qui suggère que toutes les cellules de ce stade sont totipotentes.
CLIVAGE Méroblastique
Dans les œufs télolécithal et centrolécithal, le vitellus dense et volumineux empêche le clivage. Les œufs télolécithes sont caractéristiques des oiseaux, des poissons et des reptiles tandis que les œufs centrolecithes sont caractéristiques des insectes. Les œufs télolécithaliques donnent lieu à un clivage discoïdal méroblastique. Le clivage est limité au blastodisque au pôle animal de l’œuf. Aux premiers clivages, parce que le clivage ne peut pas se faire à travers le vitellus, les blastomères sont continus au niveau de leurs marges végétales.
Ce film du développement du poisson zèbre parRolf Karlstrom est excellent. (Film de Paul Myers)
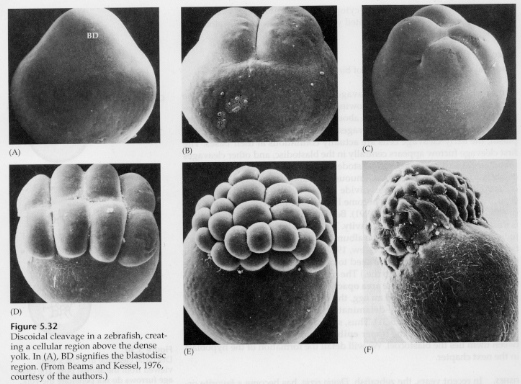 Ce n’est pas avant les clivages équatoriaux que les cellules du blastoderme se séparent du vitellus. D’autres clivages équatoriaux créent un blastoderme multicouche de trois ou quatre cellules d’épaisseur.
Ce n’est pas avant les clivages équatoriaux que les cellules du blastoderme se séparent du vitellus. D’autres clivages équatoriaux créent un blastoderme multicouche de trois ou quatre cellules d’épaisseur.
Chez les oiseaux, il se forme un espace entre le blastoderme et le vitellus appelé cavité SUBGERMINALE. Lors de la 16e division (60 000 cellules), les cellules du blastoderme migrent dans la cavité subgerminale pour former une deuxième couche. Les deux couches sont appelées EPIBLAST externe et HYPOBLAST interne, avec le blastocœle entre les deux. Nous étudierons ce phénomène plus en détail plus tard lorsque nous aborderons la gastrulation des oiseaux et des mammifères
Les œufs centrolecitaux des arthropodes subissent un CLEAVAGE SUPERFICIEL. La grande masse centrale de vitellus confine les clivages au bord cytoplasmique de l’œuf.
Une variation intéressante et instructive est observée chez les insectes. Les noyaux zygotiques se divisent sans clivage. C’est-à-dire que les noyaux subissent une caryokinèse—- division mitotique du noyau— sans cytokinèse–la division de la cellule. Ces noyaux nus sont appelés ENERGIDS. Les noyaux se divisent à une vitesse étonnante—toutes les 8 minutes (toute l’embryogenèse ne dure que 22 h).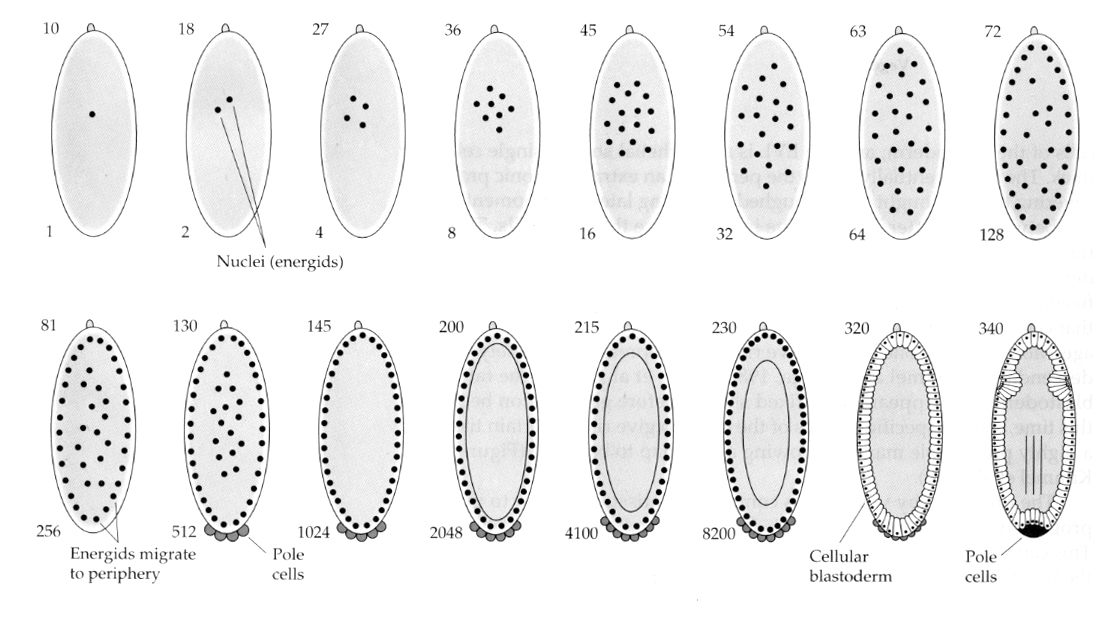
 Après plusieurs cycles de caryokinèse, les noyaux nus migrent vers la périphérie de l’œuf. A ce stade, on parle de BLASTODERM SYNCYTIQUE car tous les noyaux partagent le même cytoplasme. La cellularisation se produit à peu près à la 14e division nucléaire pour créer le BLASTODERME CELLULAIRE. Après cette période, les cellules se divisent de manière asynchrone. Cela correspond à la transition midblastula des grenouilles et des oursins. (Rappelez-vous que l’on pensait que la transition midblastula était déclenchée par le rapport entre la chromatine et le cytoplasme. La preuve de ce mécanisme chez la mouche est apportée par l’examen d’embryons haploïdes mutants. Ces embryons subissent la transition midblastula et la cellularisation une division plus tard 15. De plus, vous pouvez accélérer la cellularisation en ligaturant l’œuf et en réduisant le volume de cytoplasme. Bien que le stade de blastoderme syncytial suggère que tous les noyaux sont équipotents en ce sens qu’il ne semble pas y avoir de barrières de diffusion aux déterminants cytoplasmiques, en fait le cytoplasme est très régionalisé et les noyaux ont des domaines cytoplasmiques très organisés autour d’eux.
Après plusieurs cycles de caryokinèse, les noyaux nus migrent vers la périphérie de l’œuf. A ce stade, on parle de BLASTODERM SYNCYTIQUE car tous les noyaux partagent le même cytoplasme. La cellularisation se produit à peu près à la 14e division nucléaire pour créer le BLASTODERME CELLULAIRE. Après cette période, les cellules se divisent de manière asynchrone. Cela correspond à la transition midblastula des grenouilles et des oursins. (Rappelez-vous que l’on pensait que la transition midblastula était déclenchée par le rapport entre la chromatine et le cytoplasme. La preuve de ce mécanisme chez la mouche est apportée par l’examen d’embryons haploïdes mutants. Ces embryons subissent la transition midblastula et la cellularisation une division plus tard 15. De plus, vous pouvez accélérer la cellularisation en ligaturant l’œuf et en réduisant le volume de cytoplasme. Bien que le stade de blastoderme syncytial suggère que tous les noyaux sont équipotents en ce sens qu’il ne semble pas y avoir de barrières de diffusion aux déterminants cytoplasmiques, en fait le cytoplasme est très régionalisé et les noyaux ont des domaines cytoplasmiques très organisés autour d’eux.
Mécanismes de clivage
Cycle cellulaire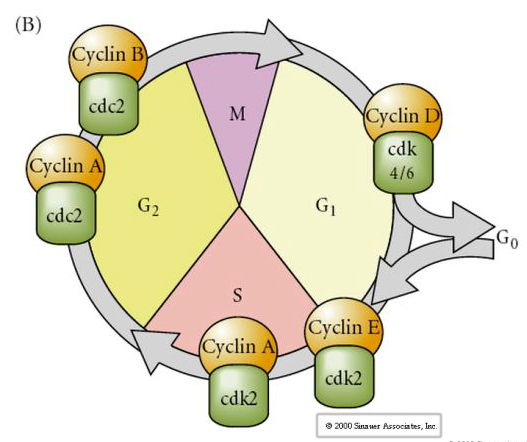
M-mitose
G1- écart de pré-réplication
S- synthèse d’ADN
G2- écart de prémitose
Dans les embryons au stade de clivage tels que les grenouilles et les mouches, les blastomères passent directement de M à S sans intervenir dans les stades G1 ou G2. Après la transition midblastula, les cellules des deux animaux présentent un stade G1 et G2. Des expériences de transplantation élégante ont démontré que c’est le cytoplasme qui régule à la fois la caryokinèse et la cytokinèse. Si des noyaux de cellules en division sont transplantés dans un ovocyte, ils cessent immédiatement de se diviser.
 A l’inverse, si des noyaux de cellules non-divisées sont mis dans des œufs énucléés fécondés, ils commencent à se diviser. Les œufs énucléés activés artificiellement et dépourvus de centrioles subissent des contractions corticales qui rappellent le clivage. Certains des facteurs cytoplasmiques régulant la division cellulaire dans l’embryon précoce ont été identifiés.
A l’inverse, si des noyaux de cellules non-divisées sont mis dans des œufs énucléés fécondés, ils commencent à se diviser. Les œufs énucléés activés artificiellement et dépourvus de centrioles subissent des contractions corticales qui rappellent le clivage. Certains des facteurs cytoplasmiques régulant la division cellulaire dans l’embryon précoce ont été identifiés.
Le facteur cytostatique (CSF) est élevé après la première division méiotique et arrête l’ovocyte dans la deuxième métaphase méiotique. Lors de la fécondation, le Ca inactive le CSF, la méiose est achevée et les pronucléus fusionnent.
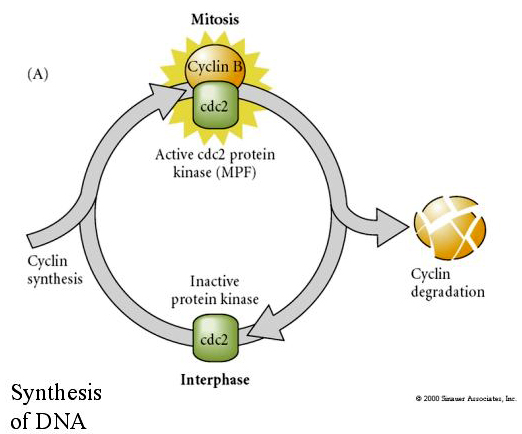
Le facteur promoteur de la méiose (MPF) fait entrer les cellules en phase M. L’activation du MPF provoque : 1. la condensation des chromosomes par la phosphorylation des histones H1, 2. la rupture de l’enveloppe nucléaire par l’hyperphosphorylation des 3 lamines nucléaires, 3. l’inhibition de l’ARN polymérase pour arrêter la transcription, 4. la phosphorylation de la sous-unité régulatrice de la myosine pour inhiber la cytokinèse.
Modèle suggéré pour la régulation cyclique du cycle cellulaire pendant les étapes de clivage de l’embrogénèse. Le MPF induit la cellule à passer de S à M. Le CSF se lie au MPF et empêche son inactivation. La cellule reste en M. Le Ca augmente et provoque l’inactivation du CSF qui à son tour entraîne l’inactivation du MPF et la cellule passe de M à S et le cycle se répète. Le MPF est composé de deux sous-unités, la cycline B et la cdc2. C’est la cycline B qui subit une synthèse et une dégradation spécifiques au cycle cellulaire, régulées par le noyau des cellules pour contrôler le cycle cellulaire dans les cellules somatiques normales. Cependant, au cours de l’ovogenèse, l’œuf est chargé de « régulateurs » de la cycline B et de l’ARNm de la cycline B de sorte que sa synthèse est régulée par des facteurs maternels indépendants du noyau zygotique. Ainsi, ce n’est que lorsque les composants maternels « s’épuisent » que le noyau zygotique prend le relais et qu’un cycle cellulaire normal (M, G1, S, G2) revient.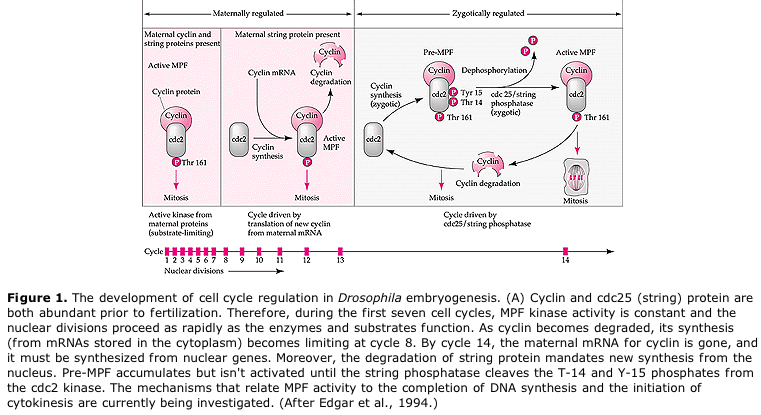
Détermination du destin cellulaire
Localisation cytoplasmique des déterminants comme mécanisme général et fondamental de la structuration précoce (Exemples Tunicier et Oursin). Une question majeure de la biologie du développement est de savoir quand et comment les destins cellulaires sont déterminés au cours du développement. Cette question est intimement liée à celle de savoir comment la formation des motifs se produit au cours du développement. L’embryon doit non seulement générer le bon nombre et le bon type de cellules différenciées, mais celles-ci doivent être organisées de manière correcte par rapport à toutes les autres cellules de l’embryon pour former un animal fonctionnel. Nous allons examiner deux possibilités de détermination du destin cellulaire et de formation du modèle : 1. Le sort des cellules pourrait être déterminé par des facteurs intrinsèques placés dans l’œuf pendant l’ovogenèse, puis répartis entre des blastomères spécifiques pendant le clivage. 2. Des signaux extrinsèques fournis par l’environnement de l’embryon pourraient fournir les informations de structuration permettant de réguler le sort des cellules. Comme nous le verrons, la plupart des organismes complexes utilisent une combinaison de signaux intrinsèques et extrinsèques pour réguler le destin cellulaire et la formation du patron embryonnaire.
La spécification autonome du destin cellulaire par des déterminants cytoplasmiques suggère que le destin d’une cellule dépend entièrement de sa lignée, alors que le développement « régulateur » suggère que le destin d’une cellule est déterminé par des signaux externes provenant d’autres cellules. Ces deux mécanismes de spécification cellulaire peuvent être distingués expérimentalement par des expériences d’isolement, d’ablation et de transplantation. Si un blastère isolé d’un embryon se différencie normalement (comme s’il était toujours dans sa position normale dans l’embryon), nous pouvons dire qu’il doit avoir des déterminants intrinsèques qui spécifient son destin. En revanche, s’il se différencie anormalement, nous pouvons dire que son destin cellulaire dépend de signaux externes. Si nous procédons à l’ablation d’un blastomère d’un embryon et que l’embryon se développe anormalement, manquant tous les destins cellulaires qui découlent normalement du blastomère ablaté, nous disons que le développement est autonome et intrinsèquement spécifié. En revanche, si l’embryon se développe normalement, nous disons que les blastomères restants peuvent réguler leur destin cellulaire pour compenser les cellules manquantes. Si une cellule transplantée maintient son destin cellulaire en fonction de sa position initiale, alors nous disons que son destin a été déterminé, si elle prend un nouveau destin en fonction de sa position nouvellement transplantée, nous disons que son destin est régulé par des signaux externes provenant de cellules voisines.
Localisation et régulation cytoplasmique dans l’œuf de tunicier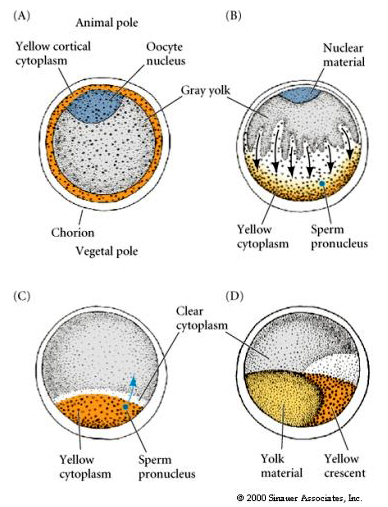
À la fin de l’ovogenèse, l’œuf de tunicier présente un pôle animal et un pôle végétal clairement distingués. Il y a un cytoplasme cortical jaune qui entoure un cytoplasme interne gris jaunâtre. Le noyau de l’ovocyte est déplacé vers le pôle animal. L’entrée du spermatozoïde dans l’hémisphère végétal féconde l’ovocyte et initie le développement. Un réarrangement spectaculaire du cytoplasme de l’œuf se produit après la fécondation donnant lieu à des cytoplasmes colorés par région qui semblent être en corrélation avec les destins ultérieurs des blastomères.
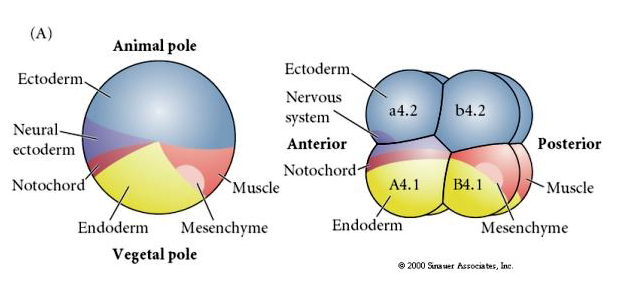 Notez que la carte du destin est en corrélation avec les différents cytoplasmes colorés de l’embryon de tunicier. Ne soyez pas confus par les différentes couleurs dans deux figures. Le cytoplasme en forme de croissant jaune « orange » est corrélé aux destins musculaires et le cytoplasme yolké (jaune) est corrélé aux destins endodermiques. Le cytoplasme gris (blanc ou violet bleuté) au-dessus du croissant jaune est corrélé à l’ectoderme neural.
Notez que la carte du destin est en corrélation avec les différents cytoplasmes colorés de l’embryon de tunicier. Ne soyez pas confus par les différentes couleurs dans deux figures. Le cytoplasme en forme de croissant jaune « orange » est corrélé aux destins musculaires et le cytoplasme yolké (jaune) est corrélé aux destins endodermiques. Le cytoplasme gris (blanc ou violet bleuté) au-dessus du croissant jaune est corrélé à l’ectoderme neural.
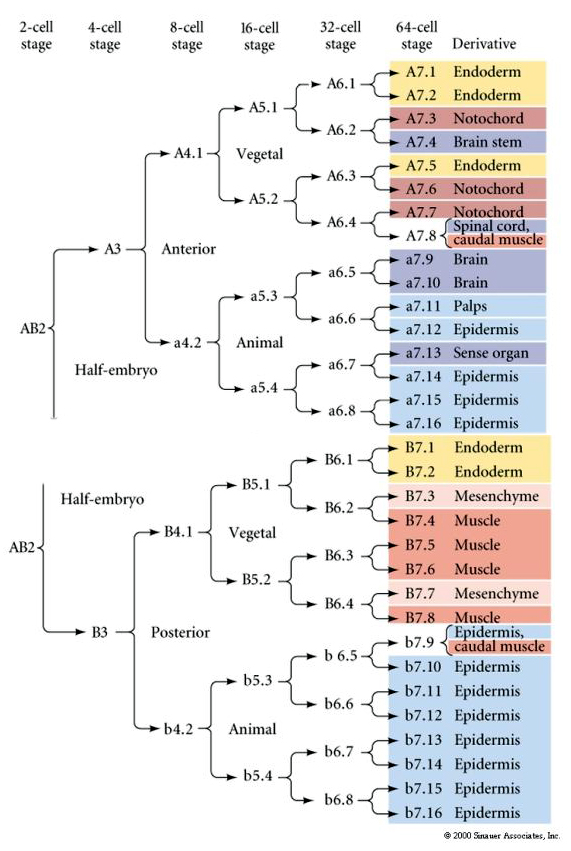 Cette carte de lignage montre la corrélation de lignage invariant avec des blastomères parcellisés cytoplasmes colorés particuliers par les clivages cellulaires invariants. Cependant, les clivages et lignages invariants ne prouvent pas nécessairement une spécification cellulaire autonome par des déterminants cytoplasmiques.
Cette carte de lignage montre la corrélation de lignage invariant avec des blastomères parcellisés cytoplasmes colorés particuliers par les clivages cellulaires invariants. Cependant, les clivages et lignages invariants ne prouvent pas nécessairement une spécification cellulaire autonome par des déterminants cytoplasmiques.
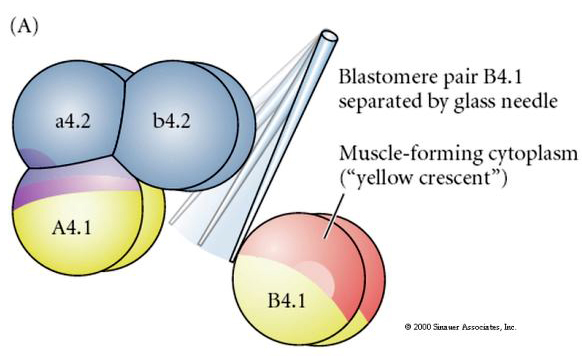 Des manipulations expérimentales sont nécessaires pour tester la détermination régulatrice versus autonome du destin cellulaire. Les expériences classiques d’isolement présentées dans les trois figures suivantes tentent de montrer que le destin cellulaire est déterminé par des déterminants cytoplasmiques qu’ils acquièrent par clivage des stéréotypes. Une aiguille en verre est utilisée pour séparer la paire de blastomères B4.1 du reste de l’embryon. Les blastomères B4.1 acquièrent normalement le cytoplasme jaune crécent corrélé au destin des cellules musculaires.
Des manipulations expérimentales sont nécessaires pour tester la détermination régulatrice versus autonome du destin cellulaire. Les expériences classiques d’isolement présentées dans les trois figures suivantes tentent de montrer que le destin cellulaire est déterminé par des déterminants cytoplasmiques qu’ils acquièrent par clivage des stéréotypes. Une aiguille en verre est utilisée pour séparer la paire de blastomères B4.1 du reste de l’embryon. Les blastomères B4.1 acquièrent normalement le cytoplasme jaune crécent corrélé au destin des cellules musculaires.
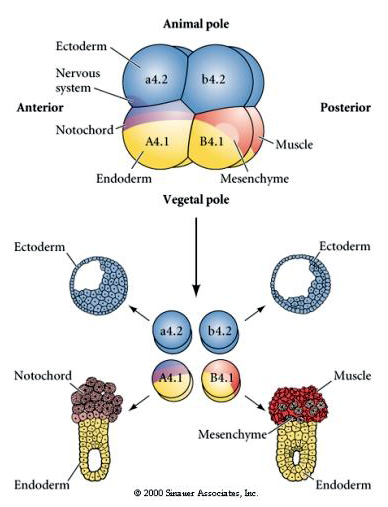
Voici les résultats des expériences d’isolement. Dans chaque cas, les blastomères isolés ne donnent naissance qu’au sous-ensemble de destins cellulaires qu’ils produiraient normalement dans l’embryon intact. Les blastomères isolés ne régulent pas leur destin pour compenser l’absence de leurs voisins. Les blastomères du pôle animal, a4.2 et b4.2, ne donnent naissance qu’à des cellules ectodermiques. A4.1 donne naissance à des cellules de la notocorde et de l’endoderme, tandis que B4.1 donne naissance à des cellules musculaires et endodermiques. Aucun des blastomères isolés ne peut donner naissance à tous les composants cellulaires d’un embryon normal.
L’expérience suivante, ci-dessous, utilise une aiguille pour manipuler le plan de clivage équatorial afin qu’il soit plus végétal que la normale et maintenant les blastomères du pôle animal, b4.2, acquièrent une partie du cytoplasme du « croissant jaune ». Lorsque ces blastomères sont isolés, ils donnent naissance à des cellules musculaires. Cela démontre joliment que le cytoplasme « croissant jaune » peut déterminer le destin des cellules musculaires et peut le faire d’une manière cellulaire autonome.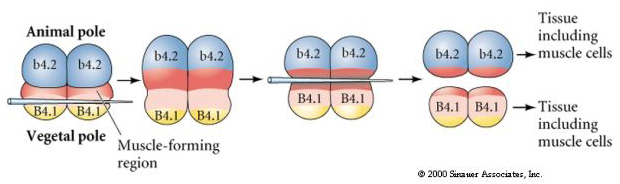
LOCALISATION ET REGULATION DANS L’OEUF D’URCHINE DE MER
Un canal gélatineux définit l’emplacement du pôle animal et reflète la polarité précoce de l’œuf. Le schéma précoce des clivages ne dépend pas du site d’entrée du sperme, mais sont déterminés par la polarité/asymétrie intrinsèque de l’œuf. Boveri (1901) a décrit une bande subéquatoriale de pigment disposée orthogonalement à l’axe animal-végétal. Ces granules indiquaient également l’emplacement du cytoplasme qui est ensuite inclus dans les cellules de l’archentéron. Horstadius (1928) a séparé les blastomères animaux et végétaux et a montré que seul le blastomère végétal pouvait donner naissance à des micromères, se gastruler et former un squelette. Sa conclusion était que les facteurs cytoplasmiques situés dans la moitié végétale sont nécessaires aux micromères, à la gastrulation et à la formation de l’archentéron, ainsi qu’à la formation du squelette. Rappelons-nous le schéma des premiers clivages. Les micromères apparaissent au cours du quatrième clivage (stade 16 cellules) à partir d’une division équatoriale inégale des blastomères du pôle végétal.
Rappelons-nous le schéma des premiers clivages. Les micromères apparaissent au cours du quatrième clivage (stade 16 cellules) à partir d’une division équatoriale inégale des blastomères du pôle végétal.
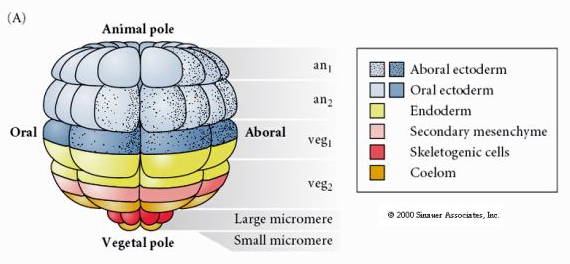 Voici la carte du destin de la blastula d’oursin au stade 64 cellules. Remarquez que les micromères sont les cellules primaires du mésenchyme et donnent naissance au squelette larvaire (les spicules du stade pluteus).
Voici la carte du destin de la blastula d’oursin au stade 64 cellules. Remarquez que les micromères sont les cellules primaires du mésenchyme et donnent naissance au squelette larvaire (les spicules du stade pluteus).
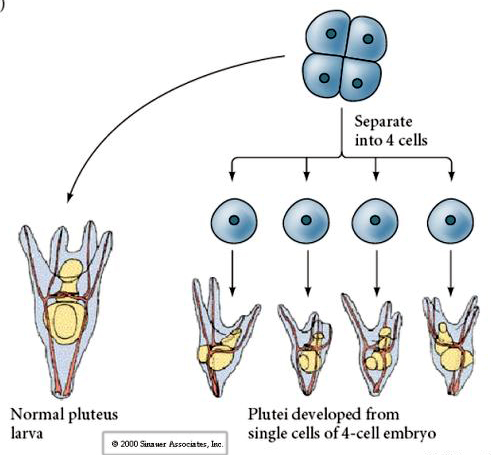 Au stade de quatre cellules, si les blastomères sont isolés les uns des autres, ils sont capables de « réguler » leur destin et donnent naissance à 4 petites larves du stade pluteus.
Au stade de quatre cellules, si les blastomères sont isolés les uns des autres, ils sont capables de « réguler » leur destin et donnent naissance à 4 petites larves du stade pluteus.
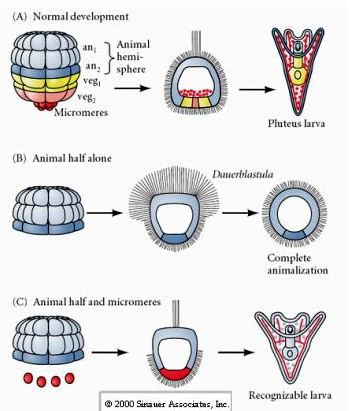 En revanche, aux stades ultérieurs, si vous isolez des demi-blastomères animaux, vous constatez qu’ils ne produisent qu’une dauerblastula « animalisée » qui n’exprime aucun destin cellulaire mésodermique ou endodermique. Les demi-blastomères végétaux isolés donnent naissance à des larves qui expriment des destins cellulaires ectodermiques, mésodermiques et endodermiques, ce qui montre que le destin de ces cellules peut être régulé. Les micromères isolés (mésenchyme primaire) subissent le nombre correct de divisions cellulaires et donnent TOUJOURS naissance à des spicules au moment prévu. Ainsi, les micromères sont définitivement désignés comme les précurseurs des cellules du mésenchyme squelettique lorsqu’ils apparaissent pour la première fois au stade de 16 cellules. Les expériences clés ont consisté à mettre les micromères en contact avec les blastomères du pôle animal et à montrer que, bien que le destin des micromères soit « fixé ou déterminé » au moment de leur naissance, les micromères sont capables d' »induire » de nouveaux destins cellulaires dans les blastomères du pôle animal. Les micromères étaient capables d’induire des destins endodermiques et mésodermiques dans les blastomères du pôle animal ! Ainsi, l’expérience tardive en « C » montre que lorsque les micromères sont ajoutés à une demi blastula animale, vous pouvez maintenant induire la formation d’une larve reconnaissable exprimant des fates endodermiques, mésodermiques et ectodermiques.
En revanche, aux stades ultérieurs, si vous isolez des demi-blastomères animaux, vous constatez qu’ils ne produisent qu’une dauerblastula « animalisée » qui n’exprime aucun destin cellulaire mésodermique ou endodermique. Les demi-blastomères végétaux isolés donnent naissance à des larves qui expriment des destins cellulaires ectodermiques, mésodermiques et endodermiques, ce qui montre que le destin de ces cellules peut être régulé. Les micromères isolés (mésenchyme primaire) subissent le nombre correct de divisions cellulaires et donnent TOUJOURS naissance à des spicules au moment prévu. Ainsi, les micromères sont définitivement désignés comme les précurseurs des cellules du mésenchyme squelettique lorsqu’ils apparaissent pour la première fois au stade de 16 cellules. Les expériences clés ont consisté à mettre les micromères en contact avec les blastomères du pôle animal et à montrer que, bien que le destin des micromères soit « fixé ou déterminé » au moment de leur naissance, les micromères sont capables d' »induire » de nouveaux destins cellulaires dans les blastomères du pôle animal. Les micromères étaient capables d’induire des destins endodermiques et mésodermiques dans les blastomères du pôle animal ! Ainsi, l’expérience tardive en « C » montre que lorsque les micromères sont ajoutés à une demi blastula animale, vous pouvez maintenant induire la formation d’une larve reconnaissable exprimant des fates endodermiques, mésodermiques et ectodermiques.
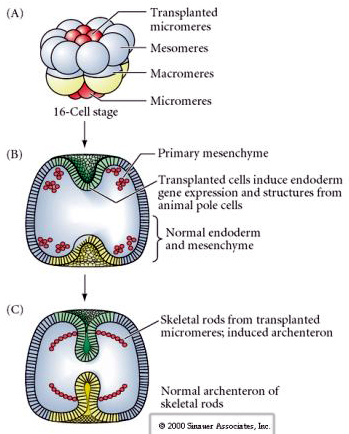 La dernière série d’expériences démontre que même dans un embryon normal, si vous transplantez des micromères à la calotte du pôle animal, vous pouvez induire un archentéron secondaire et altérer le patterning axial normal. Cela prouve une fois de plus que les micromères acquièrent un derminant cytoplasmique qui spécifie leur destin cellulaire et qu’ils fournissent le signal inductif qui modèle les structures axiales de l’embryon d’oursin. Le destin des micromères ne peut être modifié, mais les signaux provenant des micromères peuvent modifier le destin de tous les autres blastomères.
La dernière série d’expériences démontre que même dans un embryon normal, si vous transplantez des micromères à la calotte du pôle animal, vous pouvez induire un archentéron secondaire et altérer le patterning axial normal. Cela prouve une fois de plus que les micromères acquièrent un derminant cytoplasmique qui spécifie leur destin cellulaire et qu’ils fournissent le signal inductif qui modèle les structures axiales de l’embryon d’oursin. Le destin des micromères ne peut être modifié, mais les signaux provenant des micromères peuvent modifier le destin de tous les autres blastomères.
Horstadius : (1928, 1935) a montré expérimentalement que dans un embryon de stade 16 cellules, tous les étages de blastomères, à l’exception des micromères, prennent des destins différents lorsqu’ils sont transplantés dans différentes positions dans des embryons chimériques. L’archentéron se développera à partir des blastomères de veg 1 si les cellules de veg 2 sont retirées et si les micromères sont placés en contact avec la couche de veg 1. En l’absence de micromères, les blastomères veg 2 donnent naissance à l’archentéron et aux structures squelettiques. Classiquement, un gradient duel animal-végétal a été invoqué pour rendre compte de ces résultats. Cependant, ces résultats indiquent seulement que des interactions inductives décisives se produisent entre les niveaux de blastomères adjacents.
Les micromères individuels implantés près du pôle animal inhibent la formation de la touffe apicale et dans certains cas induisent un nouvel axe embryonnaire. Les blastomères Veg 2 induisent également des changements similaires aux micromères lorsqu’ils sont transplantés à côté des blastomères du pôle animal.
RÉSULTAT GÉNÉRAL DES TRANSPLANTATIONS : le sort de blastomères donnés se trouve toujours affecté par l’apposition de différentes cellules voisines qui les jouxtent dans les embryons normaux.
HYPOTHÈSE : Des déterminants cytoplasmiques maternels localisés spécifient certaines cellules de l’embryon normal, en particulier les micromères et les précurseurs de l’archentéron près du pôle végétal. Ces cellules déterminent ensuite par induction le destin des blastomères voisins, qui interagissent à leur tour avec leurs voisins. De nombreux blastomères conservent des potentialités autres que celles qu’ils expriment normalement, et pendant un certain temps, ces blastomères ne sont spécifiés que de manière réversible, comme l’exige un système de développement qui dépend dans une large mesure de l’induction.