Cleavage bezieht sich auf das stereotype Muster der frühen mitotischen Teilungen, die das große Volumen des Zytoplasmas der Eizelle aufteilen. Die frühe Zygote ist einzigartig, weil sie so groß ist. Die meisten Zellen machen zwischen den Mitosezyklen eine Wachstumsphase durch, aber das gilt nicht für Blastomere im frühen Spaltstadium. Mit jeder Teilung werden die Zellen kleiner. Dieses rasche Muster der Zellteilung ohne gleichzeitiges Wachstum endet abrupt in dem Stadium, das als mittlerer Blastula-Übergang bezeichnet wird und in dem der zygotische Kern die Kontrolle über den Zellzyklus übernimmt.
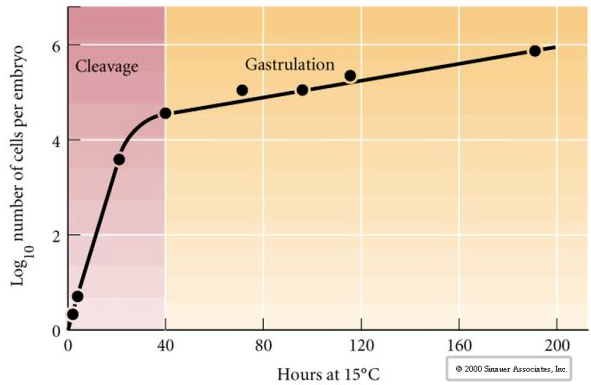 Es gibt einige Hinweise darauf, dass ein mütterlicher Faktor, vielleicht ein Transkriptionsregulator, für dieses frühe rasche Muster der Spaltungsteilungen verantwortlich ist. Durch künstliche Veränderung des Verhältnisses von zytoplasmatischer zu nukleärer DNA kann der Zeitpunkt des Midblastula-Übergangs verändert werden. Der Midblastula-Übergang bezieht sich auf den Zeitpunkt, an dem der Hauptwechsel von der Expression mütterlicher zu zygotischen Genen stattfindet.
Es gibt einige Hinweise darauf, dass ein mütterlicher Faktor, vielleicht ein Transkriptionsregulator, für dieses frühe rasche Muster der Spaltungsteilungen verantwortlich ist. Durch künstliche Veränderung des Verhältnisses von zytoplasmatischer zu nukleärer DNA kann der Zeitpunkt des Midblastula-Übergangs verändert werden. Der Midblastula-Übergang bezieht sich auf den Zeitpunkt, an dem der Hauptwechsel von der Expression mütterlicher zu zygotischen Genen stattfindet.
Die Befruchtung führt bei einigen Arten zu radikalen zytoplasmatischen Bewegungen, die wesentlich dafür sind, dass sich die zytoplasmatischen Determinanten an den richtigen Positionen im Verhältnis zu den nachfolgenden Spaltungsereignissen befinden.
Muster der embryonalen Spaltung
Das Muster der embryonalen Spaltung wird sowohl durch die Position der mitotischen Spindeln als auch durch die Menge und Verteilung des Dottersacks bestimmt. Dotter hemmt tendenziell die Spaltung. Er verlangsamt sie oder verhindert sogar die vollständige Spaltung. Der Dotter ist eine Anpassung der Tiere, die die Embryogenese mehr oder weniger isoliert von jeglicher Nahrungszufuhr durchlaufen. Einige Tiere, wie der Seeigel, haben relativ wenig Dotter, weil sie sich schnell zu einer freischwimmenden Larvenform entwickeln, die sich Nährstoffe aus ihrer Umgebung holt. Andere Tiere wie die Beuteltiere werden zu früh geboren, werden aber in einem elterlichen Beutel mit Nährstoffen versorgt. Plazenta-Säugetiere entwickeln ein spezialisiertes Organ, durch das der Embryo während der gesamten Entwicklung ernährt wird, und haben daher auch wenig Dotter.
Die Arten von Eiern, die auf den Dottermerkmalen basieren, werden wie folgt beschrieben:
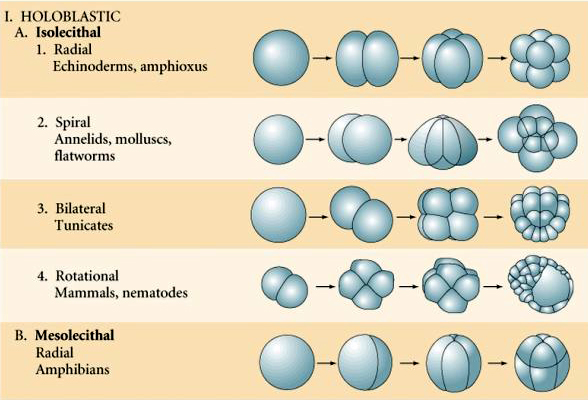
Isolezithal: spärlicher, gleichmäßig verteilter Dotter, z. B. Seeigel, Maus
Mesolecthal: mäßige Menge an Dotter, oft ungleichmäßig verteilt, z. B., Frosch
Telolecithal: dichter, an einem Ende konzentrierter Dotter, z.B. Vogel, Reptil
Centrolecithal: in der Mitte des Eies konzentrierter Dotter, z.B. Fliege
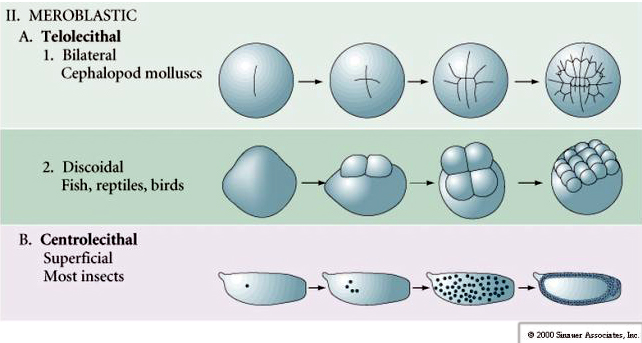
Viele Eier sind polarisiert mit einem dotterreichen Pol, der als vegetabiler Pol bezeichnet wird, und einem dotterarmen Pol, der als tierischer Pol bezeichnet wird, z.B. Frosch. Der Zygotenkern ist im Allgemeinen in Richtung des tierischen Pols verschoben. Zygoten mit relativ wenig Dotter (isolezithal und mesolezithal) spalten sich HOLOBLASTISCH. Die Spaltfurche erstreckt sich durch das ganze Ei hindurch. Telolezithale und zentrolezithale Zygoten werden MEROBLASTISCH gespalten, wobei sich die Spaltfurche nur bis zum angesammelten Dotter erstreckt. Bei zentrolezithalen Eiern (viele Insekteneier) ist die Spaltung meroblastisch und oberflächlich, während bei telolezithalen Eiern (Vögel und Fische) die Spaltung scheibenförmig ist
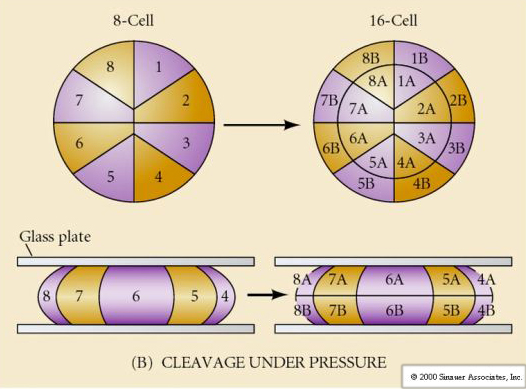
In der Natur gibt es verschiedene Arten von Spaltsymmetrie: radial (Stachelhäuter, Amphibien), spiralförmig (Weichtiere, Ringelwürmer), bilateral (Aszidien, Manteltiere), rotatorisch (Säugetiere). Die beiden folgenden Abbildungen zeigen Beispiele für holoblastische und meroblastische Spaltungssymmetrien.
RADIALE HOLOBLASTISCHE SPALTUNG
Exzellenter Film der Seeigelspaltung aus Rachel Finks „A Dozen Eggs“.
Seeigel haben auch radiale holoblastische Spaltung, aber mit einigen interessanten Unterschieden. Die erste Spaltung ist meridional, die zweite Spaltung ist meridional. Die vierte Spaltung ist meridional, aber während sich die vier Zellen des tierischen Pols gleichmäßig teilen, um acht gleich große tierische Blastomere, die so genannten MESOMERES, zu bilden, teilen sich die pflanzlichen Zellen asymmetrisch entlang der Äquatorialebene, um vier große MACROMERES und vier viel kleinere MICROMERES am pflanzlichen Pol zu bilden. Bei der fünften Teilung teilen sich die MESOMERES äquatorial und bilden zwei Schichten von acht MESOMERES an1 und an2, die MACROMERES teilen sich meridional und bilden eine Schicht von acht Zellen unterhalb von an2, die MICROMERES teilen sich und bilden einen Zellhaufen unterhalb der veg1-Schicht. Die sechste Teilung erfolgt äquatorial, wodurch die Schicht veg2 entsteht. Die siebte Teilung erfolgt meridional, so dass eine 128-zellige Blastula entsteht.
Was bestimmt diese Spaltungsmuster? Sind sie von der vorangegangenen Teilung abhängig und werden wie ein Tonband abgespielt, oder werden sie von einer intrinsischen Uhr bestimmt? 1939 hemmte Horstadius eine oder zwei der ersten drei Spaltungen und stellte fest, dass das Auftreten der Mikromere zum richtigen Zeitpunkt erfolgte, unabhängig von der Vorgeschichte der Spaltungen
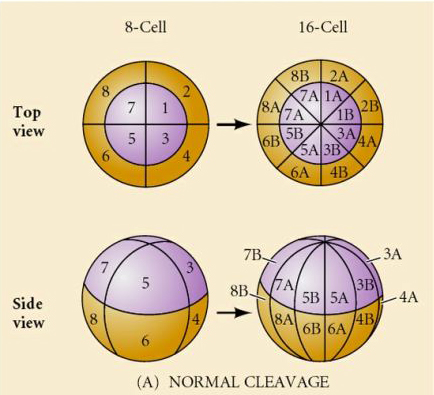
Die Schlussfolgerung aus diesen Experimenten ist, dass es irgendeinen Faktor im vegetativen Pol der Eizelle gibt, der die Bildung der Mikromere bestimmt, und weiter, dass es eine molekulare Uhr geben muss, die bei der Aktivierung der Eizelle beginnt. Die Uhr ist unabhängig von der eigentlichen Spaltung.
Die 128-Zellen-Blastula ist ein eher loser Zellball, der ein hohles Blastocoel umgibt. Die Kugel ist eine Zellschicht dick, wobei alle Zellen in Kontakt mit der äußeren hyalinen Schicht und der inneren Flüssigkeit des Blastocoels stehen. In diesem Entwicklungsstadium beginnen die Zellen, die für ein Epithel charakteristischen „tight junctions“ zu bilden. Das zentrale Blastocoel ist nun von der äußeren Umgebung isoliert. Die Blastomere teilen sich weiterhin mit ihrer Achse parallel zur hyalinen Schicht und bleiben ein Epithel mit einer Zelldicke. Das Blastocoel vergrößert sich weiter.
Zwei Theorien versuchen, das Muster der Vergrößerung der Blastozyste zu erklären
1. Die osmotische Theorie besagt, dass Ionen und Proteine von den Blastomeren in das Blastocoel sezerniert werden, was zu einem Druckaufbau durch den osmotischen Wasserfluss führt. Dieser Druck wäre dann für die Ausrichtung der Mitoseachse der Blastomere und die Vergrößerung des Blastocoels verantwortlich.
2. Die alternative Theorie von Wolpert und seinen Kollegen besagt, dass es tatsächlich die adhäsiven Wechselwirkungen zwischen den Blastomeren und zwischen den Blastomeren und der hyalinen Schicht sind, die die Mitoseachse ausrichten. Das heißt, die Adhäsion an der hyalinen Schicht ist am größten, die Adhäsion an anderen Blastomeren ist die nächste, und schließlich ist die Interaktion mit der Blastocoelwand am geringsten. Die dominante Adhäsion mit der hyalinen Schicht erzwingt die Ausdehnung der Blastozyste und des Blastocoels.
Die Zellen der Blastula bilden auf ihrer äußeren Oberfläche Zilien aus, sezernieren ein Schlupfenzym (Hyalinase) und werden freischwimmend.
AMPHIBISCHE SPALTUNG
Die Spaltung bei vielen Amphibien ist holoblastisch mit radialer Symmetrie, jedoch behindert das große Volumen des Dotters (sein Mesolecithal) die Spaltung. Am tierischen Pol erfolgt die erste Spaltung mit etwa 1 mm/min, während sie am pflanzlichen Pol 50-100 mal langsamer abläuft (.02 mm/min). Während die erste Spaltung in der dotterigen vegetabilen Region der Eizelle noch unvollständig ist, beginnt die zweite meridionale Spaltung.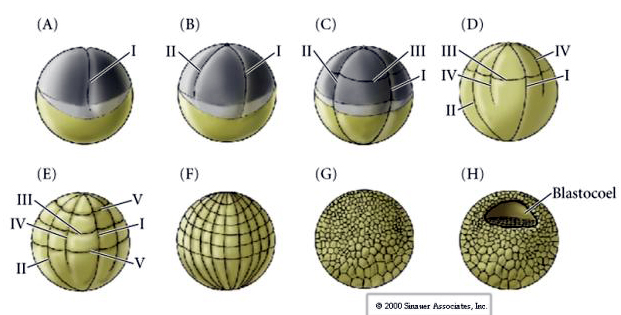
Die dritte Spaltung ist äquatorial, aber da die Kerne und Sternchen zum tierischen Pol hin verschoben sind, ist die Spaltungsebene zwar senkrecht zur vegetabilen Achse des Tieres, aber auch zum tierischen Pol hin verschoben und teilt die Blastomere nicht gleichmäßig auf. Das Ergebnis sind vier kleinere tierische Blastomere (als MICROMERES bezeichnet) und vier große Blastomere des vegetativen Pols (als MACROMERES bezeichnet). Durch diese ungleiche holoblastische Spaltung entsteht ein sich schneller teilender tierischer Pol, der aus kleineren Mikromeren besteht, und ein sich langsamer teilender pflanzlicher Pol, der aus Makromeren besteht. Der tierische Pol besteht bald aus vielen kleinen Mikromeren und der pflanzliche Pol aus einigen dottergefüllten großen Makromeren. Obwohl die Bildung des Blastocoels mit der ersten Spaltung beginnt, wird sie erst im 128-Zell-Stadium deutlich.
Welche Funktion hat das Blastocoel?
Das Blastocoel trennt die Zellen räumlich voneinander, so dass sie sich nicht berühren. Die Zellen am Dach des Blastocoels werden normalerweise zu Ektoderm. Wenn man Zellen vom Dach des Blastocoels neben die dotterartigen Zellen an der Basis des Blastocoels verpflanzt, differenzieren sie sich als Mesoderm. Mesoderm-Derivate werden normalerweise aus Zellen gebildet, die an die endodermalen Vorläuferzellen angrenzen. Eine Möglichkeit, die wir eingehend untersuchen werden, besteht darin, dass die vegetabilen Zellen über Zell-Zell-Interaktionen die benachbarten Zellen dazu veranlassen, mesodermal zu werden. Somit könnte die Bildung des Blastocoels notwendig sein, um unangemessene „induktive“ Interaktionen zwischen den frühen Zellen der Blastozyste zu verhindern. Der zweite offensichtliche Bedarf für das Blastocoel könnte während des nachfolgenden Entwicklungsstadiums, der GASTRULATION, bestehen, in dem Zellen in das Innere des Blastocoels wandern.
Säugetierspaltung
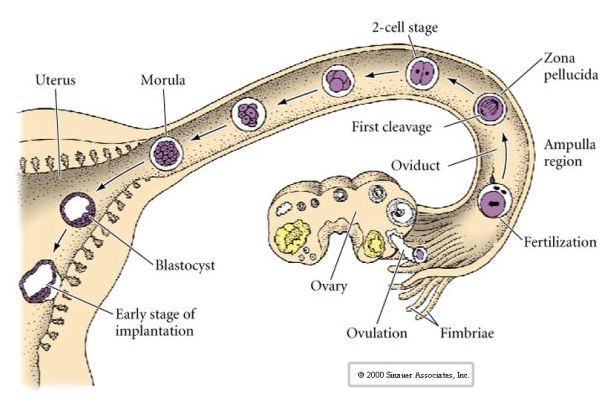
Das Säugetierei wird aus dem Eierstock in den Eileiter entlassen, wo es befruchtet wird. Die erste Spaltung beginnt etwa einen Tag nach der Befruchtung innerhalb des Eileiters. Im Gegensatz zu den meisten Tieren kann die Spaltung bei Säugetieren sehr langsam verlaufen – 1 Tag.
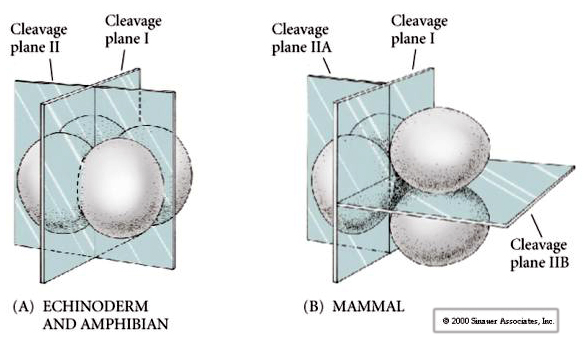 Außerdem sind die Spaltungsebenen etwas anders als bei anderen Tieren. Die erste Spaltung ist meridional, wie bei Seeigel und Frosch. Bei der zweiten Spaltung teilt sich jedoch eines der Blastomere meridional und das andere äquatorial! Diese Art der Spaltung wird ROTATIONELLE HOLOBLASTISCHE SPALTUNG genannt.
Außerdem sind die Spaltungsebenen etwas anders als bei anderen Tieren. Die erste Spaltung ist meridional, wie bei Seeigel und Frosch. Bei der zweiten Spaltung teilt sich jedoch eines der Blastomere meridional und das andere äquatorial! Diese Art der Spaltung wird ROTATIONELLE HOLOBLASTISCHE SPALTUNG genannt.
Ein weiteres einzigartiges Merkmal der Säugetierspaltung ist, dass die Blastomerenspaltung asynchron erfolgt. (verglichen mit der Synchronität von Seeigel und Frosch bis zum mittleren Blastomerenübergang). Die Spaltung des Säugetierembryos wird von Anfang an durch den zyotischen Kern gesteuert.
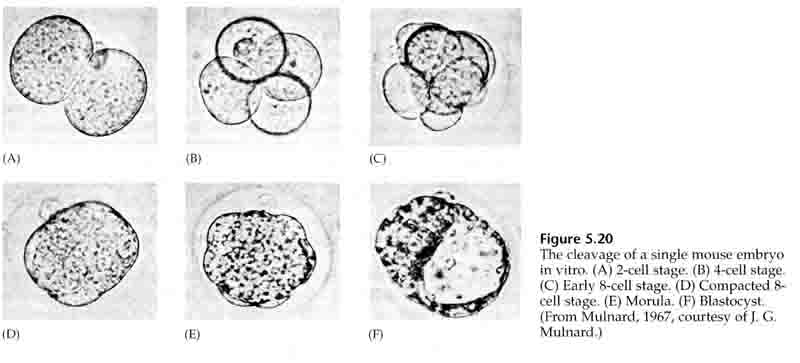
Bis zur dritten Spaltung bilden die Blastomere ein Knäuel lose miteinander verbundener Zellen, genau wie bei den anderen Tieren, die wir untersucht haben. Vor der vierten Spaltung ändern die Zellen der Blastula ihr Verhalten zueinander drastisch. Sie versuchen rasch, ihre Kontakte mit den anderen Blastomeren zu maximieren und bewirken dadurch eine Kompaktheit der Blastula.

Diese KOMPAKTHEIT resultiert zum Teil aus der Produktion eines neuartigen Adhäsionsmoleküls UVOMORULIN (E-Cadherin) und wird durch die Bildung von Tight Junctions zwischen den äußeren Zellen stabilisiert, die wie beim Seeigel das Innere der Blastula nach außen hin abdichten. Die Zellen bilden auch untereinander Gap Junctions, die den Durchgang von kleinen Molekülen wie Ionen und einigen Botenmolekülen wie Ca++ und C-AMP ermöglichen. Die kompakte 16-Zellen-Morula besteht aus einer äußeren Zellrinde und einigen wenigen Zellen (1-2), die sich im Inneren befinden. Aus den meisten der äußeren Zellen entstehen die TROBLASTISCHEN ODER TROPHECTODERMALEN ZELLEN. Diese Zellen tragen nicht zum eigentlichen Embryo bei, sondern sind für die Einnistung des Embryos in die Gebärmutterwand notwendig und bilden das Gewebe des CHORIAN, eines wesentlichen Bestandteils der Plazenta, über den wir später sprechen werden.
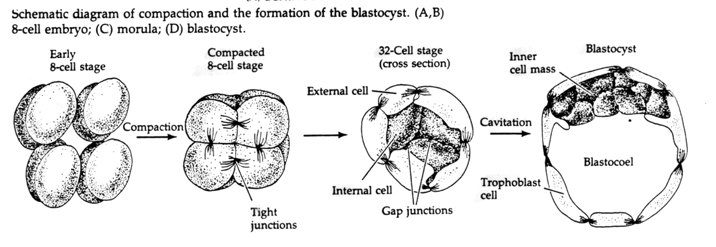
Die Zellen des Embryos stammen von den wenigen inneren Zellen der Blastula im 16-Zell-Stadium. Diese Zellen bilden die innere Zellmasse, aus der sich der gesamte Embryo entwickelt. Bei der 6. Spaltung, dem 64-Zell-Stadium, sind die innere Zellmasse und die Trophoblastenschicht vollständig voneinander getrennt. Die Trophoblasten scheiden Flüssigkeit nach innen aus und bilden das Blastocoel. Der Embryo wird nun als Blastozyste bezeichnet.
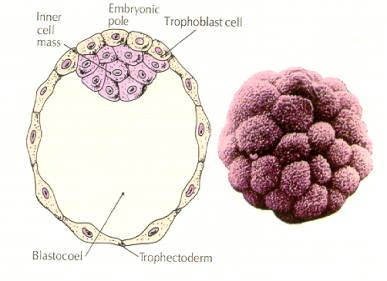 BILDUNG DER INNEREN ZELLMASSE
BILDUNG DER INNEREN ZELLMASSE
Wie entstehen diese Zellen der inneren Zellmasse? Gibt es bestimmte Blastomere, die durch intrinsische Faktoren dazu bestimmt sind, Vorläuferzellen der inneren Zellmasse zu werden? Die Antwort scheint nein zu sein. Alle frühen Blastomere scheinen totipotent zu sein, und die Entscheidung, welche Zellen zur trophoblastischen Schicht und welche zur inneren Zellmasse beitragen, ist einfach eine Frage der zufälligen Position. Zellen aus einem Embryo im 4-Zellen-Stadium, aus denen normalerweise sowohl Zellen der inneren Zellmasse als auch des Trophektoderms hervorgehen, die auf die Außenseite eines Embryos im 32-Zellen-Stadium transplantiert werden, bilden nur das Trophektoderm. Sie tragen nicht zum eigentlichen Embryo bei. Erinnern Sie sich an die frühere Vorlesung über das Klonen, dass die Fusion von zwei Mäuseembryonen im 8-Zellen-Stadium zu einem normalen Embryo führt, was darauf hindeutet, dass alle Zellen in diesem Stadium totipotent sind.
MEROBLASTISCHE SPALTUNG
In telolezithalen und zentrolezithalen Eiern verhindert der große dichte Dotter die Spaltung. Telolezithale Eier sind charakteristisch für Vögel, Fische und Reptilien, während zentrolezithale Eier charakteristisch für Insekten sind. Telolezithale Eier führen zu einer meroblastischen discoidalen Spaltung. Die Spaltung ist auf die Blastodisc am tierischen Pol des Eies beschränkt. Da die Spaltung nicht durch den Dotter hindurch erfolgen kann, sind die Blastomere an ihren vegetabilen Rändern durchgängig.
Dieser Film über die Entwicklung des Zebrafisches von Rolf Karlstrom ist hervorragend. (Film von Paul Myers)
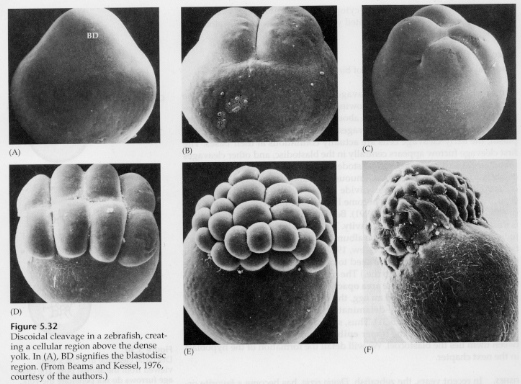 Erst bei den Äquatorialspaltungen trennen sich die Zellen des Blastoderms vom Dotter. Durch weitere Äquatorialspaltungen entsteht ein mehrschichtiges Blastoderm mit einer Dicke von drei oder vier Zellen.
Erst bei den Äquatorialspaltungen trennen sich die Zellen des Blastoderms vom Dotter. Durch weitere Äquatorialspaltungen entsteht ein mehrschichtiges Blastoderm mit einer Dicke von drei oder vier Zellen.
Bei Vögeln bildet sich zwischen dem Blastoderm und dem Dotter ein Raum, der als SUBGERMINALE Höhle bezeichnet wird. Bei der 16. Teilung (60.000 Zellen) wandern Zellen des Blastoderms in die subgerminale Höhle ein und bilden eine zweite Schicht. Die beiden Schichten werden als äußerer EPIBLAST und innerer HYPOBLAST bezeichnet, dazwischen befindet sich das Blastocoel. Wir werden dies später genauer untersuchen, wenn wir die Gastrulation bei Vögeln und Säugetieren besprechen
Zentrale Eier von Gliederfüßern durchlaufen eine SUPERFICIAL CLEAVAGE. Die große zentrale Masse des Dotters beschränkt die Spaltung auf den zytoplasmatischen Rand des Eies.
Eine interessante und aufschlussreiche Variante findet sich bei den Insekten. Die zygotischen Kerne teilen sich ohne Spaltung. Das heißt, die Kerne durchlaufen die Karyokinese—-mitotische Teilung des Zellkerns— ohne Zytokinese—die Teilung der Zelle. Diese nackten Kerne werden ENERGIDS genannt. Die Kerne teilen sich mit einer erstaunlichen Geschwindigkeit – alle 8 Minuten (die gesamte Embryogenese dauert nur 22 Stunden).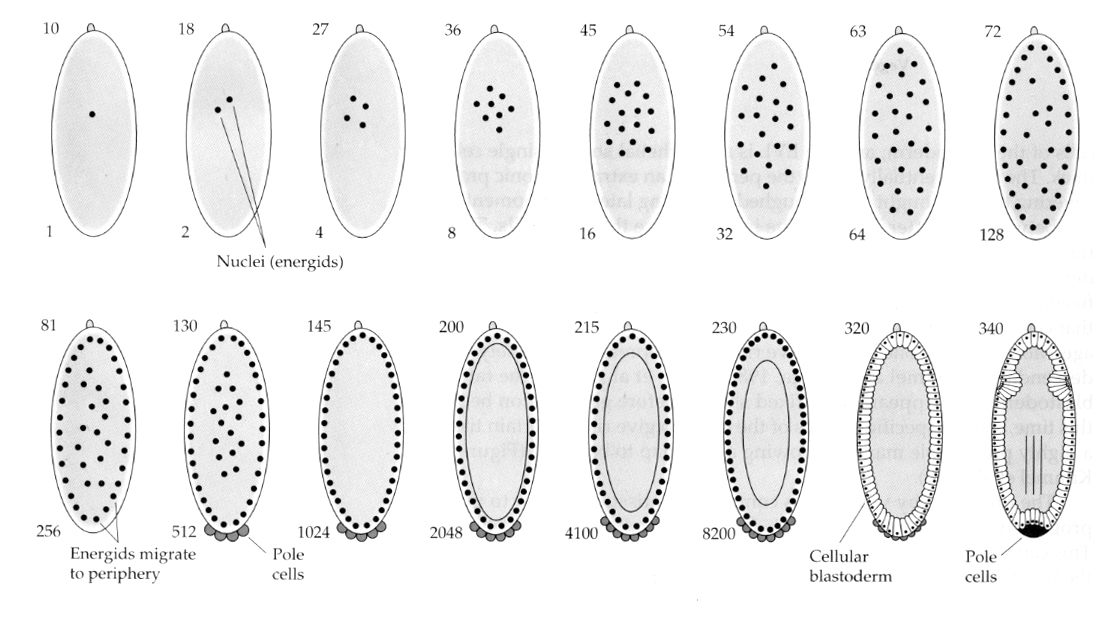
 Nach mehreren Runden der Karyokinese wandern die nackten Kerne an den Rand der Eizelle. In diesem Stadium spricht man vom SYNKYTIELLEN BLASTODERM, weil alle Kerne das gleiche Zytoplasma teilen. Die Zellularisierung erfolgt etwa bei der 14. Kernteilung, wodurch das ZELLULARE BLASTODERM entsteht. Nach diesem Zeitpunkt teilen sich die Zellen asynchron. Dies entspricht dem Midblastula-Übergang bei Fröschen und Seeigeln. (Übergang von der mütterlichen zur primär zygotischen Genexpression) Es sei daran erinnert, dass der Midblastula-Übergang vermutlich durch das Verhältnis von Chromatin zu Zytoplasma ausgelöst wird. Dieser Mechanismus lässt sich bei Fliegen durch die Untersuchung von mutierten haploiden Embryonen nachweisen. Diese Embryonen durchlaufen den Midblastula-Übergang und die Zellularisierung eine Teilung später 15. Außerdem kann man die Zellularisierung beschleunigen, indem man die Eizelle ligiert und das Volumen des Zytoplasmas reduziert. Obwohl das synzytiale Blastodermstadium suggeriert, dass alle Kerne äquipotent sind, da es keine Diffusionsbarrieren für zytoplasmatische Determinanten zu geben scheint, ist das Zytoplasma tatsächlich sehr regionalisiert und die Kerne haben hoch organisierte zytoplasmatische Domänen um sich herum.
Nach mehreren Runden der Karyokinese wandern die nackten Kerne an den Rand der Eizelle. In diesem Stadium spricht man vom SYNKYTIELLEN BLASTODERM, weil alle Kerne das gleiche Zytoplasma teilen. Die Zellularisierung erfolgt etwa bei der 14. Kernteilung, wodurch das ZELLULARE BLASTODERM entsteht. Nach diesem Zeitpunkt teilen sich die Zellen asynchron. Dies entspricht dem Midblastula-Übergang bei Fröschen und Seeigeln. (Übergang von der mütterlichen zur primär zygotischen Genexpression) Es sei daran erinnert, dass der Midblastula-Übergang vermutlich durch das Verhältnis von Chromatin zu Zytoplasma ausgelöst wird. Dieser Mechanismus lässt sich bei Fliegen durch die Untersuchung von mutierten haploiden Embryonen nachweisen. Diese Embryonen durchlaufen den Midblastula-Übergang und die Zellularisierung eine Teilung später 15. Außerdem kann man die Zellularisierung beschleunigen, indem man die Eizelle ligiert und das Volumen des Zytoplasmas reduziert. Obwohl das synzytiale Blastodermstadium suggeriert, dass alle Kerne äquipotent sind, da es keine Diffusionsbarrieren für zytoplasmatische Determinanten zu geben scheint, ist das Zytoplasma tatsächlich sehr regionalisiert und die Kerne haben hoch organisierte zytoplasmatische Domänen um sich herum.
MECHANISMEN DES SPALTUNGSSTADIUMS
Zellzyklus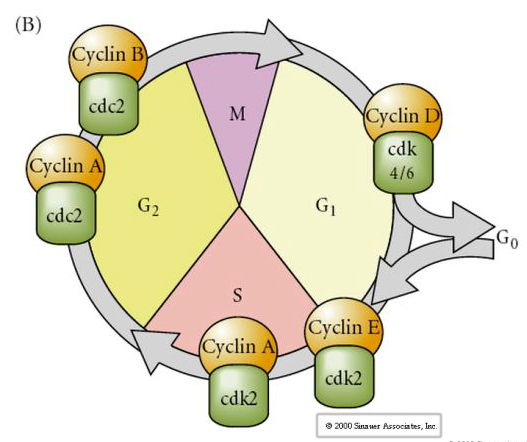
M-Mitose
G1- Präreplikationslücke
S- DNA-Synthese
G2-prämitotische Lücke
Bei Embryonen im Spaltstadium wie Fröschen und Fliegen gehen die Blastomere direkt von M zu S über, ohne dazwischenliegende G1- oder G2-Stadien. Nach dem Midblastula-Übergang haben die Zellen in beiden Tieren ein G1- und ein G2-Stadium. Elegante Transplantationsexperimente haben gezeigt, dass es das Zytoplasma ist, das sowohl die Karyokinese als auch die Zytokinese steuert. Werden Kerne von sich teilenden Zellen in eine Eizelle transplantiert, hören sie sofort auf, sich zu teilen.
 Umgekehrt beginnen sie sich zu teilen, wenn Kerne von sich nicht teilenden Zellen in befruchtete enukleierte Eizellen eingesetzt werden. Künstlich aktivierte enukleierte Eizellen ohne Zentriolen erfahren kortikale Kontraktionen, die an eine Spaltung erinnern. Einige der zytoplasmatischen Faktoren, die die Zellteilung im frühen Embryo regulieren, sind identifiziert worden.
Umgekehrt beginnen sie sich zu teilen, wenn Kerne von sich nicht teilenden Zellen in befruchtete enukleierte Eizellen eingesetzt werden. Künstlich aktivierte enukleierte Eizellen ohne Zentriolen erfahren kortikale Kontraktionen, die an eine Spaltung erinnern. Einige der zytoplasmatischen Faktoren, die die Zellteilung im frühen Embryo regulieren, sind identifiziert worden.
CYTOSTATIC FACTOR (CSF) ist nach der ersten meiotischen Teilung erhöht und arretiert die Eizelle in der zweiten meiotischen Metaphase. Nach der Befruchtung inaktiviert das Ca den CSF, die Meiose wird abgeschlossen und die Pronuklei verschmelzen.
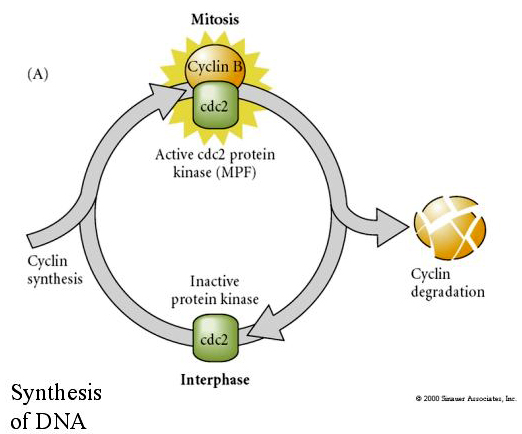
MITOSIS PROMOTING FACTOR (MPF) veranlasst die Zellen, in die M-Phase einzutreten. Die Aktivierung des MPF bewirkt: 1. die Chromosomenkondensation durch H1-Histonphosphorylierung, 2. den Abbau der Kernhülle durch Hyperphosphorylierung von 3 Kernlaminen, 3. die Hemmung der RNA-Polymerase zur Abschaltung der Transkription, 4. die Phosphorylierung der regulatorischen Myosin-Untereinheit zur Einleitung der Zytokinese.
Vorgeschlagenes Modell für die zyklische Regulierung des Zellzyklus während der Spaltungsphasen der Embrogenese. MPF veranlasst die Zelle, von S nach M überzugehen. CSF bindet an MPF und verhindert dessen Inaktivierung. Die Zelle verbleibt in M. Ca steigt an und bewirkt die Inaktivierung von CSF, was wiederum zur Inaktivierung von MPF führt, so dass die Zelle von M nach S übergeht und der Zyklus wiederholt wird. MPF setzt sich aus zwei Untereinheiten zusammen, Cyclin B und cdc2. Cyclin B durchläuft eine zellzyklusspezifische Synthese und Degradation, die vom Zellkern reguliert wird, um den Zellzyklus in normalen somatischen Zellen zu steuern. Während der Oogenese ist die Eizelle jedoch mit „Regulatoren“ von Cyclin B und Cyclin B mRNA beladen, so dass ihre Synthese durch mütterliche Faktoren unabhängig vom Zygotenkern reguliert wird. Erst wenn die mütterlichen Komponenten „ausgehen“, übernimmt der zygotische Kern und ein normaler Zellzyklus (M, G1, S, G2) kehrt zurück.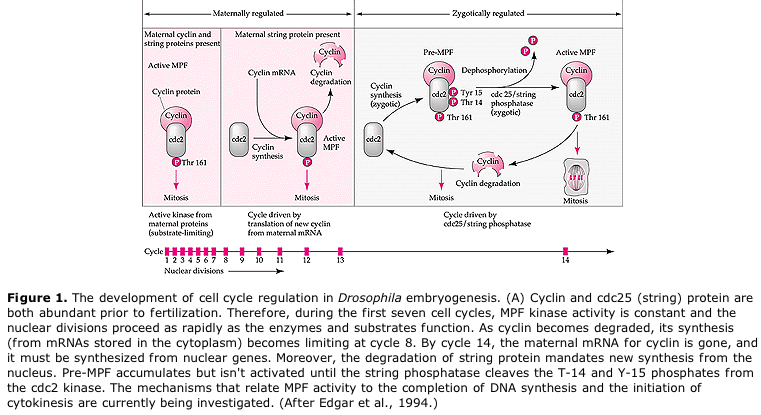
ZELLSCHICKSBESTIMMUNG
Zytoplasmatische Lokalisierung von DETERMINANTEN als allgemeiner und grundlegender Mechanismus für die frühe Musterbildung (Beispiele Tunikate und Seeigel). Eine wichtige Frage der Entwicklungsbiologie ist, wann und wie das Zellschicksal während der Entwicklung bestimmt wird. Dies steht in engem Zusammenhang mit der Frage, wie die Musterbildung während der Entwicklung erfolgt. Der Embryo muss nicht nur die richtige Anzahl und den richtigen Typ differenzierter Zellen erzeugen, sondern diese müssen auch in der richtigen Weise im Verhältnis zu allen anderen Zellen im Embryo organisiert sein, um ein funktionierendes Tier zu bilden. Wir werden zwei Möglichkeiten der Bestimmung des Zellschicksals und der Musterbildung untersuchen: 1. Das Zellschicksal könnte durch intrinsische Faktoren bestimmt werden, die während der Oogenese in die Eizelle eingebracht und dann während der Spaltung an bestimmte Blastomere verteilt werden. 2. Extrinsische Signale aus der Umgebung des Embryos könnten die Informationen für die Musterbildung liefern, um das Zellschicksal zu steuern. Wie wir sehen werden, verwenden die meisten komplexen Organismen eine Kombination aus intrinsischen und extrinsischen Signalen, um das Zellschicksal und die embryonale Musterbildung zu regulieren.
Die autonome Spezifizierung des Zellschicksals durch zytoplasmatische Determinanten deutet darauf hin, dass das Schicksal einer Zelle vollständig von ihrer Abstammung abhängt, während die „regulative“ Entwicklung darauf hindeutet, dass das Schicksal einer Zelle durch externe Signale von anderen Zellen bestimmt wird. Diese beiden Mechanismen der Zellspezifikation lassen sich experimentell durch Isolierungs-, Ablations- und Transplantationsexperimente unterscheiden. Wenn sich eine aus einem Embryo isolierte Blastmere normal differenziert (als ob sie sich noch an ihrer normalen Position im Embryo befände), können wir sagen, dass sie intrinsische Determinanten haben muss, die ihr Schicksal bestimmen. Wenn sie sich jedoch abnormal differenziert, können wir sagen, dass ihr Zellschicksal von externen Signalen abhängig ist. Wenn wir eine Blastomere aus einem Embryo entfernen und der Embryo sich abnormal entwickelt und ihm alle Zellen fehlen, die normalerweise aus der entfernten Blastomere hervorgehen, können wir sagen, dass die Entwicklung zellautonom und intrinsisch spezifiziert ist. Entwickelt sich der Embryo jedoch normal, so können die verbleibenden Blastomere ihr Zellschicksal regulieren, um die fehlenden Zellen zu kompensieren. Wenn eine transplantierte Zelle ihr Zellschicksal auf der Grundlage ihrer ursprünglichen Position beibehält, sagen wir, dass ihr Schicksal bestimmt wurde; wenn sie ein neues Schicksal auf der Grundlage ihrer neu transplantierten Position annimmt, sagen wir, dass ihr Schicksal durch externe Signale von nahegelegenen Zellen reguliert wird.
ZYTOPLASMISCHE LOKALISIERUNG UND REGULIERUNG IM TUNIKAT-EI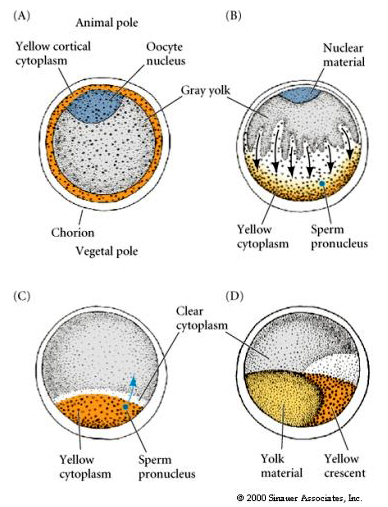
Am Ende der Oogenese hat das Tunikatei einen klar unterscheidbaren tierischen und vegetativen Pol. Es gibt ein gelbes Rindenzytoplasma, das ein graues, gelbliches inneres Zytoplasma umgibt. Der Zellkern der Eizelle ist in Richtung des tierischen Pols verlagert. Der Eintritt der Spermien in die vegetale Hemisphäre befruchtet die Eizelle und leitet die Entwicklung ein. Nach der Befruchtung kommt es zu einer dramatischen Umstrukturierung des Zytoplasmas der Eizelle, was zu regional gefärbten Zytoplasmen führt, die mit dem späteren Schicksal der Blastomere zu korrelieren scheinen.
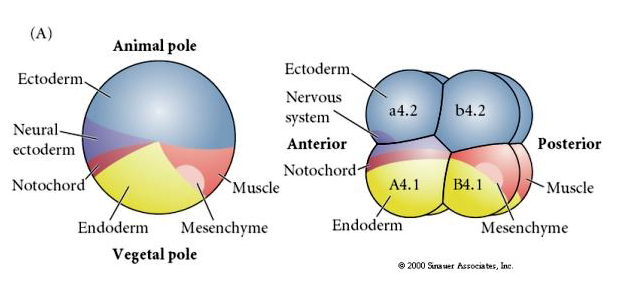 Beachten Sie, dass die Schicksalskarte mit den verschieden gefärbten Zytoplasmen des Manteltier-Embryos korreliert. Lassen Sie sich nicht von den unterschiedlichen Farben in zwei Abbildungen verwirren. Das „orange“ gelbe, sichelförmige Zytoplasma steht in Zusammenhang mit dem Muskelschicksal und das gelbliche Zytoplasma mit dem Endodermalschicksal. Das graue (weiße oder bläulich-violette) Zytoplasma oberhalb des gelben Halbmondes ist dem neuralen Ektoderm zugeordnet.
Beachten Sie, dass die Schicksalskarte mit den verschieden gefärbten Zytoplasmen des Manteltier-Embryos korreliert. Lassen Sie sich nicht von den unterschiedlichen Farben in zwei Abbildungen verwirren. Das „orange“ gelbe, sichelförmige Zytoplasma steht in Zusammenhang mit dem Muskelschicksal und das gelbliche Zytoplasma mit dem Endodermalschicksal. Das graue (weiße oder bläulich-violette) Zytoplasma oberhalb des gelben Halbmondes ist dem neuralen Ektoderm zugeordnet.
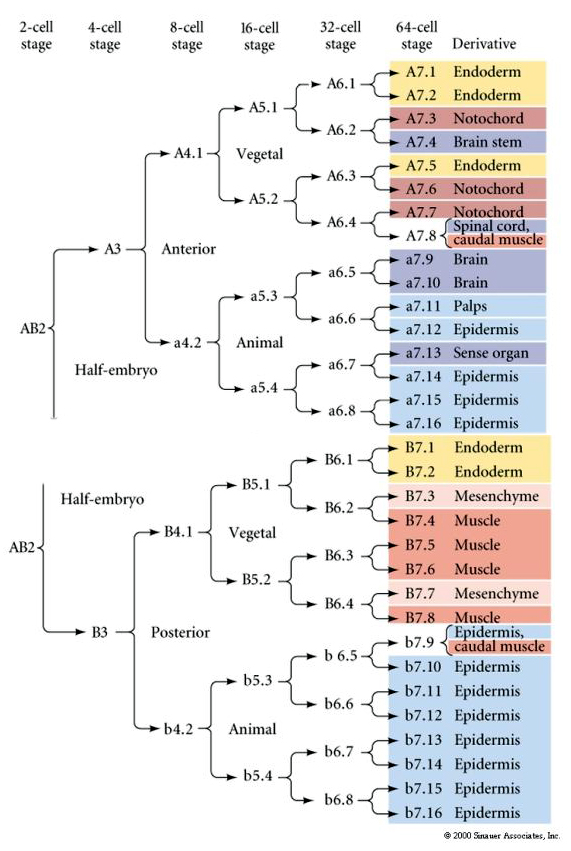 Diese Abstammungskarte zeigt die Korrelation der invarianten Abstammung mit den Blastomeren, die durch die invarianten Zellteilungen in bestimmte farbige Zytoplasmen parzelliert werden. Allerdings beweisen invariante Spaltungen und Linien nicht unbedingt eine autonome Zellspezifizierung durch zytoplasmatische Determinanten.
Diese Abstammungskarte zeigt die Korrelation der invarianten Abstammung mit den Blastomeren, die durch die invarianten Zellteilungen in bestimmte farbige Zytoplasmen parzelliert werden. Allerdings beweisen invariante Spaltungen und Linien nicht unbedingt eine autonome Zellspezifizierung durch zytoplasmatische Determinanten.
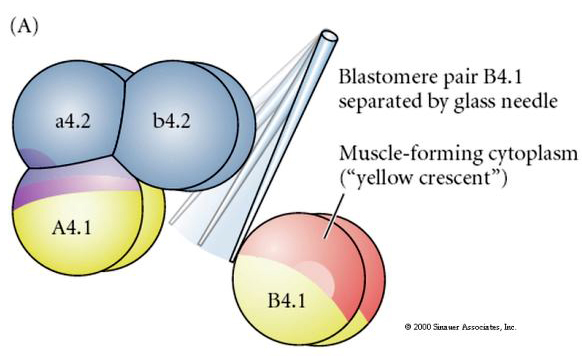 Um die regulative oder zellautonome Bestimmung des Zellschicksals zu testen, sind experimentelle Manipulationen erforderlich. Die klassischen Isolationsexperimente, die in den folgenden drei Abbildungen gezeigt werden, versuchen zu zeigen, dass das Zellschicksal durch zytoplasmatische Determinanten bestimmt wird, die sie durch Stereotypenspaltungen erwerben. Mit einer Glasnadel wird das B4.1-Blastomerpaar vom Rest des Embryos getrennt. Die B4.1-Blastomere erhalten normalerweise das gelbe kreuzförmige Zytoplasma, das mit dem Schicksal der Muskelzellen korreliert.
Um die regulative oder zellautonome Bestimmung des Zellschicksals zu testen, sind experimentelle Manipulationen erforderlich. Die klassischen Isolationsexperimente, die in den folgenden drei Abbildungen gezeigt werden, versuchen zu zeigen, dass das Zellschicksal durch zytoplasmatische Determinanten bestimmt wird, die sie durch Stereotypenspaltungen erwerben. Mit einer Glasnadel wird das B4.1-Blastomerpaar vom Rest des Embryos getrennt. Die B4.1-Blastomere erhalten normalerweise das gelbe kreuzförmige Zytoplasma, das mit dem Schicksal der Muskelzellen korreliert.
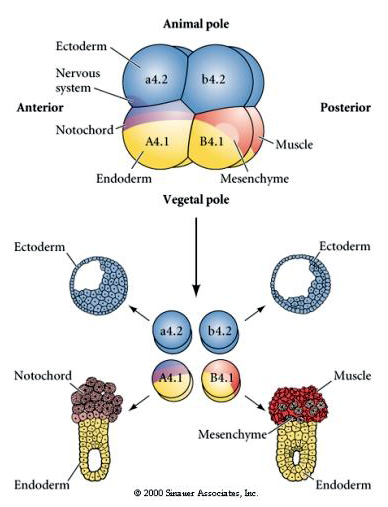
Hier sehen wir die Ergebnisse der Isolierungsexperimente. In jedem Fall bringen die isolierten Blastomere nur die Untergruppe von Zellschicksalen hervor, die sie normalerweise im intakten Embryo hervorbringen würden. Die isolierten Blastomere regulieren ihr Schicksal nicht, um das Fehlen ihrer Nachbarn zu kompensieren. Aus den Blastomeren am Tierpol, a4.2 und b4.2, entstehen nur ektodermale Zellen. Aus A4.1 entstehen Notochord- und endodermale Zellen, während aus B4.1 Muskel- und endodermale Zellen entstehen. Keines der isolierten Blastomere kann alle zellulären Bestandteile eines normalen Embryos hervorbringen.
Im folgenden Experiment wird die äquatoriale Spaltungsebene mit einer Nadel manipuliert, so dass sie vegetabiler als normal ist und die Blastomere des Tierpols, b4.2, einen Teil des „gelben Halbmondes“ Zytoplasmas erhalten. Wenn diese Blastomere isoliert werden, entstehen aus ihnen nun einige Muskelzellen. Dies zeigt sehr schön, dass das Zytoplasma der „gelben Sichel“ das Schicksal der Muskelzellen bestimmen kann, und zwar auf zellautonome Weise.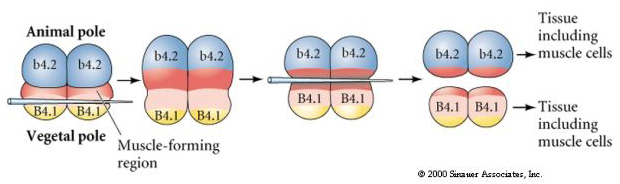
Lokalisierung und Regulierung im Meeresei
Ein Geleekanal definiert die Lage des Tierpols und spiegelt die frühe Polarität des Eies wider. Das frühe Muster der Spaltungen hängt nicht von der Stelle ab, an der die Spermien eindringen, sondern wird durch die intrinsische Polarität/Asymmetrie der Eizelle bestimmt. Boveri (1901) beschrieb ein subequatoriales Band aus Pigmenten, das orthongonal zur tierisch-vegetalen Achse angeordnet ist. Diese Körnchen wiesen auch auf die Lage des Zytoplasmas hin, das später in den Zellen des Archenterons enthalten ist. Horstadius (1928) trennte tierische und pflanzliche Blastomere und zeigte, dass nur die pflanzlichen Blastomere Mikromere hervorbringen, sich gastrulieren und ein Skelett bilden. Er kam zu dem Schluss, dass zytoplasmatische Faktoren, die sich in der vegetabilen Hälfte befinden, für die Bildung von Mikromeren, Gastrulation und Archenteron sowie für die Bildung des Skeletts notwendig sind. Erinnern Sie sich an das Muster der frühen Spaltungen. Die Mikromere entstehen während der vierten Spaltung (16-Zellen-Stadium) durch eine ungleiche äquatoriale Teilung der Blastomere des vegetativen Pols.
Erinnern Sie sich an das Muster der frühen Spaltungen. Die Mikromere entstehen während der vierten Spaltung (16-Zellen-Stadium) durch eine ungleiche äquatoriale Teilung der Blastomere des vegetativen Pols.
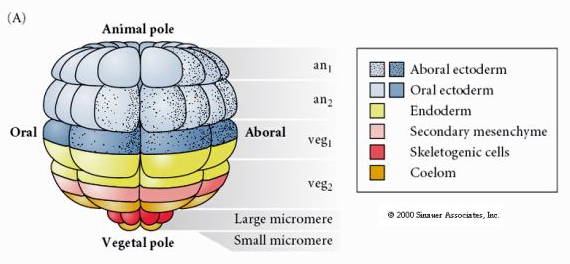 Dies zeigt die Schicksalskarte der Seeigel-Blastula im 64-Zellen-Stadium. Man beachte, dass die Mikromere die primären Mesenchymzellen sind und das Larvenskelett bilden (die Spicula im Pluteus-Stadium).
Dies zeigt die Schicksalskarte der Seeigel-Blastula im 64-Zellen-Stadium. Man beachte, dass die Mikromere die primären Mesenchymzellen sind und das Larvenskelett bilden (die Spicula im Pluteus-Stadium).
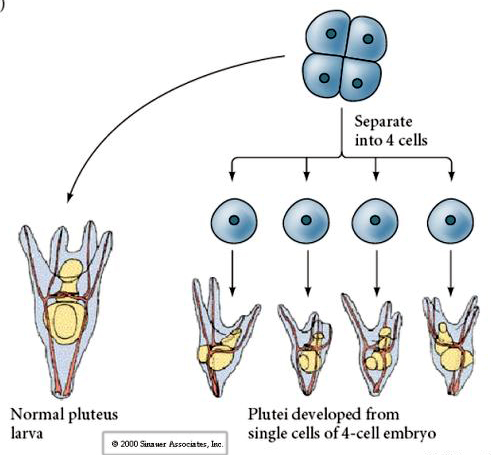 Wenn die Blastomere im Vier-Zellen-Stadium voneinander isoliert sind, können sie ihr Schicksal „regulieren“ und 4 kleine Larven im Pluteus-Stadium hervorbringen.
Wenn die Blastomere im Vier-Zellen-Stadium voneinander isoliert sind, können sie ihr Schicksal „regulieren“ und 4 kleine Larven im Pluteus-Stadium hervorbringen.
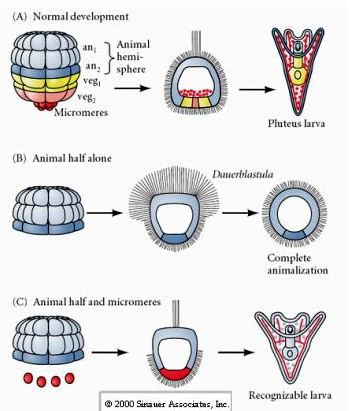 Isoliert man dagegen in späteren Stadien tierische Halbblastomere, so stellt man fest, dass sie nur eine „animalisierte“ Dauerblastula hervorbringen, die keine mesodermalen oder endodermalen Zellschicksale ausdrückt. Aus isolierten pflanzlichen Halbblastomeren entstehen Larven, die ektodermale, mesodermale und endodermale Zellschicksale aufweisen, was zeigt, dass das Schicksal dieser Zellen reguliert werden kann. Isolierte Mikromere (primäres Mesenchym) durchlaufen die richtige Anzahl von Zellteilungen und bilden IMMER planmäßig Spicula aus. Somit sind die Mikromere definitiv als Vorläufer der skelettbildenden Mesenchymzellen festgelegt, wenn sie zum ersten Mal im 16-Zellen-Stadium auftreten. Die Schlüsselexperimente bestanden darin, die Mikromere mit den Blastomeren des Tierpols zusammenzubringen und zu zeigen, dass das Schicksal der Mikromere zwar zum Zeitpunkt ihrer Geburt „festgelegt oder bestimmt“ war, die Mikromere aber in der Lage waren, neue Zellschicksale in den Blastomeren des Tierpols zu „induzieren“. Die Mikromere waren in der Lage, in den Blastomeren des Tierpols endodermale und mesodermale Zellschicksale zu induzieren! Das späte Experiment in „C“ zeigt also, dass man, wenn man Mikromere zu einer halben Tierblastula hinzufügt, die Bildung einer erkennbaren Larve induzieren kann, die endodermale, mesodermale und ektodermale Schicksale zum Ausdruck bringt.
Isoliert man dagegen in späteren Stadien tierische Halbblastomere, so stellt man fest, dass sie nur eine „animalisierte“ Dauerblastula hervorbringen, die keine mesodermalen oder endodermalen Zellschicksale ausdrückt. Aus isolierten pflanzlichen Halbblastomeren entstehen Larven, die ektodermale, mesodermale und endodermale Zellschicksale aufweisen, was zeigt, dass das Schicksal dieser Zellen reguliert werden kann. Isolierte Mikromere (primäres Mesenchym) durchlaufen die richtige Anzahl von Zellteilungen und bilden IMMER planmäßig Spicula aus. Somit sind die Mikromere definitiv als Vorläufer der skelettbildenden Mesenchymzellen festgelegt, wenn sie zum ersten Mal im 16-Zellen-Stadium auftreten. Die Schlüsselexperimente bestanden darin, die Mikromere mit den Blastomeren des Tierpols zusammenzubringen und zu zeigen, dass das Schicksal der Mikromere zwar zum Zeitpunkt ihrer Geburt „festgelegt oder bestimmt“ war, die Mikromere aber in der Lage waren, neue Zellschicksale in den Blastomeren des Tierpols zu „induzieren“. Die Mikromere waren in der Lage, in den Blastomeren des Tierpols endodermale und mesodermale Zellschicksale zu induzieren! Das späte Experiment in „C“ zeigt also, dass man, wenn man Mikromere zu einer halben Tierblastula hinzufügt, die Bildung einer erkennbaren Larve induzieren kann, die endodermale, mesodermale und ektodermale Schicksale zum Ausdruck bringt.
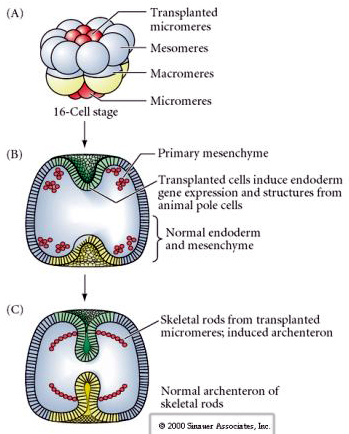 Die letzte Reihe von Experimenten zeigt, dass man sogar bei einem normalen Embryo ein sekundäres Archenteron induzieren und die normale axiale Musterung verändern kann, wenn man Mikromere in die Tierpolkappe verpflanzt. Dies wiederum spricht dafür, dass die Mikromere einen zytoplasmatischen Derminanten erwerben, der ihr Zellschicksal bestimmt, und dass sie das induktive Signal liefern, das die axialen Strukturen des Seeigel-Embryos strukturiert. Das Schicksal der Mikromere kann nicht verändert werden, aber Signale von den Mikromeren können das Schicksal aller anderen Blastomere verändern.
Die letzte Reihe von Experimenten zeigt, dass man sogar bei einem normalen Embryo ein sekundäres Archenteron induzieren und die normale axiale Musterung verändern kann, wenn man Mikromere in die Tierpolkappe verpflanzt. Dies wiederum spricht dafür, dass die Mikromere einen zytoplasmatischen Derminanten erwerben, der ihr Zellschicksal bestimmt, und dass sie das induktive Signal liefern, das die axialen Strukturen des Seeigel-Embryos strukturiert. Das Schicksal der Mikromere kann nicht verändert werden, aber Signale von den Mikromeren können das Schicksal aller anderen Blastomere verändern.
Horstadius: (1928, 1935) zeigte experimentell, dass in einem Embryo im 16-Zellen-Stadium alle Blastomere mit Ausnahme der Mikromere verschiedene Schicksale annehmen, wenn sie in chimären Embryonen an verschiedene Positionen verpflanzt werden. Das Archenteron entwickelt sich aus den Blastomeren des Veg 1, wenn die Zellen des Veg 2 entfernt werden und die Mikromere in Kontakt mit der Schicht des Veg 1 gebracht werden. Fehlen die Mikromere, bilden sich aus den Blastomeren des Veg 2 das Archenteron und die Skelettstrukturen. Klassischerweise wurde ein tierisch-vegetarischer Gradient als Erklärung für diese Ergebnisse angeführt. Diese Ergebnisse deuten jedoch nur darauf hin, dass entscheidende induktive Interaktionen zwischen benachbarten Blastomerenschichten stattfinden.
Einzelne implantierte Mikromere in der Nähe des Tierpols hemmen die apikale Büschelbildung und induzieren in einigen Fällen eine neue Embryonalachse. Veg 2-Blastomere induzieren auch ähnliche Veränderungen wie Mikromere, wenn sie neben Blastomere des Tierpols transplantiert werden.
GESAMTES ERGEBNIS VON TRANSPLANTATIONEN: Das Schicksal bestimmter Blastomere wird immer durch die Anlagerung verschiedener benachbarter Zellen beeinflusst, die in normalen Embryonen an sie angrenzen.
HYPOTHESE: Lokalisierte mütterliche zytoplasmatische Determinanten spezifizieren bestimmte Zellen im normalen Embryo, insbesondere die Mikromere und die Vorläufer des Archenterons in der Nähe des vegetativen Pols. Diese Zellen bestimmen dann induktiv das Schicksal der benachbarten Blastomere, die ihrerseits mit ihren Nachbarn interagieren. Viele der Blastomere behalten andere Potentiale als die, die sie normalerweise ausdrücken, und für eine gewisse Zeit sind diese Blastomere nur reversibel spezifiziert, wie es für ein Entwicklungssystem erforderlich ist, das in hohem Maße von Induktion abhängt.