Cleavage refere-se ao padrão estereotipado de divisões mitóticas iniciais que divide o citoplasma do ovo de grande volume. O zigoto primitivo é único em ser tão grande. A maioria das células sofre um período de crescimento entre os ciclos de mitose, mas isto não é verdade para os blastômeros do estágio de clivagem precoce. Com cada divisão, as células ficam menores. Este padrão rápido de divisão celular sem crescimento concomitante pára abruptamente no estágio chamado transição mid-blastula onde o núcleo zigótico assume o controle do ciclo celular.
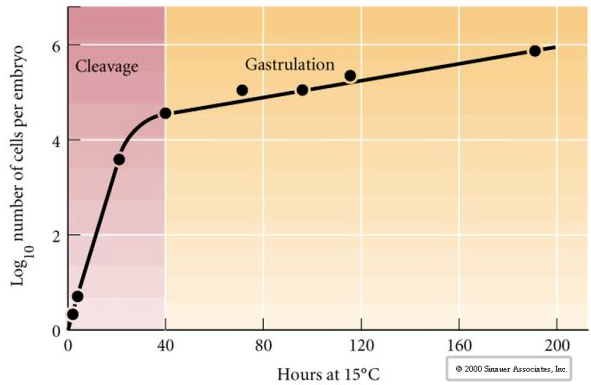 Existem algumas evidências de que um fator materno, talvez um regulador transcripcional, é responsável por este padrão rápido precoce de divisões da clivagem. Alterando artificialmente a proporção de DNA citoplasmático para nuclear, pode-se alterar o tempo de transição da midblastula. A transição da midblastula refere-se ao tempo em que ocorre a maior mudança de expressão dos genes maternos para zigóticos.
Existem algumas evidências de que um fator materno, talvez um regulador transcripcional, é responsável por este padrão rápido precoce de divisões da clivagem. Alterando artificialmente a proporção de DNA citoplasmático para nuclear, pode-se alterar o tempo de transição da midblastula. A transição da midblastula refere-se ao tempo em que ocorre a maior mudança de expressão dos genes maternos para zigóticos.
Fertilização em algumas espécies leva a movimentos citoplasmáticos radicais que são essenciais para garantir que os determinantes citoplasmáticos estejam localizados nas posições corretas em relação aos eventos subsequentes da clivagem.
PADRÕES DA CLEAVA EMBRÍNICA
O padrão de clivagem embrionária é determinado tanto pela posição dos fusos mitóticos como pela quantidade e distribuição da gema. A gema tende a inibir a clivagem. Ela a retarda ou impede a clivagem completa. A gema é uma adaptação dos animais que passam por mais ou menos embriogênese isolados de qualquer fornecimento de alimento. Alguns animais, como o ouriço-do-mar, têm relativamente pouca gema porque rapidamente se desenvolvem numa forma larvar livre que adquire nutrientes do seu ambiente. Outros animais como os marsupiais nascem prematuramente, mas são alimentados numa bolsa parental. Os mamíferos placentários desenvolvem um órgão especializado através do qual o embrião é alimentado ao longo do desenvolvimento e por isso também têm pouca gema.
Os tipos de ovos baseados nas características da gema são descritos como:
Isolecital: gema esparsa uniformemente distribuída, por exemplo, ouriço-do-mar, rato
Mesolecthal: quantidade moderada de gema, muitas vezes desigualmente distribuída, por exemplo, rã
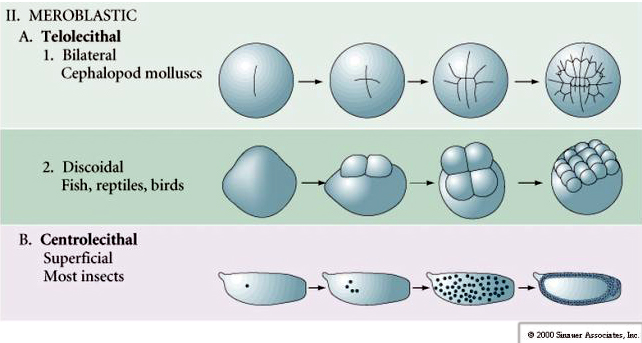
Telolecital: gema densa concentrada numa extremidade, por exemplo, ave, réptil
Centrolecital: gema concentrada no meio do ovo, por exemplo, mosca
Muitos ovos são polarizados com um pólo rico em gema, denominado pólo vegetal e um pólo pobre em gema, denominado pólo animal, por exemplo, rã. O núcleo zigótico é geralmente deslocado em direção ao pólo animal. Zigotos com relativamente pouca gema (isolecital e mesolecital) clivam HOLOBLASTICAMENTE. O sulco de clivagem estende-se por todo o ovo. Enquanto zigotos telolecitais e centro-lecitais sofrem clivagem MEROBLASTICAMENTE onde o plano de clivagem se estende apenas até a gema acumulada. Nos ovos centrolectais (muitos ovos de insetos) a clivagem é meroblástica e superficial, enquanto que nos ovos telolectais (aves e peixes) a clivagem é discoidal
Existem vários tipos de simetria de clivagem vistos na natureza: radial (equinodermos, anfíbios), espiral (moluscos, anelídeos), Bilateral (ascidianos, tunicados), Rotacional (mamíferos). As duas figuras abaixo mostram exemplos de simetrias holoblásticas e meroblásticas de clivagem.
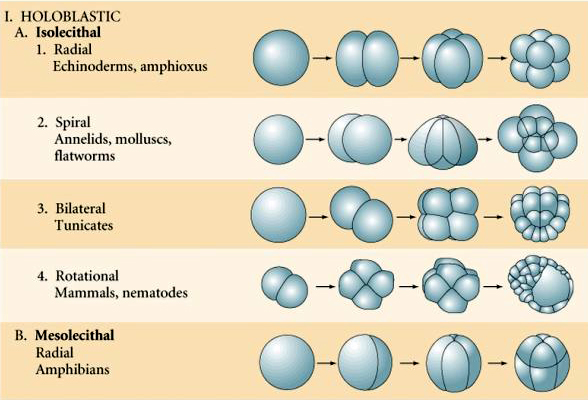
CLAVAGEM HOLOBLÁSTICA RÁDIAL
Excelente filme de clivagem de ouriço-do-mar de Rachel Fink “A Dozen Eggs”.
Os ouriços-do-mar também têm clivagem holoblástica radial, mas com algumas diferenças interessantes. A primeira clivagem é meridional. A segunda clivagem é meridional. A terceira clivagem é equatorial A quarta clivagem é meridional, mas enquanto as quatro células do pólo animal se dividem igualmente para dar origem a oito blastômeros animais de tamanho igual denominados MESOMERES, as células vegetais se dividem assimetricamente ao longo do plano equatorial para dar 4 MACROMERES grandes e 4 MICROMERES muito menores no pólo vegetal. Quinta divisão os MESOMERES dividem-se equatorialmente para dar dois níveis de oito MESOMERES an1 e an2 , os MACROMERES dividem-se meridionalmente formando um nível de oito células abaixo de an2, os MICROMERES dividem-se para dar um aglomerado de células abaixo da camada vegetal1. As sexta divisões são todas equatoriais, dando uma camada veg2. As sétimas divisões são todas meridionais, dando uma blastula de 128 células.
O que determina estes padrões de clivagem? Eles são dependentes da clivagem anterior e tocados como uma fita adesiva ou são determinados por algum relógio intrínseco? Em 1939 Horstadius inibiu uma ou duas das três primeiras clivagens e descobriu que o aparecimento dos micrômeros ocorreu no momento certo, independentemente da história das clivagens
A conclusão desses experimentos é que existe algum fator no pólo vegetal do ovo que determina a formação dos micrômeros e, além disso, que deve haver um relógio molecular que começa na ativação do ovo. O relógio é independente do evento real da clivagem.
A blástula de 128 células é uma bola bastante solta de células ao redor de um blastocoel oco. A esfera é uma camada de célula com todas as células em contato com a camada hialina externa e o fluido interno do blastocoel. Nesta fase do desenvolvimento, as células começam a formar as junções estreitas características de um epitélio. O blastocoel central está agora isolado do ambiente externo. Os blastocoel centrais continuam a dividir-se com o seu eixo paralelo à camada hialina, permanecendo um epitélio de uma célula de espessura. O blastocoel continua a aumentar.
Duas teorias tentam explicar o padrão de ampliação do blastocisto
1. A teoria osmótica sugere que íons e proteínas são secretados no blastocoel pelos blastômeros e isto resulta em um acúmulo de pressão devido ao fluxo osmótico da água. Esta pressão seria então responsável pelo alinhamento da mitose do eixo dos blastômeros e a ampliação do blastocoel.
2. A teoria alternativa de Wolpert e seus colegas sugere que são realmente as interações adesivas entre os blastômeros e entre os blastômeros e a camada hialina que alinham os eixos mitóticos. Essa é a maior aderência à hialina, a seguinte é a aderência a outros blastômeros e finalmente a interação com a parede do blastocoel é a menor. A adesão dominante com a camada hialina força a expansão do blastocisto e do blastocoel.
As células da blastula crescem cílios em sua superfície externa, secretam uma enzima hialinase (hialinase) e tornam-se nadadores livres.
AMPHIBIAN CLEAVAGE
Cleavage em muitos anfíbios é holoblástica com simetria radial, porém o grande volume de gema (sua mesolecitália) interfere com a clivagem. No pólo animal, a primeira clivagem ocorre a cerca de 1mm/min, enquanto que através do pólo vegetal ocorre 50-100 vezes mais lentamente (.02mm/min). Enquanto a primeira clivagem ainda é incompleta na região gema vegetal do ovo, a segunda clivagem meridional começa a ocorrer.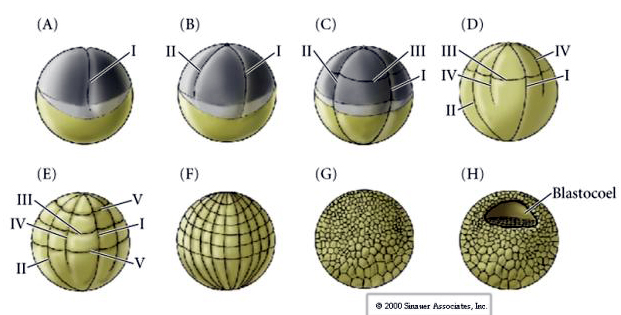
A terceira clivagem é equatorial, mas porque os núcleos e asas são deslocados para o plano de clivagem animal, embora perpendicular ao eixo animal vegetal também é deslocado para o pólo animal e não divide igualmente os blastômeros. O resultado são quatro blastômeros animais menores (denominados MICROMERES) e quatro grandes blastômeros de pólo vegetal (denominados MACROMERES). Esta clivagem holoblástica desigual dá origem a um pólo animal de divisão mais rápida composto por micrómeros menores e um pólo vegetal de divisão mais lenta composto por macrómeros. O pólo animal logo é composto por muitos micrômeros pequenos e o pólo vegetal por alguns macrômeros grandes cheios de gema. Embora a formação do blastocoel comece com a primeira clivagem, ela não se torna óbvia até a fase de 128 células.
O QUE A FUNÇÃO FAZ O SERVIÇO BLASTOCOEL?
A blastocel separa espacialmente as células para que elas não se toquem umas às outras. As células no telhado do blastocoel normalmente se tornam ectodermas. Se você transplantar células do telhado do blastocoel ao lado das células vítreas na base do blastocoel, elas se diferenciarão como mesoderme. Os derivados mesodérmicos são normalmente produzidos a partir de células adjacentes aos precursores endodérmicos. Uma possibilidade que vamos explorar a fundo é que as células vegetais induzem através das interações célula-células as células adjacentes a se tornarem mesodérmicas. Assim, a formação do blastocoel pode ser necessária para evitar interações “indutivas” inadequadas entre as células iniciais do blastocisto. A segunda necessidade óbvia para o blastocoel pode ser durante o estágio subsequente de desenvolvimento, GASTRULAÇÃO, onde as células migram para o interior do blastocoel.
MAMMALIAN CLEAVAGE
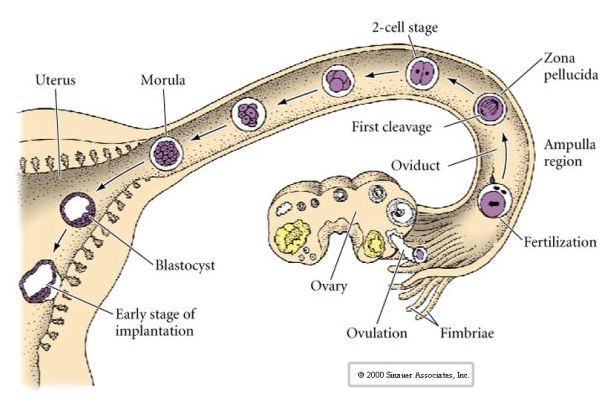
O óvulo mamífero é liberado do ovário para o oviduto onde é fertilizado. A primeira clivagem começa cerca de um dia após a fertilização dentro do oviduto. Em contraste com a maioria dos animais, a clivagem nos mamíferos pode ser muito lenta—1/dia.
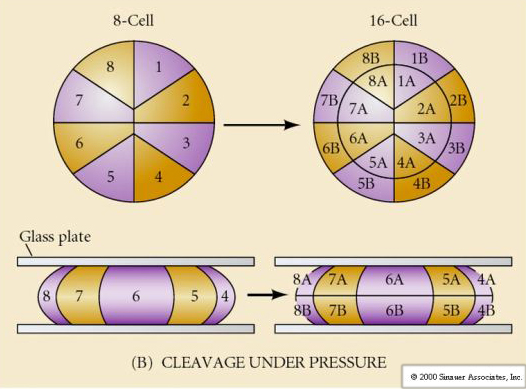
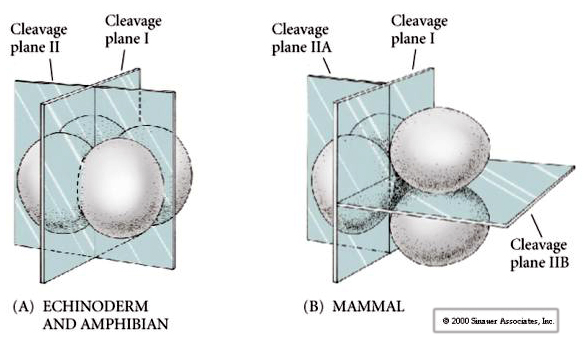 Adicionalmente, os planos de clivagem são um pouco diferentes dos outros animais. A primeira clivagem é meridional tal como o ouriço-do-mar e o sapo. No entanto, a segunda divisão da clivagem vê um dos blastômeros dividindo meridionalmente e o outro equatorialmente! Este tipo de clivagem é chamado ROTATIONAL HOLOBLASTIC CLEAVAGE.
Adicionalmente, os planos de clivagem são um pouco diferentes dos outros animais. A primeira clivagem é meridional tal como o ouriço-do-mar e o sapo. No entanto, a segunda divisão da clivagem vê um dos blastômeros dividindo meridionalmente e o outro equatorialmente! Este tipo de clivagem é chamado ROTATIONAL HOLOBLASTIC CLEAVAGE.
Uma outra característica única da clivagem dos mamíferos é que as clivagens dos blastômeros são assíncronas. (em comparação com a sincronia do ouriço-do-mar e da rã até a transição da blástula média). A clivagem do embrião do mamífero é regulada pelo núcleo ziótico desde o início.
Na terceira clivagem os blastômeros formam uma bola de células frouxamente associadas tal como os outros animais que estudamos. Antes da quarta clivagem as células da blástula mudam dramaticamente o seu comportamento umas em relação às outras. Elas tentam rapidamente maximizar o seu contacto com os outros blastómeros e ao fazê-lo fazem com que a blastula se compacte.

Esta COMPACÇÃO resulta em parte da produção de uma nova molécula de adesão UVOMORULIN (E-Cadherin) e é estabilizada pela formação de junções apertadas entre as células exteriores que, tal como no ouriço-do-mar, selam o interior da blastula a partir do exterior. As células também formam junções entre si que permitem a passagem de pequenas moléculas, tais como íons e algumas moléculas de segundos mensageiros como Ca++ e C-AMP. A mórula compactada de 16 células é constituída por uma casca externa de células e algumas células (1-2) completamente internas. A maioria das células externas dão origem às CÉLULAS TROBLÁSTICAS OU TROFECTODÉRMICAS. Estas células não contribuem para o embrião propriamente dito, mas são necessárias para a implantação do embrião na parede uterina e formam os tecidos do CORIANO, um componente essencial da placenta de que falaremos mais tarde.
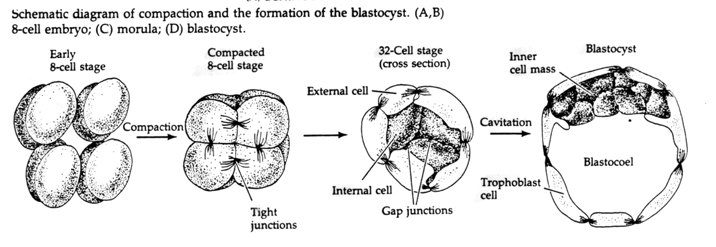
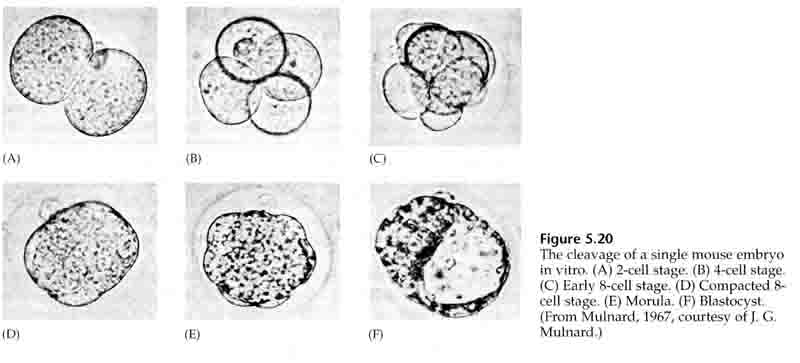
As células do embrião são derivadas das poucas células internas da blástula em estágio de 16 células. Estas células geram a massa celular interna da célula a partir da qual o embrião inteiro se desenvolve. Pela 6ª clivagem, as 64 células do estágio de 64 células, a massa celular interna e a camada trofoblástica estão completamente separadas. O fluido secreto dos trofoblastos é criado internamente para criar o blastocoel. O embrião é agora chamado de blastocisto.
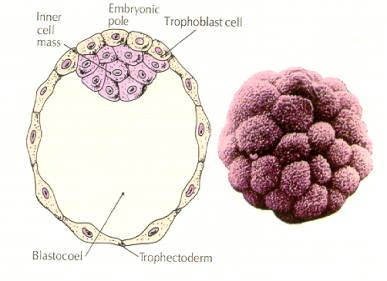 FORMAÇÃO DA MASSA DE CÉLULAS INTERNAS
FORMAÇÃO DA MASSA DE CÉLULAS INTERNAS
Como são criadas essas células de massa celular interna? Existem alguns blastômeros fadados por fatores intrínsecos a se tornarem progenitores de massa celular interna? A resposta parece ser não. Todos os primeiros blastômeros parecem ser totipotentes e a determinação de quais células irão contribuir para a camada trofoblástica e quais para a massa celular interna simplesmente uma questão de posição casual. As células de um embrião em estágio de 4 células, que normalmente dará origem tanto à massa celular interna quanto às células do tefctoderma, transplantadas para o exterior de um embrião em estágio de 32 células, dão origem apenas ao tefctoderma. Elas não contribuem para o embrião propriamente dito. Lembre-se da palestra anterior sobre clonagem que a fusão de dois embriões de camundongo em estágio de 8 células resulta em um embrião normal, sugerindo que todas as células nesse estágio são totipotentes.
MEROBLASTIC CLEAVAGE
Em ovos telolecitálicos e centrolecitálicos a gema grande e densa impede a clivagem. Os ovos telolectais são característicos das aves, peixes e répteis enquanto que os ovos centrolectais são característicos dos insetos. Os ovos telolecíticos resultam em clivagem discóides meroblástica. A clivagem é restrita ao blastodisco no pólo animal do ovo. Nas clivagens iniciais, porque a clivagem não pode prosseguir através da gema, os blastômeros são contínuos em suas margens vegetais.
Este filme de desenvolvimento do zebrafish de Wolf Karlstrom é excelente. (Filme de Paul Myers)
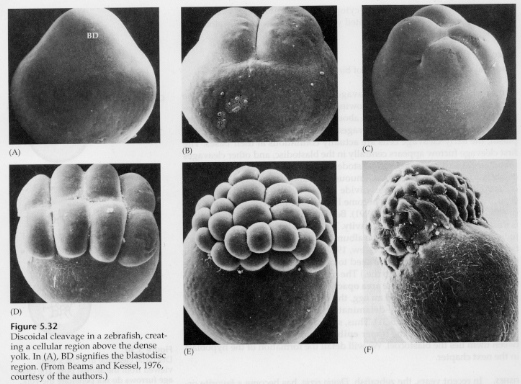 Não é até as clivagens equatoriais que as células do blastoderm se separam da gema. Outras clivagens equatoriais criam um blastoderm multicamadas com três ou quatro células de espessura.
Não é até as clivagens equatoriais que as células do blastoderm se separam da gema. Outras clivagens equatoriais criam um blastoderm multicamadas com três ou quatro células de espessura.
Nas aves forma-se um espaço entre o blastoderm e a gema chamado cavidade SUBGERMINAL. Pelas 16 divisões (60.000 células) as células do blastoderm migram para a cavidade subgerminal para formar uma segunda camada. As duas camadas são chamadas de EPIBLAST externo e HYPOBLAST interno com o blastocoel entre elas. Estudaremos isto mais detalhadamente quando discutirmos a gastrulação de aves e mamíferos
Ovos centrais de artrópodes submetidos a uma CLEAVA SUPERFICIAL. A grande massa central da gema confina as clivagens à borda citoplasmática do ovo.
Uma variação interessante e informativa é vista nos insetos. Os núcleos zigóticos se dividem com a clivagem. Isto é, os núcleos sofrem cariocineses—- divisão mitótica do núcleo… sem citoquineses… a divisão da célula. Estes núcleos nus são chamados de ENERGÍCIA. Os núcleos se dividem a uma velocidade surpreendente— cada 8 minutos (toda a embriogênese leva apenas 22 horas).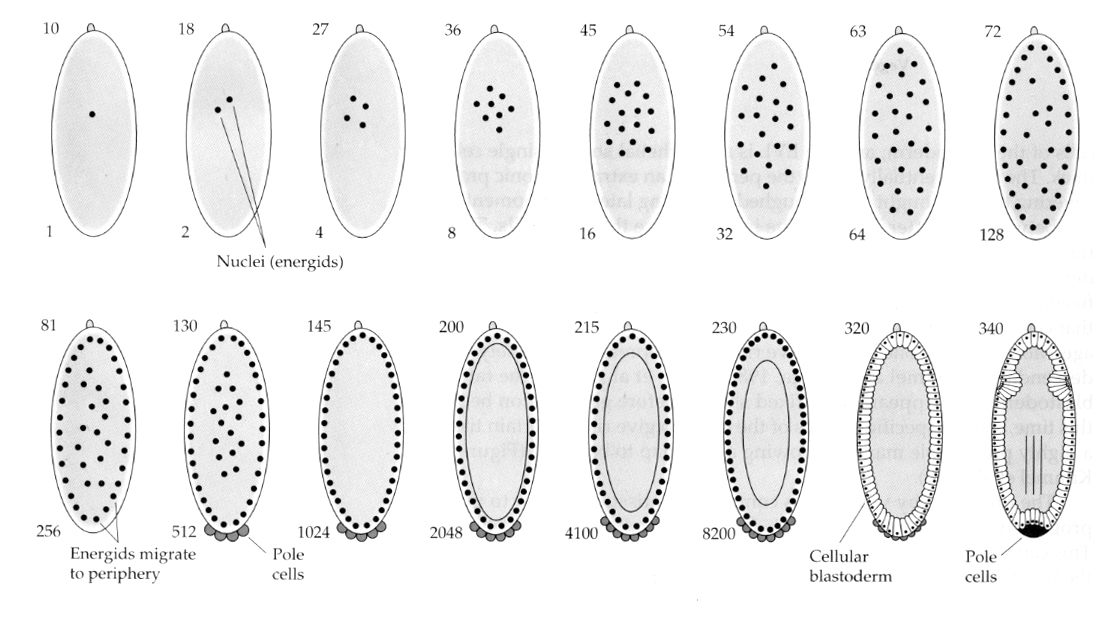
 Após várias rodadas de cariocinese os núcleos nus migram para a periferia do ovo. Nesta fase é chamado de BLASTODERME SINCÍTICO porque todos os núcleos partilham o mesmo citoplasma. A celularização ocorre aproximadamente na 14ª divisão nuclear para criar o BLASTODERMO CELULAR. Após este tempo as células se dividem de forma assíncrona. Isto corresponde à transição entre a meia-blástula dos sapos e ouriços-do-mar. (transição da expressão gênica materna para a primariamente zigótica) Lembre-se que a transição de midblastula foi pensada para ser desencadeada pela razão de cromatina para citoplasma. Evidências para este mecanismo em moscas são vistas através do exame de embriões mutantes haplóides. Estes embriões são submetidos à transição da midblastula e à celularização uma divisão mais tarde 15. Além disso, pode-se acelerar a celularização ligando o óvulo e reduzindo o volume do citoplasma. Embora o estágio sincítico blastodérmico sugira que todos os núcleos são equipotentes na medida em que não parecem existir barreiras difusoras aos determinantes citoplasmáticos, na verdade o citoplasma é muito regionalizado e os núcleos têm domínios citoplasmáticos altamente organizados ao seu redor.
Após várias rodadas de cariocinese os núcleos nus migram para a periferia do ovo. Nesta fase é chamado de BLASTODERME SINCÍTICO porque todos os núcleos partilham o mesmo citoplasma. A celularização ocorre aproximadamente na 14ª divisão nuclear para criar o BLASTODERMO CELULAR. Após este tempo as células se dividem de forma assíncrona. Isto corresponde à transição entre a meia-blástula dos sapos e ouriços-do-mar. (transição da expressão gênica materna para a primariamente zigótica) Lembre-se que a transição de midblastula foi pensada para ser desencadeada pela razão de cromatina para citoplasma. Evidências para este mecanismo em moscas são vistas através do exame de embriões mutantes haplóides. Estes embriões são submetidos à transição da midblastula e à celularização uma divisão mais tarde 15. Além disso, pode-se acelerar a celularização ligando o óvulo e reduzindo o volume do citoplasma. Embora o estágio sincítico blastodérmico sugira que todos os núcleos são equipotentes na medida em que não parecem existir barreiras difusoras aos determinantes citoplasmáticos, na verdade o citoplasma é muito regionalizado e os núcleos têm domínios citoplasmáticos altamente organizados ao seu redor.
MECANISMOS DE CLEAVAGEM
Ciclo Celular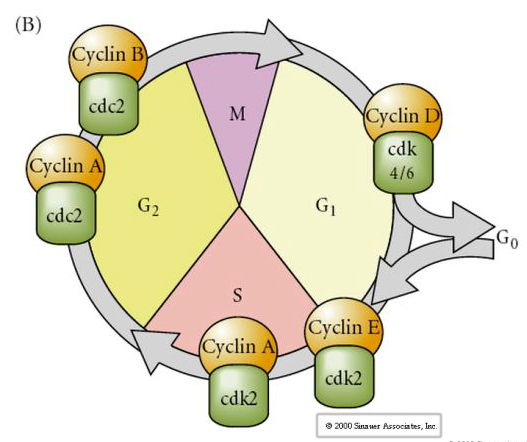
M-mitose
G1- lacuna pré-replicação
S- síntese de DNA
G2-l lacuna pré-mitose
Em fase de clivagem embriões como sapos e moscas os blastômeros vão diretamente de M a S sem intervir nos estágios G1 ou G2. Após a transição da blastula média as células em ambos os animais têm um G1 e um G2. Experiências com transplantes elegantes demonstraram que é o citoplasma que regula tanto a caricocinesia como a citoquinese. Se os núcleos das células divididas são transplantados em oócitos eles imediatamente param de se dividir.
 Conversamente se os núcleos das células não divididas são colocados em ovos enucleados fertilizados eles começam a se dividir. Ovos enucleados ativados artificialmente sem centríolos sofrerão contrações corticais que lembram a clivagem. Alguns dos fatores citoplasmáticos que regulam a divisão celular no embrião precoce foram identificados.
Conversamente se os núcleos das células não divididas são colocados em ovos enucleados fertilizados eles começam a se dividir. Ovos enucleados ativados artificialmente sem centríolos sofrerão contrações corticais que lembram a clivagem. Alguns dos fatores citoplasmáticos que regulam a divisão celular no embrião precoce foram identificados.
FATOR CITOSTÁTICO (CSF) é elevado após a primeira divisão meiótica e prende o oócito na segunda metáfase meiótica. Após a fertilização o Ca inactiva o LCR, a meiose é completada e o pronúcleo funde-se.
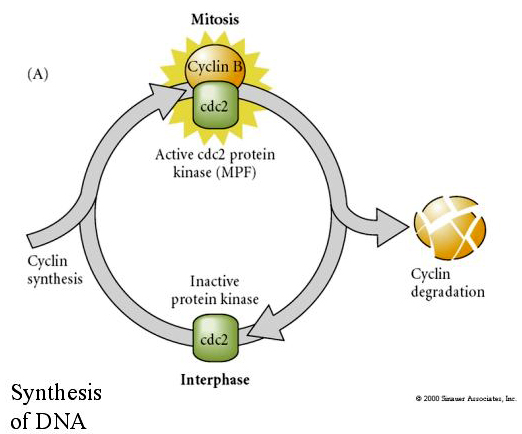
FATOR PROMOTIVO DA MITOSE (FATOR MPF) faz com que as células entrem na fase M. Causas da ativação do Fator MPF: 1. condensação cromossômica por fosforilação H1 histone, 2. quebra do envelope nuclear por hiperfosforilação de 3 laminas nucleares, 3. inibição da polimerase do RNA para desligar a transcrição, 4. fosforilação da subunidade reguladora da miosina para inibir a citocinese.
Modelo de regulação cíclica do ciclo celular durante os estágios de clivagem da embrogenese. O MPF induz a célula a proceder de S a M. O CSF liga-se ao MPF e evita a sua inactivação. A célula permanece em M. Ca aumenta e causa a inativação do CSF que por sua vez leva à inativação do MPF e a célula prossegue através de M a S e o ciclo se repete. O MPF é composto por duas subunidades, Cyclin B e cdc2. É a ciclina B que passa por uma síntese específica do ciclo celular e degradação regulada pelo núcleo celular para controlar o ciclo celular em células somáticas normais. No entanto, durante a ovulação o ovo é carregado com “reguladores” da ciclina B e do mRNA da ciclina B para que sua síntese seja regulada por fatores maternos independentes do núcleo zigótico. Assim, não é até que os componentes maternos “se esgotem” que o núcleo zigótico assume e um ciclo celular normal (M, G1, S, G2) retorna.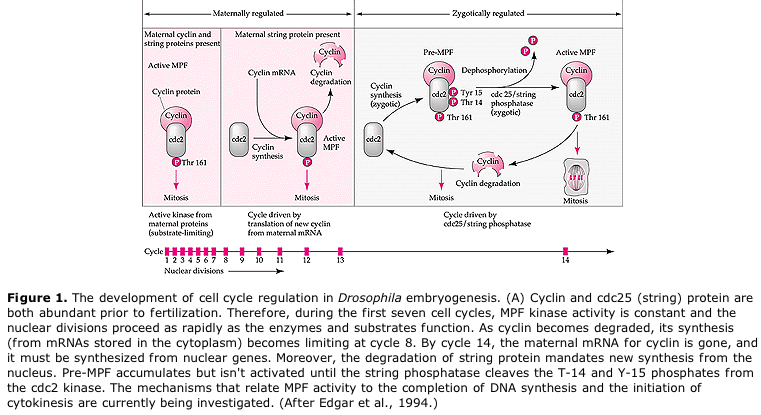
CELLL DETERMINAÇÃO FATAL
Cytoplasmic Localization of DETERMINANTS as a general and basic mechanism for early patterning (Examples Tunicate and Sea Urchin). Uma questão importante da biologia do desenvolvimento é quando e como os destinos celulares são determinados durante o desenvolvimento. Isto está intimamente relacionado com a questão de como a formação de padrões ocorre durante o desenvolvimento. O embrião não só deve gerar o número e o tipo correto de células diferenciadas, mas elas devem ser organizadas da forma correta em relação a todas as outras células do embrião para formar um animal funcional. Vamos examinar duas possibilidades de determinação do destino celular e de formação de padrões: 1. O destino celular pode ser determinado por fatores intrínsecos colocados no óvulo durante a ovulação e, em seguida, misturados a blastômeros específicos durante a clivagem, 2. Os sinais extrínsecos fornecidos pelo ambiente do embrião podem fornecer a informação de padrões para regular o destino celular. Como veremos a maioria dos organismos complexos usar uma combinação de sinais intrínsecos e extrínsecos para regular o destino celular e a formação do padrão embrionário.
A especificação do destino celular autônomo por determinantes citoplasmáticos sugere que o destino de uma célula é inteiramente dependente de sua linhagem, enquanto que o desenvolvimento “regulatório” sugere que o destino de uma célula é determinado por sinais externos de outras células. Estes dois mecanismos de especificação celular podem ser distinguidos experimentalmente por experimentos de isolamento, ablação e transplante. Se um blastmere isolado de um embrião se diferencia normalmente (como se ainda estivesse em sua posição normal no embrião) podemos dizer que ele deve ter determinantes intrínsecos que especifiquem seu destino. No entanto, se se diferenciar anormalmente, podemos dizer que o seu destino celular depende de sinais externos. Se abatermos um blastômero de um embrião e o embrião se desenvolver anormalmente, faltando todos os destinos celulares que normalmente surgem do blastômero ablacionado, dizemos que o desenvolvimento é autônomo celular e intrinsecamente especificado. Contudo, se o embrião se desenvolve normalmente dizemos que os restantes blastómeros podem regular o seu destino celular para compensar as células em falta. Se uma célula transplantada mantém seu destino celular baseado em sua posição original então dizemos que seu destino foi determinado, se assume um novo destino baseado em sua posição recém transplantada dizemos que seu destino é regulado por sinais externos de células próximas.
LOCALIZAÇÃO CITTOPLÁSMICA E REGULAMENTO NO TUNICADO EGG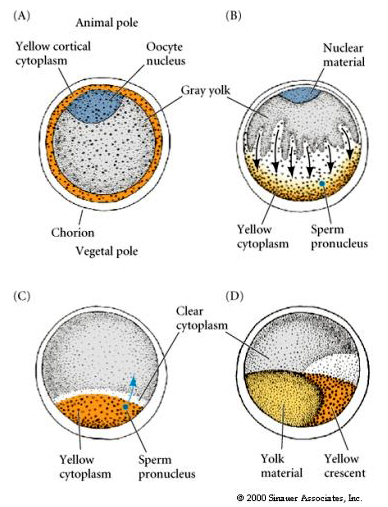
No final da oogênese o ovo sintonizado tem um pólo animal e vegetal claramente distinto. Existe um citoplasma cortical amarelo que rodeia um citoplasma interior cinzento gema. O núcleo do oócito é deslocado em direção ao pólo animal. A entrada de esperma no hemisfério vegetal fertiliza o óvulo e inicia o desenvolvimento. Um rearranjo dramático do citoplasma do óvulo ocorre após a fertilização dando origem a citoplasmas regionalmente coloridos que parecem estar correlacionados com os subsequentes blastômeros.
 Nota o mapa de destino correlaciona com os diferentes citoplasmas coloridos do embrião sintonizado. Não se confunda com as diferentes cores em duas figuras. O citoplasma “laranja” amarelo crescente está correlacionado com os destinos dos músculos e o citoplasma Yolky (amarelo) está correlacionado com os destinos endodérmicos. O citoplasma cinza (branco ou roxo azulado) acima da lua crescente amarela está correlacionado com o ectoderma neural.
Nota o mapa de destino correlaciona com os diferentes citoplasmas coloridos do embrião sintonizado. Não se confunda com as diferentes cores em duas figuras. O citoplasma “laranja” amarelo crescente está correlacionado com os destinos dos músculos e o citoplasma Yolky (amarelo) está correlacionado com os destinos endodérmicos. O citoplasma cinza (branco ou roxo azulado) acima da lua crescente amarela está correlacionado com o ectoderma neural.
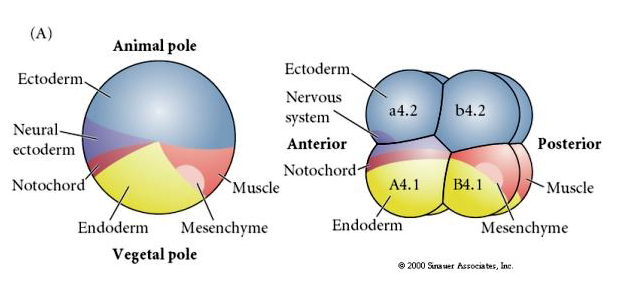
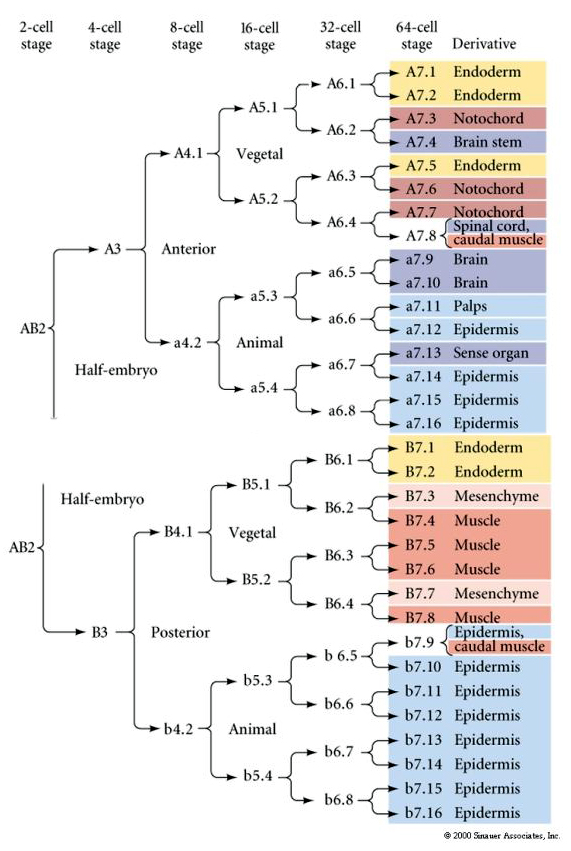 Este mapa de linhagem mostra a correlação da linhagem invariante com os blastômeros associados a citoplasmas de cor particular pelas clivagens invariantes das células. Entretanto, clivagens e linhagens invariantes não necessariamente provam especificação de células autônomas por determinantes citoplasmáticos.
Este mapa de linhagem mostra a correlação da linhagem invariante com os blastômeros associados a citoplasmas de cor particular pelas clivagens invariantes das células. Entretanto, clivagens e linhagens invariantes não necessariamente provam especificação de células autônomas por determinantes citoplasmáticos.
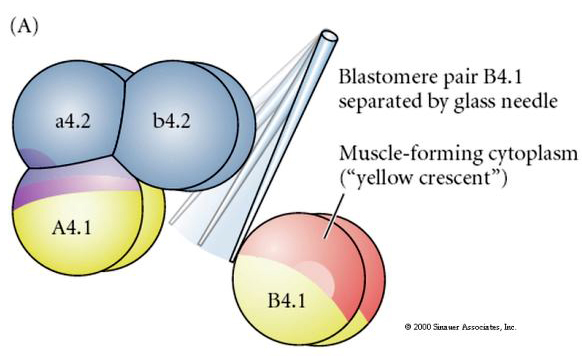 Manipulações experimentais são necessárias para testar a determinação reguladora versus a determinação autônoma do destino celular. As experiências clássicas de isolamento mostradas nas três figuras seguintes tentam mostrar que o destino celular é determinado por determinantes citoplasmáticos que eles adquirem através de clivagens estereotipadas. Uma agulha de vidro é usada para separar o par de blastômeros B4.1 do resto do embrião. Os blastômeros B4.1 normalmente adquirem o citoplasma amarelo crecente correlacionado com o destino das células musculares.
Manipulações experimentais são necessárias para testar a determinação reguladora versus a determinação autônoma do destino celular. As experiências clássicas de isolamento mostradas nas três figuras seguintes tentam mostrar que o destino celular é determinado por determinantes citoplasmáticos que eles adquirem através de clivagens estereotipadas. Uma agulha de vidro é usada para separar o par de blastômeros B4.1 do resto do embrião. Os blastômeros B4.1 normalmente adquirem o citoplasma amarelo crecente correlacionado com o destino das células musculares.
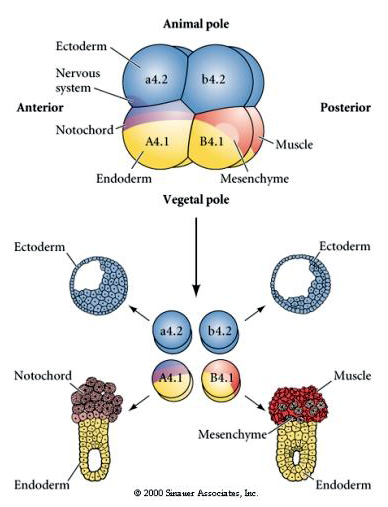
Aqui podemos ver os resultados dos experimentos de isolamento. Em cada caso os blastômeros isolados dão origem apenas àquele subconjunto de destinos celulares que normalmente produziriam no embrião intacto. Os blastômeros isolados não regulam o seu destino para compensar os seus vizinhos desaparecidos. Os blastômeros de polos animais, a4.2 e b4.2, dão origem apenas a células ectodérmicas. A4.1 dá origem a células notocorda e endodérmicas, enquanto que B4.1 dá origem a células musculares e endodérmicas. Nenhum dos blastômeros isolados pode dar origem a todos os componentes celulares de um embrião normal.
A próxima experiência abaixo usa uma agulha para manipular o plano de clivagem equatorial de modo que seja mais vegetal do que o normal e agora os blastômeros do pólo animal, b4.2, adquirem um pouco do citoplasma “crescente amarelo”. Quando estes blastômeros são isolados eles agora dão origem a algumas células musculares. Isto demonstra bem que o citoplasma “lua crescente amarela” pode determinar o destino das células musculares e pode fazê-lo de forma autónoma.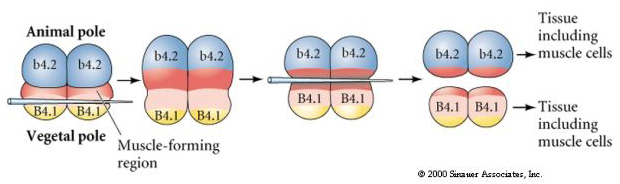
LOCALIZAÇÃO E REGULAMENTAÇÃO NO MAR URCHIN EGG
Um canal gelatinoso define a localização do pólo animal e reflecte a polaridade precoce do ovo. O padrão precoce das clivagens não depende do local de entrada dos espermatozóides, mas é determinado pela polaridade/asimetria intrínseca do óvulo. Boveri (1901) descreveu uma faixa subequatorial de pigmento disposta ortogonalmente ao eixo animal-vegetal. Estes grânulos também indicaram a localização do citoplasma que posteriormente é incluído nas células do arquétrio. Horstadius (1928) separou os blastômeros animais e vegetais e mostrou que apenas os blastômeros vegetais dariam origem aos micrômeros, gastruiriam e formariam esqueleto. Sua conclusão foi que fatores citoplasmáticos localizados na metade vegetal são necessários para micrômeros, gastrulação e formação de esqueleto. Remmbrar o padrão de clivagens precoces. Os micrômeros surgem durante a quarta clivagem (estágio de 16 células) a partir de uma divisão equatorial desigual dos blastômeros do pólo vegetal.
Remmbrar o padrão de clivagens precoces. Os micrômeros surgem durante a quarta clivagem (estágio de 16 células) a partir de uma divisão equatorial desigual dos blastômeros do pólo vegetal.
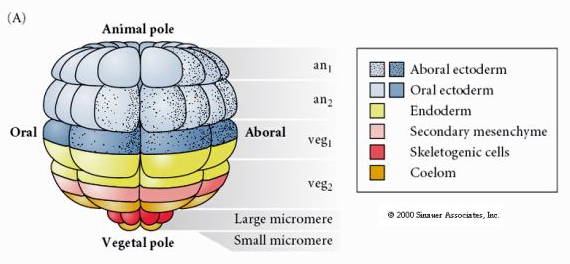 Este mostra o mapa de destino da blástula de ouriço-do-mar em estágio de 64 células. Note que os micrómeros são as células mesenquimais primárias e dão origem ao esqueleto larval (os espículas em estágio de pluteus).
Este mostra o mapa de destino da blástula de ouriço-do-mar em estágio de 64 células. Note que os micrómeros são as células mesenquimais primárias e dão origem ao esqueleto larval (os espículas em estágio de pluteus).
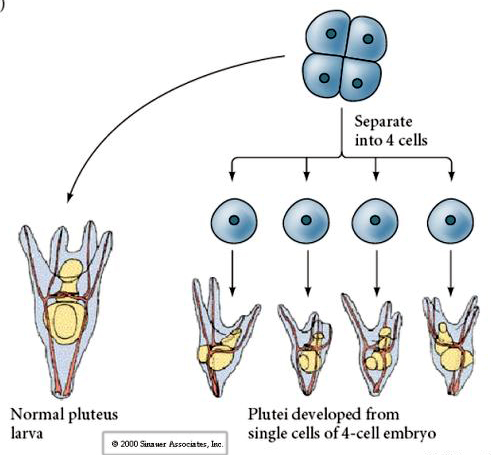 No estágio de quatro células, se os blastômeros são isolados uns dos outros eles são capazes de “regular” seu destino e dar origem a 4 pequenas larvas em estágio de pluteus.
No estágio de quatro células, se os blastômeros são isolados uns dos outros eles são capazes de “regular” seu destino e dar origem a 4 pequenas larvas em estágio de pluteus.
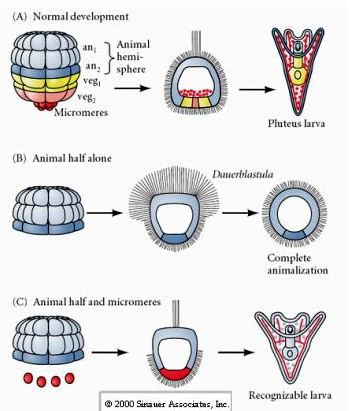 Em contraste, em estágios posteriores, se você isolar os meio blastômeros animais você verá que eles só produzem uma dauerblastula “animalizada” que não expressa nenhum destino celular mesodérmico ou endodérmico. Os semi-blastômeros vegetais isolados dão origem a larvas que expressam o destino das células ectodérmicas, mesodérmicas e endodérmicas, mostrando que o destino dessas células pode ser regulado. Os micrómeros isolados (mesênquima primária) sofrem o número correto de divisões celulares e SEMPRE dão origem a espículas na programação. Assim, os micrómeros são definitivamente especificados como os precursores das células do mesênquima esqueletogênico quando eles aparecem pela primeira vez no estágio de 16 células. Os experimentos chave foram colocar os micrômeros junto com os blastômeros dos polos animais e mostrar que embora o destino dos micrômeros fosse “fixo ou determinado” no momento de seu nascimento, os micrômeros foram capazes de “induzir” novos destinos celulares nos blastômeros dos polos animais. Os micrômeros foram capazes de induzir o destino endodérmico e mesodérmico nos blastômeros dos polos animais! Assim, o experimento tardio em “C” mostra que quando micrômeros são adicionados a uma meia blástula animal você pode agora induzir a formação de uma larva reconhecível expressando os destinos endodérmicos, mesodérmicos e ectodérmicos.
Em contraste, em estágios posteriores, se você isolar os meio blastômeros animais você verá que eles só produzem uma dauerblastula “animalizada” que não expressa nenhum destino celular mesodérmico ou endodérmico. Os semi-blastômeros vegetais isolados dão origem a larvas que expressam o destino das células ectodérmicas, mesodérmicas e endodérmicas, mostrando que o destino dessas células pode ser regulado. Os micrómeros isolados (mesênquima primária) sofrem o número correto de divisões celulares e SEMPRE dão origem a espículas na programação. Assim, os micrómeros são definitivamente especificados como os precursores das células do mesênquima esqueletogênico quando eles aparecem pela primeira vez no estágio de 16 células. Os experimentos chave foram colocar os micrômeros junto com os blastômeros dos polos animais e mostrar que embora o destino dos micrômeros fosse “fixo ou determinado” no momento de seu nascimento, os micrômeros foram capazes de “induzir” novos destinos celulares nos blastômeros dos polos animais. Os micrômeros foram capazes de induzir o destino endodérmico e mesodérmico nos blastômeros dos polos animais! Assim, o experimento tardio em “C” mostra que quando micrômeros são adicionados a uma meia blástula animal você pode agora induzir a formação de uma larva reconhecível expressando os destinos endodérmicos, mesodérmicos e ectodérmicos.
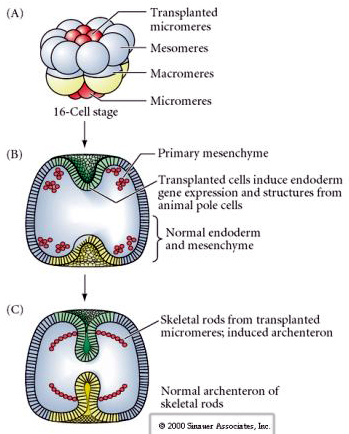 O conjunto final de experimentos demonstra que mesmo em um embrião normal, se você transplantar micrômeros para a tampa do pólo animal você pode induzir um archenteron secundário e alterar o padrão axial normal. Isto novamente argumenta que os micrômeros adquirem um derminante citoplasmático específico do seu destino celular e que eles fornecem o sinal indutivo que padrão as estruturas axiais do embrião do uchin do mar. O destino dos micromeros não pode ser alterado, mas os sinais dos micromeros podem alterar o destino de todos os outros blastômeros.
O conjunto final de experimentos demonstra que mesmo em um embrião normal, se você transplantar micrômeros para a tampa do pólo animal você pode induzir um archenteron secundário e alterar o padrão axial normal. Isto novamente argumenta que os micrômeros adquirem um derminante citoplasmático específico do seu destino celular e que eles fornecem o sinal indutivo que padrão as estruturas axiais do embrião do uchin do mar. O destino dos micromeros não pode ser alterado, mas os sinais dos micromeros podem alterar o destino de todos os outros blastômeros.
Horstadius: (1928, 1935) mostrou experimentalmente que num embrião de 16 células todos os níveis de blastómeros, excepto os micrómeros, irão assumir diferentes destinos quando transplantados para posições diferentes em embriões quiméricos. O arcentroon se desenvolverá a partir dos blastômeros veg 1 se as células veg 2 forem removidas e os micrômeros forem colocados em contato com a camada veg 1. Na ausência de micrômeros, os blastômeros vegetais 2 dão origem a estruturas esqueléticas e arcenteron. Classicamente, um gradiente animal-vegetal de duelo foi invocado para explicar estes resultados. Entretanto, estes resultados apenas indicam que interações indutivas decisivas ocorrem entre camadas de blastômeros adjacentes.
Micrométricos individuais plantados próximos ao pólo animal inibem a formação de tufos apicais e em alguns casos induzem um novo eixo embrionário. Os blastômeros Veg 2 também induzirão mudanças similares aos micrômeros quando transplantados próximos aos blastômeros de pólo animal.
ResULTAGENERAL DAS TRANSPLANTAÇÕES: o destino de determinados blastômeros é sempre afetado pela aposição de diferentes células vizinhas que os conjuguem em embriões normais.
HIPOTESE: determinantes citoplasmáticos maternos localizados especificam certas células no embrião normal, em particular os micrômeros e os precursores dos arcentéricos próximos ao pólo vegetal. Estas células determinam então indutivamente os destinos dos blastômeros vizinhos, que por sua vez interagem com os seus vizinhos. Muitos dos blastômeros retêm potencialidades diferentes daquelas que normalmente expressam, e por algum tempo estes blastômeros são apenas reversivelmente especificados, como requerido para um sistema de desenvolvimento que depende em grande parte da indução.