- Paarungsfalter (Tineidae, Ditrysia, Lepidoptera), erhalten als gefrorener Verhaltenseinschluss in Baltischem Bernstein (Eozän)
- ABSTRACT
- EINFÜHRUNG
- MATERIALIEN UND METHODEN
- SYSTEMATISCHE PALÄONTOLOGIE
- DISKUSSION
- Zufälliges Zusammentreffen oder eine erhaltene Paarung?
- Taphonomie
- Geschlechtsdimorphismus
- Habitat
- ZUSAMMENFASSUNG
- ANMERKUNGEN
Paarungsfalter (Tineidae, Ditrysia, Lepidoptera), erhalten als gefrorener Verhaltenseinschluss in Baltischem Bernstein (Eozän)
Thilo C. Fischer und Marie K. Hörnig
Artikelnummer: 22.1.7
https://doi.org/10.26879/829
Copyright Paleontological Society, February 2019
Autorenbiografien
Plain-language und multi-lingual abstracts
PDF version
Submission: 22 Octobere 2017. Annahme: 23. Januar 2019
{flike id=2421}
ABSTRACT
Die Untersuchung von Bernsteineinschlüssen bietet einen einzigartigen Einblick in die Biologie von Tieren, die vor Millionen von Jahren lebten, aufgrund ihrer außergewöhnlichen Erhaltung unter nahezu lebensähnlichen Bedingungen. Dies gilt nicht nur für morphologische Aspekte, auch Verhaltensweisen lassen sich aus diesen Fossilien ableiten.
Hier werden Microlepidoptera aus eozänem baltischen Bernstein berichtet, die höchstwahrscheinlich das erste Vorkommen von fossilen Lepidoptera in Kopula darstellen. Die Falter gehören zu den Tineidae (zu denen auch die Kleidermotten gehören) und werden als neue Art und neue Gattung, Forcepsites michalskii, beschrieben. Das Umklammerungsorgan des Männchens ist für Motten aus baltischem Bernstein recht ungewöhnlich und besteht aus einem ventralen und einem dorsalen Teil, die jeweils in zwei parallelen, dornartigen Fortsätzen enden und offenbar nicht von den Valven gebildet werden. Das gemeinsame Vorkommen von Männchen und Weibchen, wahrscheinlich in Kopula, ermöglichte die direkte Untersuchung ihres Sexualdimorphismus, und es gibt Hinweise darauf, dass der Lebensraum dieser Art der Ort der Harzproduktion im baltischen Bernsteinwald ist. Aus dem Sexualdimorphismus der Fühler und der Augenmorphologie wird interpretiert, dass bei dieser Art das Weibchen das rufende Geschlecht für die Paarung war.
Thilo C. Fischer. Förderverein der Bayerischen Staatssammlung für Paläontologie und Historische Geologie München Richard-Wagner-Straße 10, D-80333 München, Deutschland.
Marie K. Hörnig. Universität Greifswald, Zoologisches Institut und Museum, Zytologie und Evolutionsbiologie, Soldmannstr. 23, D-17489 Greifswald, Deutschland.
SCHLÜSSELWÖRTER: Kleidermotten; Lebensraum in Kopula; Microlepidoptera; neue Arten und Gattungen; Sexualdimorphismus
Endzitat: Fischer, Thilo C., und Hörnig, Marie K. 2019. Paarungsfalter (Tineidae, Ditrysia, Lepidoptera), erhalten als gefrorener Verhaltenseinschluss in Baltischem Bernstein (Eozän). Palaeontologia Electronica 22.1.7A 1-11. https://doi.org/10.26879/829
palaeo-electronica.org/content/2019/2421-mating-moths
Copyright: Februar 2019 Paleontological Society.
Dies ist ein Open-Access-Artikel, der unter den Bedingungen von Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) verbreitet wird, was den Nutzern erlaubt, das Material in jedem Medium oder Format zu kopieren und weiterzuverbreiten, vorausgesetzt, es wird nicht für kommerzielle Zwecke verwendet und der ursprüngliche Autor und die Quelle werden genannt, mit Hinweisen, wenn Änderungen vorgenommen werden.
creativecommons.org/licenses/by-nc-sa/4.0/
http://zoobank.org/BCF64D89-6879-4805-8021-7CE926CE4B12
EINFÜHRUNG
Paarungswillige Insekten werden selten in Bernstein als Fälle des sogenannten „eingefrorenen Verhaltens“ gefunden (Arillo, 2007, und Verweise darin). Solche wurden aus eozänem baltischen Bernstein berichtet, zum Beispiel aus den Gruppen Diptera, Coleoptera, Hemiptera, Hymenoptera und ganz selten Trichoptera (Weitschat und Wichard, 2002; Weitschat, 2009; Boucot und Poinar Jr., 2010; Gröhn, 2016).
In baltischem Bernstein sind Lepidoptera generell selten und kommen in etwa einem von 250 Einschlüssen vor (zum Vergleich: Dipteren machen etwa 64 % aller Insekten im Baltischen Bernstein aus, Lepidoptera etwa 0,4 %; Hoffeins und Hoffeins 2003; Gröhn 2016). Wie bei anderen Insekten sind in Kopula erhaltene Imagos viel seltener, und Lepidoptera in Kopula wurden bisher noch nicht beschrieben, auch nicht in anderen Bernsteinen oder aus Nicht-Bernstein-Lokalitäten (Sohn et al., 2012; Sohn und Lamas, 2013). Ein In-Copula-Vorkommen ermöglicht die zweifelsfreie Zuordnung beider Sexualformen zueinander und beider zusammen zu einer eigenen Art und damit die genaue Beschreibung des Sexualdimorphismus einer Art. Alternativ kann der Sexualdimorphismus bei fossilen Insekten nur dann mit statistischen Mitteln untersucht werden, wenn Funde einer Art reichlich vorhanden sind, wie bei vielen Nematocera (z.B., Borkent, 1995).
Tineidae sind hochgradig divergente basale Vertreter der Lepidopterengruppe Ditrysia (Regier et al., 2014), ihre Larven ernähren sich von einem breiten Spektrum an Substraten (Detritus, Pilze, Flechten oder Keratin) (Scoble, 1995), sind also Generalisten (85,7%) (Menken et al., 2009). Im Baltischen Bernstein machen die Tineidae etwa ein Viertel aller Lepidopterenfunde aus (Skalski, 1977). Hier wird eine seltene und neue Art der Tineidae mit ihren Sexualformen aus einem mutmaßlichen In-Kopula-Vorkommen beschrieben.
MATERIALIEN UND METHODEN
Das Bernsteinstück wurde von Artur Michalski (Wroclaw, Polen) gefunden und erworben. Es wurde durch Behandlung mit Acryllack konserviert und stammt aus der Sammlung des Autors (TF) mit der Sammlungsnummer 7131. Die Lagerung erfolgte bei konstanter Temperatur in Plastikklammerbeuteln in Metallboxen unter Ausschluss von Sauerstoff und Licht. Es wird in der Bayerischen Paläontologischen Staatssammlung München mit der Nummer SNSB-BSPG 2017 I 113 hinterlegt.
Das Exemplar wurde mit einer Canon EOS 70d fotografiert, die mit einem Canon MP-E 65 mm Objektiv und einem Canon Twin Flash MT-24 ausgestattet war. Um Reflexionen zu vermeiden, wurden Polarisationsfilter vor den Blitzen und dem Kameraobjektiv angebracht und eingestellt (kreuzpolarisiertes Licht). Um die Konvexität und Konkavität der Bernsteinoberfläche zu reduzieren, wurde ein Tropfen Glyzerin aufgetragen und mit einem Deckglas abgedeckt. Die aufgenommenen z-Stapel wurden mit Combine ZP fusioniert und mit Adobe Photoshop CS 3 weiterverarbeitet. Der Einschluss konnte nicht mit der Mikro-Computer-Tomographie untersucht werden, da metallische, scheinbar pyritische Einschlüsse vorhanden sind, die starke Artefakte verursachen.
SYSTEMATISCHE PALÄONTOLOGIE
Systematik (nach van Nieukerken et al., 2011)
Ordnung LEPIDOPTERA Linnaeus, 1758
Klasse DITRYSIA Börner, 1925
Überfamilie TINEOIDEA Latreille, 1810
Familie TINEIDAE Latreille, 1810
Genus Forcepsites nov. gen.
zoobank.org/DDB6884D-845A-4A87-981E-A2953ADD8964
Etymology. „Forceps“, lateinisch für Zange, bezieht sich auf das männliche Umklammerungsorgan.
Art Forcepsites michalskii nov. spec.
zoobank.org/5494D58E-7773-473C-AFB2-140DDD049226
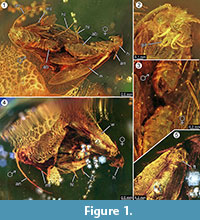 Holotypus. Exemplar ex coll. Fischer no. 7131, Abbildung 1.2
Holotypus. Exemplar ex coll. Fischer no. 7131, Abbildung 1.2
Locus typicus. Bernsteinmine von Yantarni, GUS
Stratum typicum. „Blaue Erde“ (oberes Eozän – unteres Oligozän)
Etymologie. Der Artname michalskii wurde gewählt, um Artur Michalski für die Bereitstellung dieses Exemplars zu danken.
Repository. Bayerische Staatssammlung für Paläontologie und Geologie, München, Deutschland; Hinterlegungsnummer SNSB-BSPG 2017 I 113.
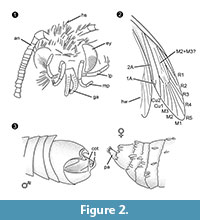
Gattungsdiagnose. Monotypische Gattung mit dem Umklammerungsorgan des Männchens (Abbildung 2.3) mit einem ventralen und dorsalen Teil, die jeweils in zwei parallelen, dornartigen Fortsätzen enden, als bestimmendes Merkmal.
 Artenbestimmung. Die jeweiligen qualitativen und quantitativen Merkmale der weiblichen und männlichen Imagos (Abbildung 1) wurden bestimmt und sind in Tabelle 1 zusammengefasst.
Artenbestimmung. Die jeweiligen qualitativen und quantitativen Merkmale der weiblichen und männlichen Imagos (Abbildung 1) wurden bestimmt und sind in Tabelle 1 zusammengefasst.
Differenzialdiagnose. Die Kombination der Merkmale kleiner Rüssel mit abgetrennten Galeen, lange und gefaltete Maxillarpalpen mit fünf Segmenten, nach oben gerichtete und leicht gebogene Labialpalpen mit seitlichen Borsten, Kopf mit vielen aufrechten haarähnlichen Schuppen legen eine Zugehörigkeit zu den Tineidae nahe, aber keine dieser Merkmale ist apomorph, noch ist eine solche Apomorphie derzeit für adulte Tineidae bekannt (Regier et al., 2014). Die Adern R4 und R5 sind nicht verschmolzen/gestielt, was ein Hinweis auf Gelechioidea (Gelechiidae und Oecophoridae) wäre (Scoble, 1995), die andere große Gruppe von Lepidoptera, die in baltischem Bernstein gefunden wurde. Die Art unterscheidet sich von allen beschriebenen Vertretern der Tineidae oder anderer Familien aus baltischem Bernstein (Rebel, 1934, 1935; Kuznezov, 1941; Skalski, 1973; Kozlov, 1987, 1988; Sohn et al., 2012; Sohn und Lamas, 2013), insbesondere in Bezug auf den männlichen Genitalapparat. Am ähnlichsten scheint Tineosemopsis decurtatus Skalski 1974 (Weibchen bekannt), unterscheidet sich aber durch das Fehlen von aufrechten Haaren am Scheitel und die kleineren Augen. Tillyardinea eocaenica Kusnezov 1941 (Weibchen), die aufrechte Schuppen am Scheitel und eine ähnliche Äderung hat, unterscheidet sich durch die Stirn und die Labialpalpen. Simulotinea intermedia Skalski 1977 hat einen ähnlichen Habitus, unterscheidet sich aber auch durch das Vorhandensein einer gegabelten Ader, die die große Zelle im Vorderflügel (M2+3) teilt.
Taphonomie. Männchen und Weibchen von Forcepsites michalskii sind nebeneinander fossilisiert und mit dem hinteren Teil des Abdomens zueinander gerichtet. Die beiden Einschlüsse befinden sich in einem zylindrischen Stück nicht-autoklavierten baltischen Bernsteins mit einem Durchmesser von 15 mm und einer Höhe von 11 mm, das auf etwa der Hälfte seiner Höhe durch einen unebenen Rand zwischen zwei Harzschichten geteilt ist. Dieser Rand weist eine Pyritschicht als Teil seiner Ebene auf. In einer Harzschicht befinden sich die beiden Motten, die ihre Rückenseiten zu dieser Grenze hin freilegen. Lange Schuppen, die vom Rand des weiblichen Flügels stammen, sind erhalten. Die weibliche Imago hat zwei Beine verloren, und ihr Thorax ist beschädigt. Die andere Strömung enthält nicht-lineare Reihen von Blasen. Beide Individuen scheinen frisch geschlüpft zu sein, da die Schuppen auf den Flügeln vollständig erhalten und die Flügel nicht zerfleddert sind. An Flügeln, Bauch und Beinen konnten keine Duftorgane festgestellt werden. Die einzigen bei den Microlepidoptera erhaltenen Syninclusionen sind Trichome, die für baltischen Bernstein typisch sind.
DISKUSSION
Zufälliges Zusammentreffen oder eine erhaltene Paarung?
Die beiliegenden Falter sind männliche und weibliche Vertreter der gleichen Art und liegen mit den Hinterleibern zueinander orientiert nebeneinander. Die Genitalien der Falter stehen jedoch nicht in direktem Kontakt, sondern in einer engen Position. Die dorsale/ventrale Ausrichtung von Männchen und Weibchen unterscheidet sich leicht, was auf eine leichte Drehung innerhalb der Körperachse (insbesondere beim Männchen) zurückzuführen ist. Die Ausrichtung des hinteren Teils des Hinterleibs beider Falter ist zueinander gerichtet.
Es sind mehrere Fälle bekannt, in denen die Situation des Einschlusses in das noch flüssige Harz eine Stressreaktion, wie die Eiablage, auslösen kann (Weitschat, 2009). Die Auslösung von Paarungsverhalten durch den Harzfluss ist generell nicht plausibel, aber die Situation des Einschlusses zeigt, dass leichte Bewegungen innerhalb des frischen Harzes möglich waren.
Es stellt sich auch die Frage, ob dieser Befund auch ein zufälliges Zusammentreffen darstellen könnte. Die Wahrscheinlichkeit für ein solches zufälliges Zusammentreffen lässt sich grob abschätzen. Unter den Insekteneinschlüssen kommen Motten mit einer Häufigkeit von etwa einem von 250 Einschlüssen in baltischem Bernstein vor (Krzeminskaet al., 1991 (0,6%); Hoffeins und Hoffeins, 2003 (0,4%); Sontag, 2003 (0,27%), und eigene Beobachtung). Bei einem einzelnen Bernstein mit einem Motteneinschluss beträgt die Wahrscheinlichkeit des zufälligen gleichzeitigen Auftretens einer anderen Motte einfach 1:250 (Motten treten nicht in Schwärmen auf). Das gleichzeitige Vorkommen desselben Taxons oder eines reichlich vorhandenen Taxons, das verwechselt werden könnte, wird bestenfalls auf 1:10 geschätzt (Skalski, 1977), und ein weiteres Vorkommen von etwa 1:2 bei unterschiedlichen Geschlechtern. Unter Berücksichtigung der weiteren Chancen für eine enge Anordnung, sowohl der Ausrichtung der Körperachsen, als auch einer geeigneten Körperorientierung, ist die Wahrscheinlichkeit für ein zufälliges gemeinsames Auftreten, das als Paarungsereignis fehlinterpretiert werden könnte, weitaus geringer als die beobachtete Häufigkeit von einem von 920 Lepidoptereneinschlüssen in der Sammlung des untersuchten Autors.
Die wahrscheinlichste Interpretation für diesen Befund ist, dass sich die Falter in Kopula befanden und die Genitalien in Kontakt waren, die Individuen aber durch den Harzfluss leicht voneinander entfernt waren (siehe Diskussion unten).
Taphonomie
Die Bedeutung einer sorgfältigen Analyse von Harzflüssen für die Taphonomie von Bernsteineinschlüssen wurde von Coty et al. (2014) mit ihrer Studie einer Ameisen-Termiten-Interaktion, die in mexikanischem Chiapas-Bernstein erhalten ist, demonstriert.
Das Auftreten eines In-Copula-Ereignisses wird durch die Entdeckung langer Schuppen, die vom Rand des weiblichen Flügels stammen und über eine gewisse Distanz in Richtung des Männchens drifteten, stark unterstützt. Dies könnte auf eine starke laminare Harzströmung an dieser Stelle hindeuten, die sich entlang ihrer gemeinsamen Achse bewegte und sie über die jetzt beobachtete kurze Distanz auseinander zog. Während der Paarung der Falter kann das Männchen den Kontakt zur Paarungsstelle verlieren und nur durch das Umklammerungsorgan am Weibchen befestigt sein, wobei nur das Weibchen Kontakt zur Oberfläche hat. Dieses Verhalten und der Luftzug durch den plötzlichen Harzfluss könnten der Grund dafür sein, dass das Weibchen seine beiden Hinterbeine verloren hat. An der Rückenseite des Falters, die an der konvexen Oberfläche dieses ersten laminaren Harzstroms freigelegt wurde, ist der Flügel des Weibchens und der darunter liegende Thorax teilweise beschädigt (Abbildung 1.5). Vermutlich handelt es sich bei diesen zerstörten Bereichen um Fraßspuren, die von anderen Insekten verursacht wurden, höchstwahrscheinlich von Ameisen, wie sie häufig in Bernsteinproben beobachtet werden. Nach dem ersten Harzfluss als Einbettungsereignis waren die Rückenseiten also für einige Zeit freigelegt, lange genug, um Raubtieren das Betreten dieser festen Oberfläche zu ermöglichen. Der zweite Harzfluss, der diese Seite später bedeckte, könnte ein schneller und turbulenter Harzfluss gewesen sein, worauf eine Reihe von kleinen, in unregelmäßigen Kurven angeordneten Bläschen hinweist, die darin gefunden wurden. Dies wäre ein typischer taphonomischer Prozess für eine sogenannte „Schlaube“ aus baltischem Bernstein (Gröhn, 2016).
Geschlechtsdimorphismus
Geschlechtsdimorphismus ist bei fossilen Arten, von denen meist nur wenige Exemplare bekannt sind, schwer zu beobachten. Um eine sichere Artbestimmung als Grundlage für die weitere Differenzierung zwischen den Geschlechtern und die Aufklärung des Sexualdimorphismus zu ermöglichen, müssen geschlechtsneutrale Merkmale diagnostisch sein. Bei stark geschlechtsdimorphen Arten, z. B. mit brachypteren Weibchen wie bei vielen Psychidae (Scoble, 1995), wäre ein Rückschluss auf die Zugehörigkeit beider Geschlechter zu einer Art kaum möglich. Daher können nur Fälle von schwachem Sexualdimorphismus bei fossilen Arten mit statistischen Mitteln zuverlässig erkannt werden, ohne sie in Kopula zu finden. Dies unterstreicht die Bedeutung von nachgewiesenem Paarungsverhalten bei fossilen Arten für die Beschreibung solcher Fälle von starkem Sexualdimorphismus. Solche erhaltenen Funde fossiler Paarung können auch die Zugehörigkeit von zuvor bekannten sexuell dimorphen Formen zu einer Art bestätigen, selbst ohne die Möglichkeit einer statistischen Unterstützung. Es besteht eine gewisse Chance, dass ein erhaltenes Paarungsereignis eine interspezifische oder intergenerische Paarung darstellt, wie sie von Nachtfaltern und Schmetterlingen bekannt sind (Ganyard und Brady, 1972; Deering und Scriber, 2002). Diese Phänomene sind jedoch viel seltener als intraspezifische Paarungen und werden wohl kaum als seltene Fossilien gefunden werden.
Ein nicht-allometrischer Sexualdimorphismus, der bei Forcepsites michalskii beobachtet wurde, sind die abgetrennten Galeen im Rüssel des Männchens. Dies könnte ein Hinweis auf einen nicht funktionalen Zustand sein, wobei die männlichen Imagines dieser Art nicht fressen, wie es bei vielen existierenden (männlichen) Psychidae mit rudimentärem oder fehlendem Rüssel der Fall ist (Scoble, 1995). Die hier gefundenen allometrischen Sexualdimorphismen sind: (1) Das Weibchen ist größer als das Männchen, sowohl in der Körpergröße als auch in der Flügellänge. Die jeweiligen Verhältnisse sind jedoch fast gleich. (2) Beim Weibchen ist der Hinterleib im Vergleich zum Männchen relativ und absolut breiter. (3) Die Fühler des Männchens sind viel größer und dicker als bei der weiblichen Imago. Bei mehreren lebenden Arten sind die Fühler geschlechtsdimorph (Scoble, 1995), die gut entwickelten männlichen Fühler dienen der Chemosensation von weiblichen Pheromonen. (4) Die Maxillarpalpen der Männchen sind doppelt so dick wie die der Weibchen und weisen eine gerippte Struktur auf. (5) Die Augen der Männchen sind ebenfalls größer, aber die Anzahl der Ommatidien ist ungefähr gleich. Größere Augen empfangen nur mehr Licht und könnten empfindlicher sein; die Auflösung wäre jedoch die gleiche.
Die Langstreckenerkennung von rufenden weiblichen Faltern erfolgt über die Chemorezeptoren der Männchen, während die Kurzstreckenerkennung stattdessen auf der visuellen Identifizierung beruht (Groot, 2014). Bei Forcepsites michalskii scheint auch das Weibchen das rufende Geschlecht zu sein, was durch den größeren Antennenapparat und die größeren Augen des Männchens nahegelegt wird.
Habitat
Auf der Grundlage der oben dargestellten Diskussion ist klar, dass in Kopula gefangene Individuen nur an dem Ort vorkommen können, an dem diese Art lebte und sich paarte. Einzelne Individuen können durch den Wind verdriftet werden oder lebensraumfremde Orte aufsuchen, wie z. B. Wasserinsekten, die selten in baltischem Bernstein gefunden werden (Wichardet al., 2009); bei paarenden Individuen hingegen kann dies kaum der Fall sein, ohne getrennt zu werden. In der Literatur scheint es keine Belege für die Paarung von Motten im Flug zu geben. Im Gegensatz dazu „rufen“ die Weibchen bei den meisten Lepidoptera und bei den überwiegend nachtaktiven Mikrolepidoptera (Motten) die Männchen durch Pheromone an und bestimmen so die Paarungsorte (Groot, 2014). Es kann sein, dass sie vor der Paarung fliegen, aber in den meisten Fällen scheinen sie sessil zu sein und fächeln, um Pheromone zu verteilen. Bei einigen Taxa können die rufenden oder suchenden Geschlechter jedoch auch umgekehrt sein, aber bei den Tineidae wird berichtet, dass das Weibchen das rufende Geschlecht ist (Wagner und Rosovsky, 1991; Scoble, 1995). In jedem Fall war der Ort des Harzflusses, d.h. das Biotop mit den bernsteinproduzierenden Bäumen, höchstwahrscheinlich auch der Lebensraum der hier beschriebenen Kleidermotte.
ZUSAMMENFASSUNG
Eine tineoide Motte mit einem bemerkenswerten männlichen Genitalapparat wird als neue Art und Gattung Forcepsites michalskii aus eozänem baltischem Bernstein beschrieben. Weibchen und Männchen sind eng beieinander und mit dem Hinterleib zueinander ausgerichtet erhalten, was darauf hindeutet, dass diese Falter während der Paarung im frischen Harz gefangen waren. Ein starker, laminarer Harzstrom, auf den mehrere abgetriebene Körperteile des Weibchens hindeuten, könnte die beiden auf die jetzt beobachtete kurze Distanz auseinandergezogen haben. Dieses Exemplar könnte daher das erste Beispiel für einen fossilen Lepidoptera darstellen, der in Kopula gefangen wurde.
Es wird angenommen, dass Forcepsites michalskii eine waldbewohnende Art war, da in Kopula gefangene Individuen nur von dem Ort dokumentiert werden können, an dem diese Art lebte und sich paarte.
Weibchen und Männchen von F. michalskii zeigen sexuelle Dimorphismen in der Körpergröße, der Flügellänge, den Proportionen des Abdomens, der Größe der Facettenaugen und der Morphologie der Maxillarpalpen sowie der Fühler. Aufgrund der deutlich größeren und dickeren Fühler des Männchens sowie der größeren Augen wird vermutet, dass das Weibchen bei dieser Art das rufende Geschlecht sein könnte, wie es auch bei anderen Tineidae-Arten der Fall ist.
ANMERKUNGEN
A. Michalski (Wroclaw, Polen) danken wir für die Bereitstellung dieses außergewöhnlichen Exemplars und dafür, dass er uns darauf aufmerksam gemacht hat. M. Schwarz vom Oberösterreichischen Landesmuseum (Linz, Österreich) unterstützte uns freundlicherweise bei der Durchsicht der Lepidoptera-Sammlung. MKH wurde freundlicherweise durch ein Stipendium der Studienstiftung des deutschen Volkes gefördert und dankt S. Harzsch (Greifswald, Deutschland) für seine Unterstützung. Wir bedanken uns für die wertvollen wissenschaftlichen Kommentare von M. Heikkilä und C. Haug (München, Deutschland) zum Manuskript sowie für die Kommentare von J. Krieger (Greifswald, Deutschland) und die Unterstützung durch C. MacGraphery (Freising, Deutschland) und Y. Goldman (Collinsville, CT, USA) bei der Überprüfung des englischen Textes als Muttersprachler. Außerdem danken wir zwei anonymen Gutachtern für ihre hilfreichen Kommentare.
Arillo, A. 2007. Paläoethologie: versteinerte Verhaltensweisen in Bernstein. Geologica Acta, 5(2):159-166. https://doi.org/10.1344/105.000000301
Börner, C. 1925. Lepidoptera, Schmetterlinge, S. 358-387. In Brohmer, P. (Hrsg.). Fauna von Deutschland. Ein Bestimmungsbuch unserer heimischen Tierwelt. Quelle und Meyer, Leipzig.
Borkent, A. 1995. Stechmücken im kreidezeitlichen Bernstein Nordamerikas (Diptera: Ceratopogonidae). Backhuys Publishers, Leiden, The Netherlands.
Boucot, A.J. and Poinar Jr, G.O. 2010. Fossil Behavior Compendium. CRC Press, Boca Raton, S. 147-151.
Coty, D., Aria, C., Garrouste, R., Wils, P., Legendre, F. and Nel, A. 2014. The first ant-termite syninclusion in amber with CT-scan analysis of taphonomy. PLOS one, 9(8):e104410. https://doi.org/10.1371/journal.pone.0104410
Deering, M.D. und Scriber, J.M. 2002. Feld-Bioassays zeigen eine heterospezifische Asymmetrie der Paarungspräferenz zwischen hybridisierenden nordamerikanischen Papilio-Schmetterlingsarten (Lepidoptera: Papilionidae). Journal of Ethology 20:25-33. https://doi.org/10.1007/s10164-002-0050-2
Fletcher, T.B. 1940. New generic names for microlepidoptera. Entomologist’s Record, 52:17-19.
Ganyard, M.C. und Brady, Jr.U.E. 1972. Interspecific attraction in Lepidoptera in the field. Annals of the Entomological Society of America, 65 (6): 1279-1282. https://doi.org/10.1093/aesa/65.6.1279
Gröhn, C. 2016. Einschlüsse im Baltischen Bernstein. Wachholtz Verlag – Murmann Publishers, Kiel, Hamburg.
Groot, A.T. 2014. Circadian rhythms of sexual activities in moths: A review. Frontiers in Ecology and Evolution 2:43. https://doi.org/10.3389/fevo.2014.00043
Hoffeins, C. and Hoffeins, H.W. 2003. Untersuchungen über die Häufigkeit von Inklusen in Baltischem und Bitterfelder Bernstein (Tertiär, Eozän) aus unselektierten Aufsammlungen unter besonderer Berücksichtigung der Ordnung Diptera. Studia Dipterologica, 10(2):381-392.
Kozlov, M.V. 1987. New moth-like Lepidoptera from the Baltic amber. Paleontological Journal, 4:59-67.
Kozlov, M.V. 1988. Paleontology of lepidopterans and problems of the phylogeny of the order Papilionida, p. 16-69. In Ponomarenko A.G. (ed.), The Mesozoic-Cenozoic Crisis in the Evolution of Insects. Academy of Sciences, Moscow.
Krzeminska, E., Krzeminski, W., Haenni, J.-P., and Dufour, C. 1991. Les Fantomes De L’Ambre (Die Geister des Bernsteins). Muséed’histoire naturelle de Neuchâtel, Neuchâtel, Schweiz.
Kusnezov, N. 1941. A Revision of Amber Lepidoptera. Paleontological Institute, USSR Academy of Sciences, Moscow & Leningrad.
Latreille, P.A. 1810. Considérations générales sur l’ordre naturel des animaux composant les classes des crustacés, des arachnides, et des insectes: avec un tableau méthodique de leurs genres, disposés en familles. Paris, Schoell.
Menken, S.B.J., Boomsma, J.J. and van Nieukerken, E.J. 2009. Large-scale evolutionary patterns of host plant associations in the Lepidoptera. Evolution, 64(4):1098-1119. https://doi.org/10.1111/j.1558-5646.2009.00889.x
Rebel, H. 1934. Bernstein-Lepidopteren (aus der Sammlung Bachofen-Echt). Palaeobiologica, 6:1-16.
Rebel, H. 1935. Bernstein-Lepidopteren. Entomologische Zeitschrift Iris, 49:162-186.
Regier, J.C., Mitter, C., Davis, D.R., Harrison, T.L., Sohn J.-C., Cummings, M.P., Zwick, A., and Mitter, K.T. 2014. Eine molekulare Phylogenie und überarbeitete Klassifikation für die ältesten Ditrysia-Mottenlinien (Lepidoptera: Tineoidea), mit Implikationen für die angestammten Ernährungsgewohnheiten der mega-diversen Ditrysia. Systematic Entomology, 40(2). https://doi.org/10.1111/syen.12110
Scoble, M.J. 1995. The Lepidoptera – Form, Funktion und Vielfalt. The Natural History Museum / Oxford University Press, Oxford.
Skalski, A.W. 1973. Studien über die Lepidoptera aus fossilen Harzen. Part II. Epiborkhausenites obscurotrimaculatus gen. et sp. nov. (Oecophoridae) und eine in baltischem Bernstein entdeckte Tineid-Motte. Acta Palaeontologica Polonica, 18(1):153-160.
Skalski, A.W. 1974. Zwei neue Gattungen und Arten der Familie Tineidae aus dem Baltischen Bernstein. Studien an Lepidopteren aus fossilen Harzen V. Beiträge zur Entomologie, 1/4(24):97-104.
Skalski, A.W. 1977. Studien zu den Lepidopteren aus fossilen Harzen. Teil I. Allgemeine Bemerkungen und Beschreibungen von neuen Gattungen und Arten der Familien Tineidae und Oecophoridae aus baltischem Bernstein. Prace Museum Ziemi, 26:3-24.
Sohn, J.-C., Labandeira, C., Davis, D., and Mitter, C. 2012. Ein kommentierter Katalog der fossilen und subfossilen Lepidoptera (Insecta: Holometabola) der Welt. Zootaxa, 3286:1-132.
Sohn, J.-C. and Lamas, G. 2013. Korrekturen, Ergänzungen und nomenklatorische Anmerkungen zum kürzlich veröffentlichten Weltkatalog der fossilen und subfossilen Lepidoptera. Zootaxa, 3599:395-399.
Sontag, E. 2003. Tierische Einschlüsse in einer Probe von unselektiertem baltischem Bernstein. Acta Zoologica Cracoviensia, 46 (suppl.-Fossil Insects):431-440.
van Nieukerken, E.J., Kaila, L., Kitching, I.J., Kristensen, N.P., Lees, D.C., Minet, J., Mitter, C., Mutanen, M., Regier, J.C., Simonsen, T.J., Wahlberg, N., Yen, S.-H., Zahiri, R., Adamski, D., Baixeras, J., Bartsch, D., Bengtsson, B.Å., Brown, J.W., Bucheli, S.R., Davis, D.R., De Prins, J., De Prins, W., Epstein, M.E., Gentili-Poole, P., Gielis, C., Hätteschwiler, P., Hausmann, A., Holloway, J.D., Kallies, A., Karsholt, O., Kawahara, A.Y., Koster, S.J.C., Kozlov, M.V., Lafontaine, J.D., Lamas, G., Landry, J.-F., Lee, S., Nuss, M., Park, K.-T., Penz, C., Rota, J., Schintlmeister, A., Schmidt, B.C., Sohn, J.-C, Solis, M.A., Tarmann, G.M., Warren, A.D., Weller, S., Yakovlev, R.V., Zolotuhin, V.V., und Zwick, A. 2011. Ordnung Lepidoptera Linnaeus, 1758. In Zhang, Z.-Q. (ed.), Animal biodiversity: An outline of higher-level classification and survey of taxonomic richness. Zootaxa, 3148:212-221.
von Linné, C. 1758. übersetzt von William Turton (1806). Volume 1. A General System of Nature: Durch die drei großen Königreiche der Tiere, Pflanzen und Mineralien, systematisch gegliedert in ihre verschiedenen Klassen, Ordnungen, Gattungen, Arten und Varietäten. Lackington, Allen, and Co, London.
Wagner, D.L. und Rosovsky, J. 1991. Paarungssysteme bei primitiven Lepidoptera, mit Schwerpunkt auf dem Fortpflanzungsverhalten von Korscheltellus gracilis (Hepialidae). Zoological Journal of the Linnean Society, 102:277-303. https://doi.org/10.1111/j.1096-3642.1991.tb00003.x
Weitschat, W. und Wichard, W. 2002. Atlas der Pflanzen und Tiere im baltischen Bernstein. Verlag Friedrich Pfeil, München.
Weitschat, W. 2009. Jäger, Gejagte, Parasiten und blinde Passagiere – Momentaufnahmen aus dem Bernsteinwald. Denisia, 26(86):243-256.
Wichard, W., Gröhn, C., and Seredszus, F. 2009. Aquatische Insekten im Baltischen Bernstein. Verlag Kessel, Remagen-Oberwinter.