A hasadás a korai mitotikus osztódások sztereotip mintázatára utal, amely a nagy mennyiségű petesejt citoplazmáját osztja fel. A korai zigóta egyedülállóan nagy méretű. A legtöbb sejt a mitózisciklusok között növekedési időszakon megy keresztül, de ez nem igaz a korai hasadási stádiumú blasztomerekre. Minden egyes osztódással a sejtek kisebbek lesznek. A sejtosztódásnak ez a gyors, egyidejű növekedés nélküli mintázata hirtelen megáll a középső blasztóma átmenetnek nevezett szakaszban, ahol a zigóta magja átveszi a sejtciklus irányítását.
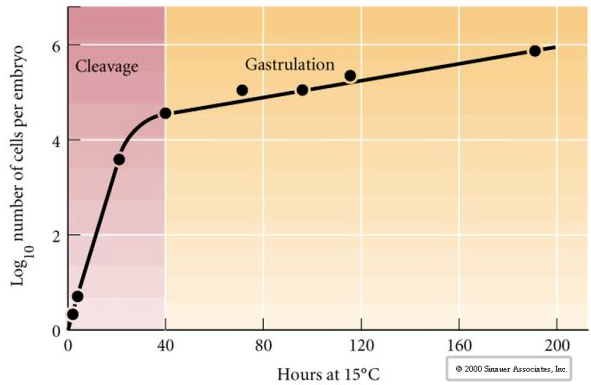 Van némi bizonyíték arra, hogy egy anyai faktor, talán egy transzkripciós szabályozó felelős a hasadási osztódások e korai gyors mintázatáért. A citoplazma és a nukleáris DNS arányának mesterséges megváltoztatásával megváltoztatható a középblasztuláris átmenet időpontja. A midblastula átmenet azt az időpontot jelöli, amikor az anyai gének kifejeződéséről a zigóta génekre történő fő átállás történik.
Van némi bizonyíték arra, hogy egy anyai faktor, talán egy transzkripciós szabályozó felelős a hasadási osztódások e korai gyors mintázatáért. A citoplazma és a nukleáris DNS arányának mesterséges megváltoztatásával megváltoztatható a középblasztuláris átmenet időpontja. A midblastula átmenet azt az időpontot jelöli, amikor az anyai gének kifejeződéséről a zigóta génekre történő fő átállás történik.
A megtermékenyítés egyes fajoknál radikális citoplazmatikus mozgásokhoz vezet, amelyek elengedhetetlenek ahhoz, hogy a citoplazmatikus determinánsok a későbbi hasadási eseményekhez képest a megfelelő pozícióban helyezkedjenek el.
Az EMBRYONIKUS CSILLAGOZÁS PATTERNUSAI
Az embrionális hasadás mintázatát mind a mitotikus orsók helyzete, mind a sárgatest mennyisége és eloszlása meghatározza. A sárgája inkább gátolja a hasadást. Lelassítja, vagy éppenséggel megakadályozza a teljes hasadást. A sárgatest azon állatok alkalmazkodása, amelyek az embriogenezis többé-kevésbé tápláléktól elszigetelten zajlik le. Néhány állatnak, mint például a tengeri sünnek, viszonylag kevés sárgája van, mert gyorsan fejlődik szabadon úszó lárvaformává, amely a környezetéből szerzi be a tápanyagokat. Más állatok, például az erszényesek koraszülöttként születnek, de a szülői erszényben kapnak táplálékot. A méhlepényes emlősök egy speciális szervet fejlesztenek ki, amelyen keresztül az embrió a fejlődés során táplálkozik, és így szintén kevés sárgája van.
A tojások típusait a sárgája jellemzői alapján a következőképpen írják le:
Izolecitális: gyér, egyenletesen eloszló sárgája, pl. tengeri sün, egér
Mesolectális: mérsékelt mennyiségű sárgája van, gyakran egyenetlenül eloszlik, pl., béka
Telolecitális: sűrű, az egyik végére koncentrált sárgája, pl. madár, hüllő
Centrolitális: a tojás közepére koncentrált sárgája, pl. légy
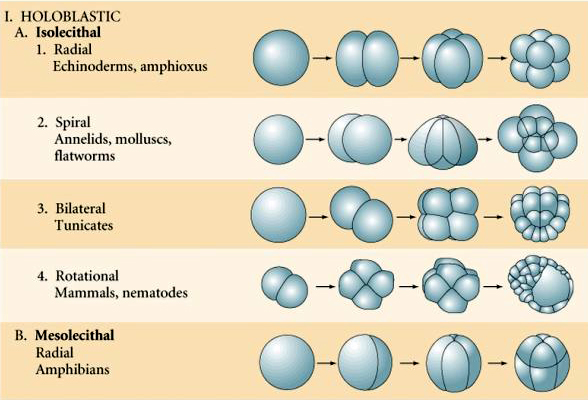
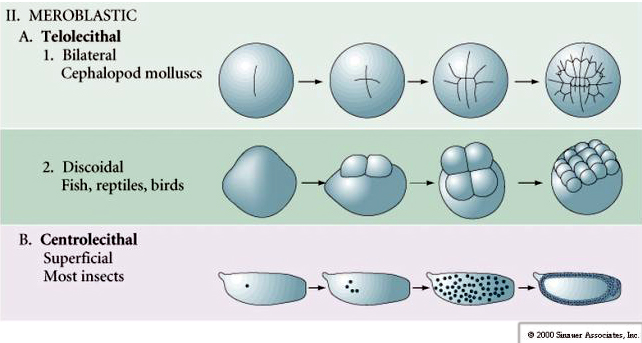
Néhány tojás polarizált, egy sárgájában gazdag pólus, az úgynevezett növényi pólus és egy sárgájában szegény pólus, az úgynevezett állati pólus, pl. béka. A zigóta mag általában az állati pólus felé tolódik. A viszonylag kevés sárgáját tartalmazó zigóták (izolecitális és mezolecitális) HOLOBLASZTIKUSAN hasadnak. A hasadási barázda végigvonul a petesejtben. Míg a telolecitális és centrolecitális zigóták MEROBLASZTIKUS hasadáson mennek keresztül, ahol a hasítási sík csak a felhalmozott sárgájáig terjed. A centrolecithális petékben (sok rovar petéje) a hasadás meroblasztikus és felületes, míg a telolecithális petékben (madarak és halak) a hasadás diszkoidális
A természetben többféle hasadási szimmetria figyelhető meg: radiális (tüskésbőrűek, kétéltűek), spirális (puhatestűek, gyűrűsállatok), bilaterális (aszcidiák,zsákállatok), rotációs (emlősök). Az alábbi két ábra a holoblasztikus és a meroblasztikus hasadási szimmetriára mutat példákat.
RADIÁLIS HOLOBLASZTIKUS CSAKADÁS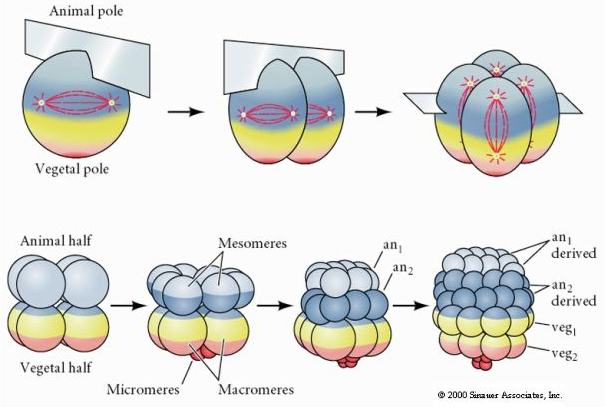
Kiváló film a tengeri sün hasadásáról Rachel Fink “Egy tucat tojás” című filmjéből.
A tengeri sünöknek is van radiális holoblasztikus hasadása, de néhány érdekes különbséggel. Az első hasadás meridionális.A második hasadás meridionális. A harmadik hasadás egyenlítői A negyedik hasadás meridiális, de míg a négy állati pólus sejtjei egyenlően osztódnak, hogy nyolc egyforma méretű állati blasztomer, úgynevezett MESOMERES keletkezzen, addig a vegetális sejtek aszimmetrikusan osztódnak az egyenlítői sík mentén, hogy 4 nagy MACROMERES és 4 sokkal kisebb MICROMERES keletkezzen a vegetális póluson. Ötödik osztódáskor a MESOMERES egyenlítői irányban osztódik, így két nyolc MESOMERES an1 és an2 csoportot kap, a MACROMERES meridiálisan osztódik, és egy nyolc sejtből álló csoportot alkot az an2 alatt, a MICROMERES osztódik, így a veg1 réteg alatt egy sejtcsoportot kap. A hatodik osztódás mind egyenlítői irányú, ami a veg2 réteget adja. A hetedik osztódás mind meridionális, ami egy 128 sejtes blasztulát eredményez.
Mi határozza meg ezeket a hasadási mintákat? Függenek-e az előző osztódástól, és lejátszódnak-e, mint egy szalag, vagy valamilyen belső óra határozza meg őket? 1939-ben Horstadius az első három hasadásból egyet vagy kettőt gátolt, és azt találta, hogy a mikromerek megjelenése a megfelelő időben történt, függetlenül a hasadások előzményeitől
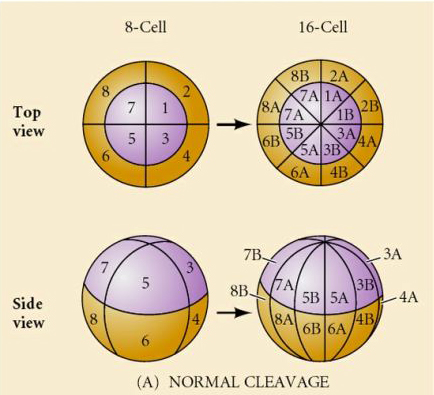
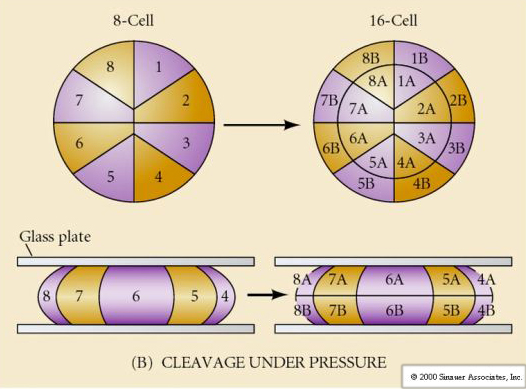
A kísérletekből az a következtetés vonható le, hogy a petesejt vegetális pólusában van valamilyen tényező, amely meghatározza a mikromerek kialakulását, továbbá, hogy kell lennie egy molekuláris órának, amely a petesejt aktiválásakor indul. Az óra független a tényleges hasadási eseménytől.
A 128 sejtes blasztula egy üreges blasztocsőt körülvevő, meglehetősen laza sejtgolyó. A gömb egy sejtréteg vastagságú, és minden sejt érintkezik a külső hialinréteggel és a blastocoel belső folyadékával. A fejlődésnek ebben a szakaszában a sejtek kezdik kialakítani a hámra jellemző szoros kötéseket. A központi blastocoel most már el van szigetelve a külső környezettől. A blasztomerek továbbra is a hialinréteggel párhuzamos tengellyel osztódnak, és egy sejt vastagságú hám marad. A blasztociszta tovább növekszik.
Két elmélet próbálja megmagyarázni a blasztociszta megnagyobbodásának mintázatát
1. Az ozmotikus elmélet szerint a blastomerek ionokat és fehérjéket választanak ki a blastocoelbe, és ez a víz ozmotikus áramlása miatt nyomásnövekedést eredményez. Ez a nyomás lenne azután felelős a blastomerek mitózistengelyének igazításáért és a blastococoel megnagyobbodásáért.
2. A Wolpert és munkatársai által kidolgozott alternatív elmélet szerint valójában a blastomerek közötti, valamint a blastomerek és a hialinréteg közötti tapadó kölcsönhatások igazítják a mitózistengelyeket. Vagyis a hialinhoz való tapadás a legnagyobb, a más blastomerekhez való tapadás a következő, és végül a blastocoel falával való kölcsönhatás a legkisebb. A hialinréteggel való domináns tapadás kényszeríti ki a blasztociszta és a blastocoel kitágulását.
A blasztó sejtjei külső felületükön csillókat növesztenek, keltető enzimet (hialináz) választanak ki, és szabadon úszóvá válnak.
AMPHIBIAI KELEVÁLÁS
A kelés sok kétéltűben holoblasztikus, radiális szimmetriával, azonban a nagy mennyiségű sárgatest (annak mesolecituma) akadályozza a kelést. Az állati póluson az első hasadás kb. 1 mm/perc sebességgel halad, míg a növényi póluson keresztül 50-100-szor lassabban (,02 mm/perc). Míg az első hasadás még nem fejeződött be a petesejt fonalas vegetális régiójában, megkezdődik a második meridiális hasadás.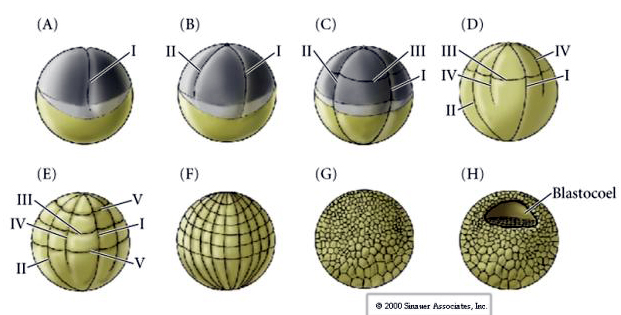
A harmadik hasadás ekvatoriális, de mivel a sejtmagok és az aszterek állati irányba tolódnak el, a hasadási sík, bár merőleges az állati vegetális tengelyre, szintén az állati pólus felé tolódik el, és nem egyenlően osztja fel a blasztomereket. Az eredmény négy kisebb állati blasztomer (úgynevezett MICROMERES) és négy nagy vegetális pólusú blasztomer (úgynevezett MACROMERES). Ez az egyenlőtlen holoblasztikus hasadás egy gyorsabban osztódó, kisebb mikromerekből álló állati pólust és egy lassabban osztódó, makromerekből álló növényi pólust eredményez. Az állati pólus hamarosan sok kis mikromérából, a vegetális pólus pedig néhány sárgájával teli nagy makromérából áll. Bár a blasztocéla kialakulása az első hasadással kezdődik, az csak a 128 sejtes stádiumban válik nyilvánvalóvá.
MELY FUNKCIÓT SZOLGÁL A BASZTOCÉL?
A blasztocéla térben elválasztja a sejteket, hogy azok ne érjenek egymáshoz. A blastocoel tetején lévő sejtek általában ektodermává alakulnak. Ha a blastocoel tetejéről származó sejteket átültetjük a blastocoel alján lévő sárgatestű sejtek mellé, azok mezodermaként differenciálódnak. A mezodermális származékok általában az endodermális prekurzorok melletti sejtekből keletkeznek. Az egyik lehetőség, amelyet alaposan meg fogunk vizsgálni, hogy a vegetális sejtek sejt-sejt kölcsönhatásokon keresztül indukálják a szomszédos sejtek mezodermává válását. Így a blasztociszta korai sejtjei közötti nem megfelelő “induktív” kölcsönhatások megelőzéséhez szükséges lehet a blasztociszta burok kialakulása. A másik nyilvánvaló igény a blastocoelre a fejlődés későbbi szakaszában, a GASTRULÁCIÓ során lehet, amikor a sejtek a blastocoel belsejébe vándorolnak.
EMBERI TISZTA
Az emlősök petesejtje a petefészekből a petevezetékbe kerül, ahol megtermékenyül. Az első hasadás körülbelül egy nappal a megtermékenyítés után kezdődik a petevezetéken belül. A legtöbb állattal éles ellentétben az emlősöknél a hasadás nagyon lassú lehet—1/nap.
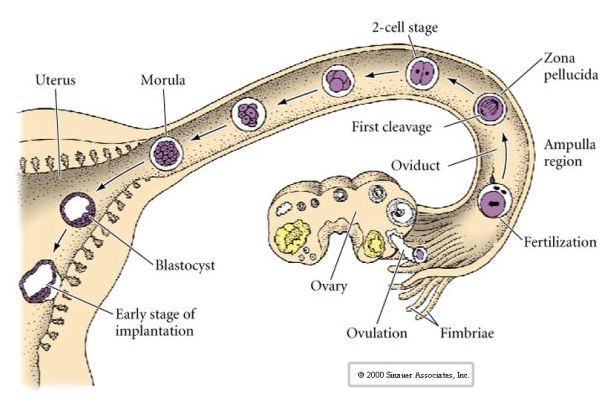
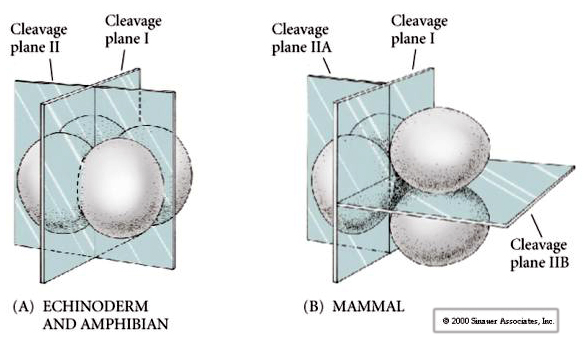 A hasadási síkok ráadásul némileg eltérnek más állatokétól. Az első hasadási sík meridionális, akárcsak a tengeri sünnél és a békánál. A második hasadási osztódás során azonban az egyik blasztomer meridiálisan, a másik pedig egyenlítői irányban osztódik! Ezt a fajta hasadást ROTÁCIÓS HOLOBLASZTIKUS OSZTÁLÁSNAK nevezik.
A hasadási síkok ráadásul némileg eltérnek más állatokétól. Az első hasadási sík meridionális, akárcsak a tengeri sünnél és a békánál. A második hasadási osztódás során azonban az egyik blasztomer meridiálisan, a másik pedig egyenlítői irányban osztódik! Ezt a fajta hasadást ROTÁCIÓS HOLOBLASZTIKUS OSZTÁLÁSNAK nevezik.
Az emlősök hasadásának másik egyedi jellemzője, hogy a blasztomerhasadás aszinkron. (szemben a tengeri sün és a béka szinkronitásával a középső blastula átmenetig). Az emlős embrió hasadását a kezdetektől fogva a ziotikus mag szabályozza.
A harmadik hasadás során a blasztomerek lazán kapcsolódó sejtek gömbjét alkotják, akárcsak a többi általunk vizsgált állatnál. A negyedik hasadás előtt a blasztóma sejtjei drámaian megváltoztatják egymás iránti viselkedésüket. Gyorsan megpróbálják maximalizálni kapcsolataikat a többi blasztomerrel, és ezzel a blasztula tömörödését okozzák.

Ez a tömörödés részben egy újszerű adhéziós molekula, az UVOMORULIN (E-Cadherin) termelésének eredménye, és a külső sejtek közötti szoros kötések kialakulása stabilizálja, amely a tengeri sünhöz hasonlóan elzárja a blasztula belsejét a külvilágtól. A sejtek egymás között réskapcsolatokat is kialakítanak, amelyek lehetővé teszik a kis molekulák, például az ionok és néhány második hírvivő molekula, például a Ca++ és a C-AMP átjutását. A tömörített 16 sejtes morula egy külső sejtkéregből és néhány sejtből (1-2) áll, amelyek teljesen belül vannak. A legtöbb külső sejtből a TROBLASZTIKUS VAGY TROPHECTODERMÁLIS SEJTEK keletkeznek. Ezek a sejtek nem járulnak hozzá a tulajdonképpeni embrióhoz, hanem az embrió méhfalba való beágyazódásához szükségesek, és a CHORIAN szöveteit alkotják, a méhlepény egyik lényeges alkotóelemét, amelyről később még beszélünk.
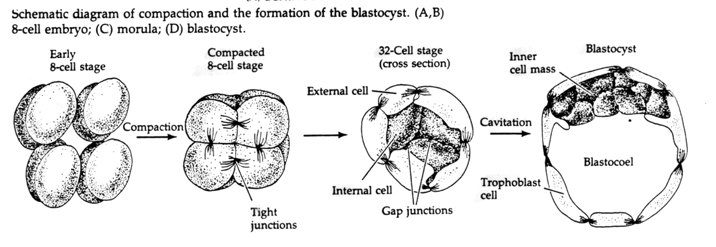
Az embrió sejtjei a 16 sejtes stádiumú blasztula belső néhány sejtjéből származnak. Ezek a sejtek hozzák létre azt a belső sejttömeget, amelyből az egész embrió kifejlődik. A 6. hasadásra, a 64 sejtes stádiumra a belső sejttömeg és a trofoblasztos réteg teljesen elkülönül. A trofoblasztok belsőleg folyadékot választanak ki, hogy létrehozzák a blastocoelt. Az embriót most már blastocisztának nevezzük.
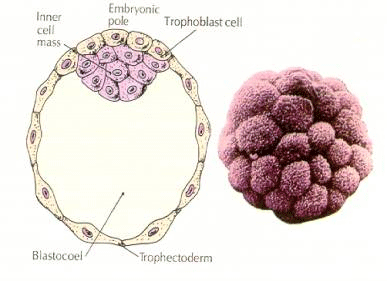 A BELSŐ SEJTTÖMEG KIALAKULÁSA
A BELSŐ SEJTTÖMEG KIALAKULÁSA
Hogyan jönnek létre ezek a belső sejttömegű sejtek? Vannak-e bizonyos blasztomerek, amelyeket belső faktorok arra rendeltek, hogy belső sejttömegű progenitorokká váljanak? A válasz nemnek tűnik. Úgy tűnik, hogy minden korai blasztomer totipotens, és annak meghatározása, hogy mely sejtek járulnak hozzá a trofoblasztos réteghez és melyek a belső sejttömeghez, egyszerűen a véletlen helyzet kérdése. Egy 4 sejtes stádiumú embrióból származó sejtek, amelyekből normális esetben mind a belső sejttömeg, mind a trophektoderma sejtjei keletkeznek, egy 32 sejtes stádiumú embrió külsejére átültetve csak trophektoderma keletkezik. Ezek nem járulnak hozzá a tulajdonképpeni embrióhoz. Emlékezzünk vissza a klónozásról szóló korábbi előadásból, hogy két 8 sejtes stádiumú egérembrió fúziója normális embriót eredményez, ami arra utal, hogy ebben a stádiumban minden sejt totipotens.
MEROBLASZTIKUS CSÖKKENÉS
A telolecitális és centrolecitális tojásokban a nagy, sűrű sárgája megakadályozza a hasadást. A telolecitális tojások a madarakra, halakra és hüllőkre, míg a centrolecitális tojások a rovarokra jellemzőek. A telolecitális tojások meroblasztikus diszkoid hasadást eredményeznek. A hasadás a tojás állati pólusán lévő blastodiscusra korlátozódik. A korai hasadásoknál, mivel a hasadás nem tud a sárgáján keresztül haladni, a blasztomerek a vegetális peremükön folytonosak.
A zebrahal fejlődéséről készült film, amelyetRolf Karlstrom készített, kiváló. (Paul Myers filmje)
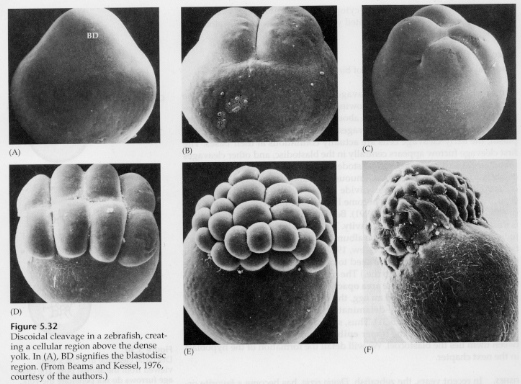 Csak az egyenlítői hasadásoknál válnak el a blasztoderma sejtjei a sárgájától. A további ekvatoriális hasadások többrétegű, három-négy sejt vastagságú blastodermát hoznak létre.
Csak az egyenlítői hasadásoknál válnak el a blasztoderma sejtjei a sárgájától. A további ekvatoriális hasadások többrétegű, három-négy sejt vastagságú blastodermát hoznak létre.
A madaraknál a blastodermák és a sárgája között egy tér alakul ki, amelyet SUBGERMINÁLIS ÜREGNEK nevezünk. A 16 osztódással (60 000 sejt) a blastoderma sejtjei a subgerminalis üregbe vándorolnak, és ott egy második réteget képeznek. A két réteget külső EPIBLAST-nak és belső HYPOBLAST-nak nevezik, a köztük lévő blastocoellel. Ezt a későbbiekben részletesebben tanulmányozzuk, amikor a madarak és emlősök gasztrulációját tárgyaljuk
Az ízeltlábúak petéi SZUPERFIKCIÓS TÖRÖLÉSEN mennek keresztül. A nagy központi sárgatesttömeg a hasadást a tojás citoplazmás peremére korlátozza.
Egy érdekes és tanulságos változatot láthatunk a rovaroknál. A zigóta sejtmagok hasadás nélkül osztódnak. Vagyis a sejtmagok karyokinézis—-mitotikus osztódáson mennek keresztül— citokinézis–a sejt osztódása nélkül. Ezeket a csupasz sejtmagokat ENERGIDOKNAK nevezzük. A sejtmagok elképesztő sebességgel osztódnak — 8 percenként (az egész embriogenezis mindössze 22 órát vesz igénybe).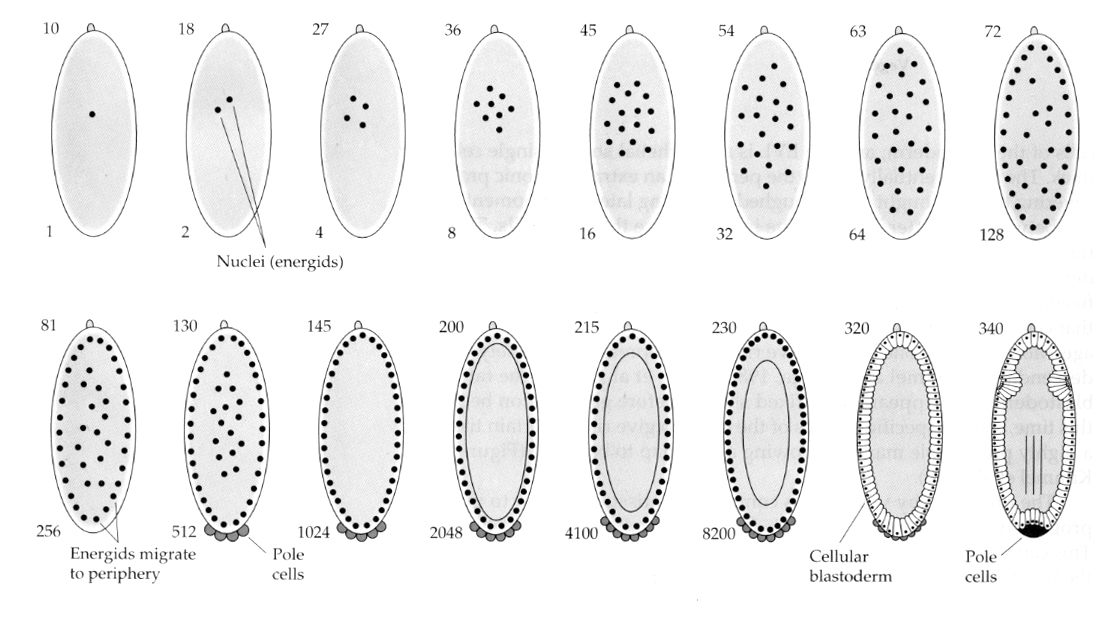
 A karyokinézis több fordulója után a csupasz sejtmagok a petesejt perifériájára vándorolnak. Ezt a stádiumot nevezzük SZINCIONÁLIS BLASTODERMÁNAK, mert az összes sejtmag osztozik ugyanazon a citoplazmán. A sejtosztódás körülbelül a 14. magosztódáskor következik be, és létrejön a CELLULÁRIS BLASTODERM. Ezt követően a sejtek aszinkron módon osztódnak. Ez megfelel a békák és a tengeri sünök középblastuláris átmenetének. (átmenet az anyai génkifejeződésről az elsődlegesen zigóta génkifejeződésre) Emlékezzünk arra, hogy a midblastula átmenetet feltételezhetően a kromatin és a citoplazma aránya váltja ki. Ennek a mechanizmusnak a bizonyítása a legyeknél mutáns haploid embriók vizsgálatával látható. Ezek az embriók egy osztódással később mennek keresztül a midblastula átmeneten és a cellularizáción 15.. Továbbá felgyorsíthatjuk a cellularizációt a petesejt lekötésével és a citoplazma mennyiségének csökkentésével. Bár a szinciális blasztoderma stádium azt sugallja, hogy minden sejtmag ekvipotens, mivel úgy tűnik, hogy nincsenek diffúziós akadályok a citoplazmatikus determinánsok számára, valójában a citoplazma nagyon regionalizált, és a sejtmagok körül erősen szervezett citoplazmatikus domének vannak.
A karyokinézis több fordulója után a csupasz sejtmagok a petesejt perifériájára vándorolnak. Ezt a stádiumot nevezzük SZINCIONÁLIS BLASTODERMÁNAK, mert az összes sejtmag osztozik ugyanazon a citoplazmán. A sejtosztódás körülbelül a 14. magosztódáskor következik be, és létrejön a CELLULÁRIS BLASTODERM. Ezt követően a sejtek aszinkron módon osztódnak. Ez megfelel a békák és a tengeri sünök középblastuláris átmenetének. (átmenet az anyai génkifejeződésről az elsődlegesen zigóta génkifejeződésre) Emlékezzünk arra, hogy a midblastula átmenetet feltételezhetően a kromatin és a citoplazma aránya váltja ki. Ennek a mechanizmusnak a bizonyítása a legyeknél mutáns haploid embriók vizsgálatával látható. Ezek az embriók egy osztódással később mennek keresztül a midblastula átmeneten és a cellularizáción 15.. Továbbá felgyorsíthatjuk a cellularizációt a petesejt lekötésével és a citoplazma mennyiségének csökkentésével. Bár a szinciális blasztoderma stádium azt sugallja, hogy minden sejtmag ekvipotens, mivel úgy tűnik, hogy nincsenek diffúziós akadályok a citoplazmatikus determinánsok számára, valójában a citoplazma nagyon regionalizált, és a sejtmagok körül erősen szervezett citoplazmatikus domének vannak.
A KLEAVÁCIÓ MECHANIZMUSAI
S sejtciklus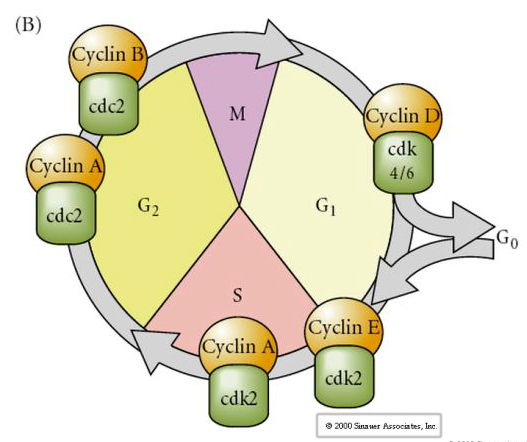
M-mitózis
G1- pre-replikációs rés
S- DNS-szintézis
G2-premitotikus rés
A hasadási stádiumban lévő embriókban, például a békákban és a legyekben a blasztomerek közvetlenül az M-ről az S-re lépnek, G1 vagy G2 szakaszok közbeiktatása nélkül. A középblasztóma átmenet után a sejtek mindkét állatban G1 és G2. Elegáns transzplantációs kísérletek kimutatták, hogy a citoplazma szabályozza mind a karyokinézist, mind a citokinézist. Ha osztódó sejtekből származó sejtmagokat ültetünk át petesejtbe, azok azonnal abbahagyják az osztódást.
 Megfordítva, ha nem osztódó sejtekből származó sejtmagokat ültetünk megtermékenyített enukleált petesejtbe, azok osztódni kezdenek. A centriolák nélküli, mesterségesen aktivált enukleált petesejtekben a hasadásra emlékeztető kérgi összehúzódások mennek végbe. A korai embrióban a sejtosztódást szabályozó citoplazmatikus faktorok közül azonosítottak néhányat.
Megfordítva, ha nem osztódó sejtekből származó sejtmagokat ültetünk megtermékenyített enukleált petesejtbe, azok osztódni kezdenek. A centriolák nélküli, mesterségesen aktivált enukleált petesejtekben a hasadásra emlékeztető kérgi összehúzódások mennek végbe. A korai embrióban a sejtosztódást szabályozó citoplazmatikus faktorok közül azonosítottak néhányat.
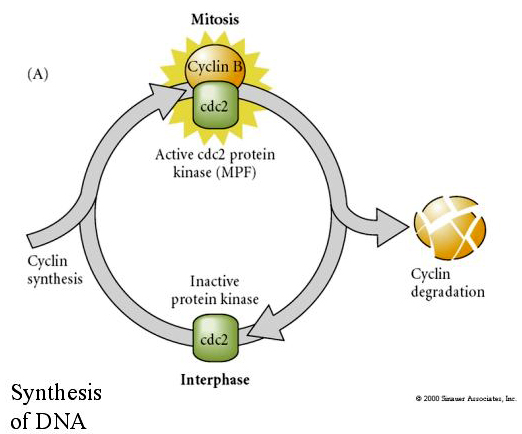
A citosztatikus faktor (CSF) az első meiotikus osztódás után emelkedik, és a második meiotikus metafázisban megállítja a petesejtet. Megtermékenyítéskor a Ca inaktiválja a CSF-et, a meiózis befejeződik és a pronukleuszok összeolvadnak.
MITOSIS PROMOTING FACTOR (MPF) hatására a sejtek belépnek az M fázisba. Az MPF aktiválása okozza: 1. kromoszóma kondenzáció a H1 hisztonok foszforilációjával, 2. magburkolat lebontása a 3 nukleáris lamin hiperfoszforilációjával, 3. RNS polimeráz gátlása a transzkripció leállításához, 4. Myosin szabályozó alegység foszforilációja a citokinézis inhibt.
A sejtciklus ciklikus szabályozásának javasolt modellje az embrogenezis hasadási szakaszaiban. Az MPF indukálja a sejtet, hogy S-ből M-be haladjon. A CSF kötődik az MPF-hez és megakadályozza az inaktiválását. A sejt M-ben marad. A Ca növekszik és a CSF inaktiválódását okozza, ami viszont az MPF inaktiválódásához vezet, és a sejt M-ből S-be jut, és a ciklus megismétlődik. Az MPF két alegységből, a ciklin B-ből és a cdc2-ből áll. A ciklin B az, amely a sejtmag által szabályozott sejtciklus-specifikus szintézisen és degradáción megy keresztül, hogy szabályozza a sejtciklust a normál szomatikus sejtekben. Az oogenezis során azonban a petesejt tele van a ciklin B és a ciklin B mRNS “szabályozóival”, így annak szintézisét a zigóta sejtmagtól független anyai faktorok szabályozzák. Így csak akkor “fogynak el” az anyai komponensek, amikor a zigóta mag átveszi az irányítást, és visszatér a normális sejtciklus (M, G1, S, G2). 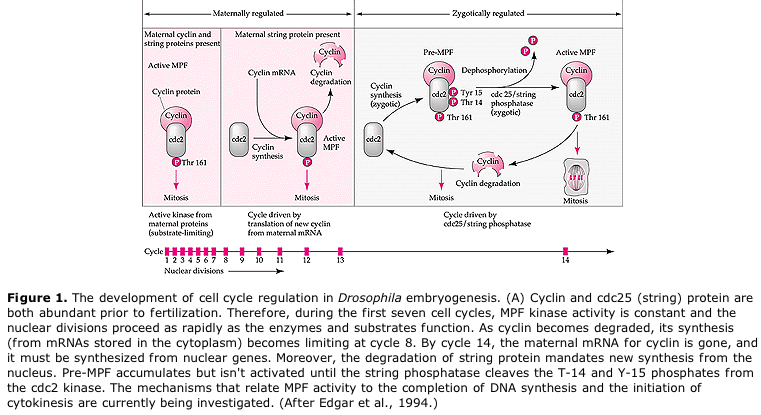
CELLASOROZAT DETERMINÁCIÓ
DETERMINÁCIÓK citoplazmatikus lokalizációja mint a korai mintázódás általános és alapvető mechanizmusa (példák: Tunicate és Sea Urchin). A fejlődésbiológia egyik fő kérdése, hogy mikor és hogyan határozódnak meg a sejtsorsok a fejlődés során. Ez szorosan összefügg azzal a kérdéssel, hogy a fejlődés során hogyan történik a mintaképződés. Az embriónak nemcsak a megfelelő számú és típusú differenciált sejteket kell létrehoznia, hanem ezeknek az embrió összes többi sejtjéhez képest a megfelelő módon kell szerveződniük ahhoz, hogy egy működőképes állatot alkossanak. A sejtsorsmeghatározás és a mintaképződés két lehetőségét fogjuk megvizsgálni: 1. A sejtsorsot az oogenezis során a petesejtbe kerülő intrinzik faktorok határozhatják meg, majd a hasadás során a specifikus blasztomerekhez kerülnek, 2. Az embrió környezete által adott extrinzik jelek szolgáltathatják a sejtsors szabályozásához szükséges mintázati információt. Mint látni fogjuk, a legtöbb összetett organizmus az intrinzikus és extrinzikus jelek kombinációját használja a sejtsors és az embrionális mintaképződés szabályozására.
A citoplazmatikus determinánsok által meghatározott autonóm sejtsors azt sugallja, hogy egy sejt sorsa teljes mértékben a származásától függ, míg a “regulatív” fejlődés azt sugallja, hogy egy sejt sorsát más sejtekből származó külső jelek határozzák meg. A sejtspecifikáció e két mechanizmusa kísérletileg elkülöníthető izolációs, ablációs és transzplantációs kísérletekkel. Ha egy embrióból izolált hólyagsejt normálisan differenciálódik (mintha még mindig a normális helyén lenne az embrióban), akkor azt mondhatjuk, hogy olyan belső determinánsokkal kell rendelkeznie, amelyek meghatározzák a sorsát. Ha azonban rendellenesen differenciálódik, akkor azt mondhatjuk, hogy a sejtsorsa külső jelektől függ. Ha egy embrióból eltávolítunk egy blasztomert, és az embrió rendellenesen fejlődik, és hiányzik az összes olyan sejtsors, amely normális esetben az eltávolított blasztomerből ered, akkor azt mondjuk, hogy a fejlődés sejtautonóm és belsőleg meghatározott. Ha azonban az embrió normálisan fejlődik, azt mondjuk, hogy a megmaradó blasztomerek képesek szabályozni sejtsorsukat, hogy kompenzálják a hiányzó sejteket. Ha egy átültetett sejt megtartja az eredeti helyzete alapján a sejtsorsát, akkor azt mondjuk, hogy a sorsa determinált, ha pedig az újonnan átültetett helyzete alapján új sorsot vesz fel, akkor azt mondjuk, hogy a sorsát a közeli sejtekből érkező külső jelek szabályozzák.
CYTOPLASMÁS LOKALIZÁLÁS ÉS SZABÁLYOZÁS A TUNIKÁTUMI EGERBEN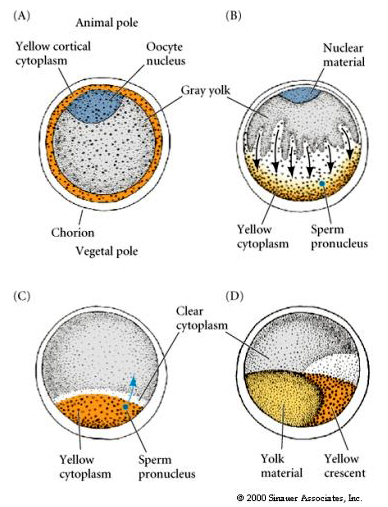
Az oogenezis végén a tunikátatojásnak egyértelműen megkülönböztetett állati és növényi pólusa van. Sárga kérgi citoplazma van, amely egy szürke, sárgás belső citoplazmát vesz körül. A petesejtmag az állati pólus felé tolódik. A vegetális féltekébe behatoló spermium megtermékenyíti a petesejtet és elindítja a fejlődést. A megtermékenyítés után a petesejt citoplazmájának drámai átrendeződése következik be, ami regionálisan színezett citoplazmákat eredményez, amelyek úgy tűnik, hogy korrelálnak a későbbi blasztomer-sorsokkal.
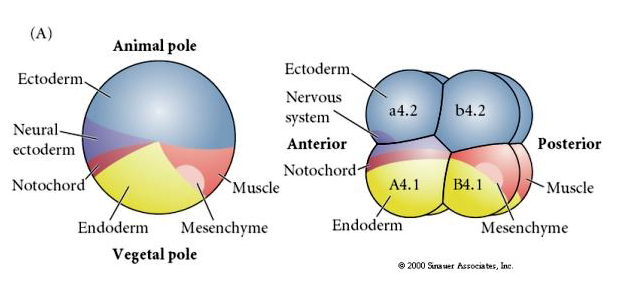 Figyeljük meg, hogy a sors-térkép korrelál a tunikális embrió különböző színű citoplazmáival. Ne tévesszenek össze a két ábrán látható eltérő színek. A “narancssárga” sárga sarlós citoplazma az izomsorsokkal, a yolky (sárga) citoplazma pedig az endodermális sorsokkal korrelál. A sárga félhold feletti szürke (fehér vagy kékeslila) citoplazma a neurális ektodermával korrelál.
Figyeljük meg, hogy a sors-térkép korrelál a tunikális embrió különböző színű citoplazmáival. Ne tévesszenek össze a két ábrán látható eltérő színek. A “narancssárga” sárga sarlós citoplazma az izomsorsokkal, a yolky (sárga) citoplazma pedig az endodermális sorsokkal korrelál. A sárga félhold feletti szürke (fehér vagy kékeslila) citoplazma a neurális ektodermával korrelál.
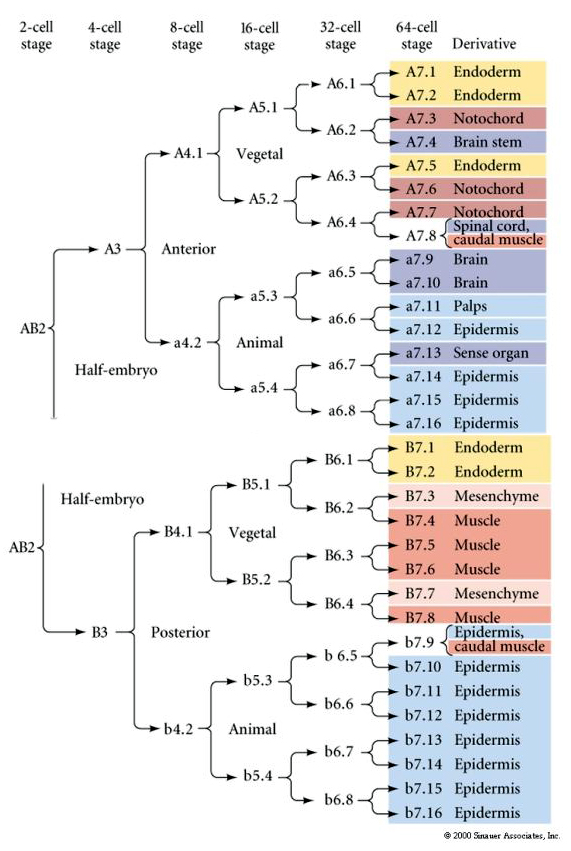 Ez a vonalas térkép az invariáns vonalas korrelációt mutatja a blasztomerek által felparcellázott egyes színes citoplazmákkal az invariáns sejthasadások által. Az invariáns hasadások és vonalvezetések azonban nem feltétlenül bizonyítják az autonóm sejtspecifikációt a citoplazmatikus determinánsok által.
Ez a vonalas térkép az invariáns vonalas korrelációt mutatja a blasztomerek által felparcellázott egyes színes citoplazmákkal az invariáns sejthasadások által. Az invariáns hasadások és vonalvezetések azonban nem feltétlenül bizonyítják az autonóm sejtspecifikációt a citoplazmatikus determinánsok által.
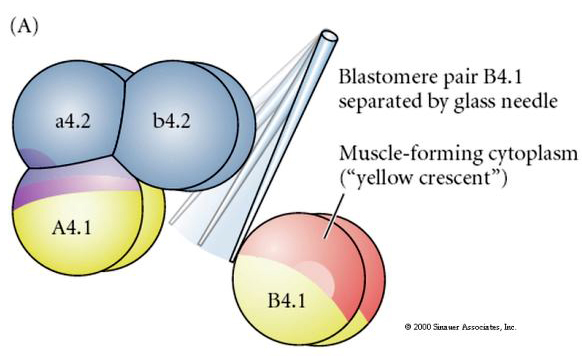 Kísérleti manipulációk szükségesek a sejtsors regulatív versus sejtautonóm meghatározásának teszteléséhez. A következő három ábrán bemutatott klasszikus izolációs kísérletek azt próbálják bizonyítani, hogy a sejtsorsot citoplazmatikus determinánsok határozzák meg, amelyeket sztereotip hasításokon keresztül szereznek meg. Üvegtűt használunk a B4.1 blasztomerpár elkülönítésére az embrió többi részétől. A B4.1-es blastomerek általában az izomszöveti sejtsorssal korreláló sárga krecens citoplazmát kapnak.
Kísérleti manipulációk szükségesek a sejtsors regulatív versus sejtautonóm meghatározásának teszteléséhez. A következő három ábrán bemutatott klasszikus izolációs kísérletek azt próbálják bizonyítani, hogy a sejtsorsot citoplazmatikus determinánsok határozzák meg, amelyeket sztereotip hasításokon keresztül szereznek meg. Üvegtűt használunk a B4.1 blasztomerpár elkülönítésére az embrió többi részétől. A B4.1-es blastomerek általában az izomszöveti sejtsorssal korreláló sárga krecens citoplazmát kapnak.
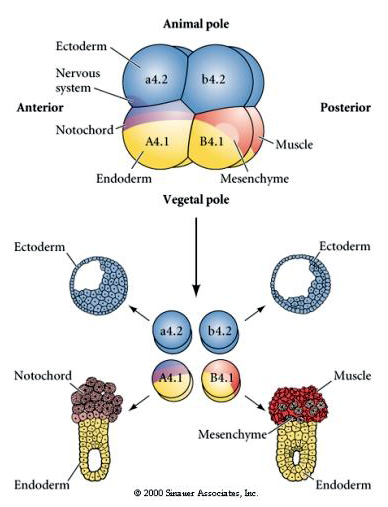
Itt láthatjuk az izolációs kísérletek eredményeit. Az izolált blasztomerek minden esetben csak a sejtsorsoknak azt a részhalmazát hozzák létre, amelyet normális esetben az ép embrióban termelnének. Az izolált blasztomerek nem szabályozzák sorsukat, hogy kompenzálják hiányzó szomszédjaikat. Az állati pólusú blastomerek, az a4.2 és a b4.2, csak ektodermális sejteket hoznak létre. Az A4.1 notochord- és endodermális sejteket, míg a B4.1 izom- és endodermális sejteket hoz létre. Az izolált blasztomerek egyike sem képes a normális embrió összes sejtkomponensét létrehozni.
A következő alábbi kísérletben egy tűvel manipuláljuk az egyenlítői hasadási síkot, hogy az a normálisnál vegetatívabb legyen, és most az állati pólusú b4.2 blasztomerek is megkapják a “sárga félhold” citoplazma egy részét. Amikor ezeket a blasztomereket izoláljuk, most néhány izomsejtet hoznak létre. Ez szépen bizonyítja, hogy a “sárga félhold” citoplazma képes meghatározni az izomsejtek sorsát, méghozzá sejtautonóm módon. 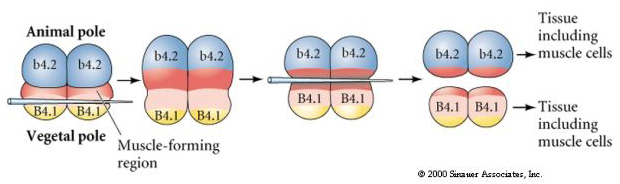
LOKALIZÁCIÓ ÉS REGULÁCIÓ A TENGERI URCHIN EGYBEN
A zselés csatorna határozza meg az állati pólus helyét, és tükrözi a pete korai polaritását. A hasadások korai mintázata nem függ a spermiumok belépési helyétől, hanem a petesejt belső polaritása/aszimmetriája határozza meg. Boveri (1901) leírta az állati-vegetális tengelyhez képest ortongonálisan elhelyezkedő szubekvatoriális pigmentcsíkot. Ezek a szemcsék a később az archenteron sejtjeibe kerülő citoplazma helyét is jelezték. Horstadius (1928) elkülönítette az állati és a vegetális blasztomereket, és kimutatta, hogy csak a vegetális blasztomerből keletkeznek mikromerek, gasztrulálódnak és csontvázat képeznek. Következtetése az volt, hogy a vegetális félben található citoplazmatikus faktorok szükségesek a mikromérák, a gasztruláció és az archenteron fromációjához,valamint a csontvázképződéshez. Emlékezzünk a korai hasadások mintázatára. A mikromerek a negyedik hasadás során (16 sejtes stádium) a vegetális pólusú blastomerek egyenlőtlen egyenlőtlen osztódásából keletkeznek.
Emlékezzünk a korai hasadások mintázatára. A mikromerek a negyedik hasadás során (16 sejtes stádium) a vegetális pólusú blastomerek egyenlőtlen egyenlőtlen osztódásából keletkeznek.
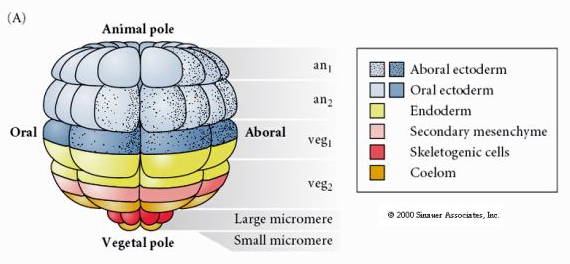 A 64 sejtes stádiumú tengeri sün blastula sors-térképét mutatja. Vegyük észre, hogy a mikromerek az elsődleges mesenchimasejtek, amelyekből a lárva váza (a pluteus stádiumú tüskék) keletkezik.
A 64 sejtes stádiumú tengeri sün blastula sors-térképét mutatja. Vegyük észre, hogy a mikromerek az elsődleges mesenchimasejtek, amelyekből a lárva váza (a pluteus stádiumú tüskék) keletkezik.
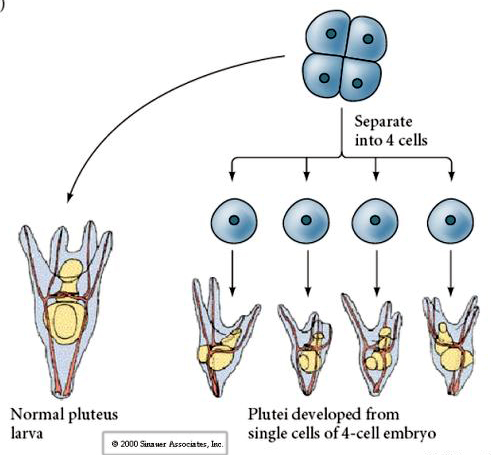 A négysejtes stádiumban, ha a blastomerek egymástól elkülönülnek, képesek “szabályozni” sorsukat, és 4 kis pluteus stádiumú lárvát hoznak létre.
A négysejtes stádiumban, ha a blastomerek egymástól elkülönülnek, képesek “szabályozni” sorsukat, és 4 kis pluteus stádiumú lárvát hoznak létre.
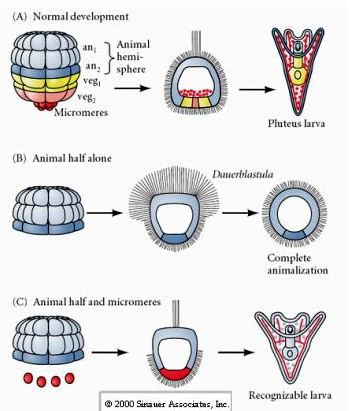 Ezzel szemben a későbbi stádiumokban, ha állati fél blastomereket izolálunk, azt tapasztaljuk, hogy azok csak egy “animalizált” dauerblasztulát hoznak létre, amely nem fejez ki semmilyen mezodermális vagy endodermális sejtsorsot. Az izolált vegetális fél-blasztomerekből ektodermális, mezodermális és endodermális sejtsorsokat kifejező lárvák jönnek létre, ami azt mutatja, hogy e sejtek sorsa szabályozható. Az izolált mikromerek (primer mesenchyma) a megfelelő számú sejtosztódáson mennek keresztül, és MINDIG menetrendszerűen tüskéket hoznak létre. Így a mikromerek a 16 sejtes stádiumban történő első megjelenésükkor véglegesen a csontvázképző mesenchimasejtek előfutáraiként specifikálódnak. A legfontosabb kísérletek a mikromerek és az állati pólusú blasztomerek együttes elhelyezése voltak, és annak kimutatása, hogy bár a mikromerek sorsa születésük idején “rögzített vagy meghatározott” volt, a mikromerek képesek voltak új sejtsorsot “indukálni” az állati pólusú blasztomerekből. A mikromérák képesek voltak endodermális és mezodermális sorsot indukálni az állati pólusú blasztomerekben! Így a “C”-ben szereplő késői kísérlet azt mutatja, hogy ha mikromérákat adunk egy állati fél blastomérához, akkor már képesek vagyunk egy felismerhető, endodermális, mezodermális és ektodermális sorsokat kifejező lárva kialakulását indukálni.
Ezzel szemben a későbbi stádiumokban, ha állati fél blastomereket izolálunk, azt tapasztaljuk, hogy azok csak egy “animalizált” dauerblasztulát hoznak létre, amely nem fejez ki semmilyen mezodermális vagy endodermális sejtsorsot. Az izolált vegetális fél-blasztomerekből ektodermális, mezodermális és endodermális sejtsorsokat kifejező lárvák jönnek létre, ami azt mutatja, hogy e sejtek sorsa szabályozható. Az izolált mikromerek (primer mesenchyma) a megfelelő számú sejtosztódáson mennek keresztül, és MINDIG menetrendszerűen tüskéket hoznak létre. Így a mikromerek a 16 sejtes stádiumban történő első megjelenésükkor véglegesen a csontvázképző mesenchimasejtek előfutáraiként specifikálódnak. A legfontosabb kísérletek a mikromerek és az állati pólusú blasztomerek együttes elhelyezése voltak, és annak kimutatása, hogy bár a mikromerek sorsa születésük idején “rögzített vagy meghatározott” volt, a mikromerek képesek voltak új sejtsorsot “indukálni” az állati pólusú blasztomerekből. A mikromérák képesek voltak endodermális és mezodermális sorsot indukálni az állati pólusú blasztomerekben! Így a “C”-ben szereplő késői kísérlet azt mutatja, hogy ha mikromérákat adunk egy állati fél blastomérához, akkor már képesek vagyunk egy felismerhető, endodermális, mezodermális és ektodermális sorsokat kifejező lárva kialakulását indukálni.
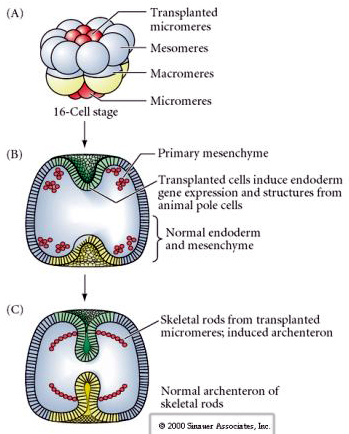 Az utolsó kísérletsorozat azt mutatja, hogy még egy normális embrióban is, ha mikromérákat ültetünk az állati pólus sapkájába, akkor másodlagos archenteront indukálhatunk és megváltoztathatjuk a normális axiális mintázódást. Ez ismét amellett érvel, hogy a mikromerek egy citoplazmatikus derminánsra tesznek szert, amely meghatározza a sejtsorsukat, és hogy ők adják azt az induktív jelet, amely a tengeri uchin embrió axiális struktúráit mintázza. A mikromerek sorsa nem változtatható meg, de a mikromerekből érkező jelek megváltoztathatják az összes többi blasztomer sorsát.
Az utolsó kísérletsorozat azt mutatja, hogy még egy normális embrióban is, ha mikromérákat ültetünk az állati pólus sapkájába, akkor másodlagos archenteront indukálhatunk és megváltoztathatjuk a normális axiális mintázódást. Ez ismét amellett érvel, hogy a mikromerek egy citoplazmatikus derminánsra tesznek szert, amely meghatározza a sejtsorsukat, és hogy ők adják azt az induktív jelet, amely a tengeri uchin embrió axiális struktúráit mintázza. A mikromerek sorsa nem változtatható meg, de a mikromerekből érkező jelek megváltoztathatják az összes többi blasztomer sorsát.
Horstadius: (1928, 1935) kísérletileg kimutatta, hogy egy 16 sejtes stádiumú embrióban a mikromerek kivételével a blasztomerek minden rétege különböző sorsot vesz fel, amikor a kiméra embriókban különböző helyekre ültetik át. Az archenteron a veg 1 blastomerekből fog kifejlődni, ha a veg 2 sejteket eltávolítjuk, és a mikromérákat a veg 1 réteggel érintkezve helyezzük el. Mikromerek hiányában a veg 2 blastomerekből archenteron és vázszerkezetek keletkeznek. Klasszikusan egy duális állati-vegetális gradiensre hivatkoztak ezen eredmények magyarázatára. Ezek az eredmények azonban csak arra utalnak, hogy a szomszédos blastomer rétegek között döntő induktív kölcsönhatások lépnek fel.
Az állati pólus közelében beültetett egyedi mikromérák gátolják az apikális tufaképződést, és egyes esetekben új embrionális tengelyeket indukálnak. A Veg 2 blastomerek az állati pólusú blastomerek mellé transzplantálva szintén a mikromerekhez hasonló változásokat indukálnak.
A transzplantációk általános eredménye: az adott blastomerek sorsát normális embriókban mindig befolyásolja a velük szomszédos különböző szomszédos sejtek appozíciója.
HYPOTÉZIS: Lokalizált anyai citoplazmatikus determinánsok határoznak meg bizonyos sejteket a normális embrióban, különösen a mikromérákat és a vegetális pólus közelében lévő archenteron előfutárait. Ezek a sejtek aztán induktív módon határozzák meg a szomszédos blasztomerek sorsát, amelyek viszont kölcsönhatásba lépnek szomszédaikkal. A blasztomerek közül sokan megtartják a normálisan kifejezettől eltérő potenciálokat, és ezek a blasztomerek egy ideig csak reverzibilisen meghatározottak, ahogyan azt egy olyan fejlődési rendszer megköveteli, amely nagymértékben az indukciótól függ.